非器质性失眠症患者氧化应激水平研究
王新源,陈 强*,潘 燕,李 玲,佘 琴
非器质性失眠症(失眠症)是以频繁而又持续的入睡困难和/或睡眠维持困难并导致睡眠感不满意为特征的睡眠障碍[1]。近年来,氧化应激与失眠的相互关系正逐渐成为人们研究的一个方向。氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过多,超出机体氧化物的清除能力,使得氧化与抗氧化系统失衡,细胞进入氧化应激状态,从而继发细胞损伤[2]。研究表明,大脑的自由基在日间醒觉状态时进行积累,在睡眠期间进行清除[3]。睡眠期间过多自由基的清除是通过减少自由基的生成及增加内源性抗氧化机制完成的,但氧化应激与失眠症之间的关系目前仍未阐明。本研究旨在分析失眠症患者氧化应激水平的变化,从而探讨其是否与失眠症的发病存在一定的关系。
1 对象与方法
1.1 研究对象 选择2015年1月—2017年3月在新疆精神卫生中心睡眠医学科就诊的失眠症患者78例作为失眠症组。纳入标准:(1)符合国际疾病分类标准编码(ICD-10)有关失眠症的诊断标准[4];(2)匹兹堡睡眠质量指数(Pittsburgh Sleep Quality Index,PSQI)总分≥7分[5];(3)年龄18~60岁;(4)认可并签署知情同意书,且能够理解和遵守研究的要求。排除标准:(1)脑器质性精神障碍者;(2)精神活性物质或非成瘾物质所致精神障碍者;(3)严重的躯体疾病或神经系统疾病者;(4)近期有创伤或近1周内有感染或发热者;(5)其他睡眠疾病及特殊的短睡者。
选择同期新疆精神卫生中心健康职工76例作为对照组。纳入标准:(1)年龄 18~60岁;(2)PSQI总分<7分;(3)认可并签署知情同意书。排除标准:(1)患有严重躯体疾病者;(2)患有符合ICD-10诊断标准的精神障碍或既往有精神障碍病史者;(3)现在或既往有物质依赖或物质滥用者;(4)三代直系亲属中有精神障碍者。本研究方案通过新疆精神卫生中心伦理委员会批准。
1.2 研究方法
1.2.1 入组诊断及量表评定 所有入组人员均经2名睡眠专科的高年资医师检查,按ICD-10中失眠症的诊断标准[4]同时诊断,PSQI评分按规范操作同时评定。PSQI由23个条目构成,分为7个成分,包括睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物及日间功能障碍,每个成分按0~3分计分,各成分评分相加为PSQI总分,总分0~21分,总分越高提示睡眠质量越差,临床以PSQI总分≥7分为睡眠障碍[5]。采用自制一般资料调查问卷收集两组的一般资料,包括性别、年龄、吸烟情况、饮酒情况。
1.2.2 实验室检查
1.2.2.1 血清样本 所有受试者在晨起空腹安静状态下,用高压蒸汽灭菌后的10 ml试管抽血样品至少5 ml,室温静置,3 h内离心,离心半径15 cm,2 000 r/min离心20 min,分离血清2~3 ml,置-80 ℃医用冰箱备用。
1.2.2.2 试剂及检测方法 过氧化氢酶(hydrogen pemxidase,CAT),型号A007-1试剂盒;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX),型号A005试剂盒;丙二醛(malondiadehycle,MDA),型号A003-1试剂盒;超氧化物歧化酶(superoxide dismutase,SOD),型号A001-3试剂盒;均购自南京建成科技有限公司。所有样本由同一人测定,测定过程严格按照试剂盒提供的实验方法进行操作,每个样本测定3次,取平均值。
1.3 统计学方法 采用SPSS 17.0统计软件对数据进行统计分析。呈正态分布的计量资料以s)表示,方差齐时组间比较采用t检验,方差不齐时组间比较采用t'检验。计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 失眠症组与对照组一般资料比较 两组性别、年龄、吸烟情况、饮酒情况比较,差异无统计学意义(P>0.05,见表1)。
2.2 失眠症组与对照组PSQI评分比较 失眠症组PSQI总分及各成分评分均高于对照组,差异有统计学意义(P<0.001,见表 2)。
2.3 失眠症组与对照组氧化应激指标比较 失眠症组CAT、GSH-PX、SOD的活性水平低于对照组,差异有统计学意义(P<0.001);失眠症组MDA的活性水平与对照组比较,差异无统计学意义(P>0.05,见表3)。
表3 失眠症组与对照组氧化应激指标比较s)Table3 Comparison of oxidative stress indices between nonorganic insomnia group and control group
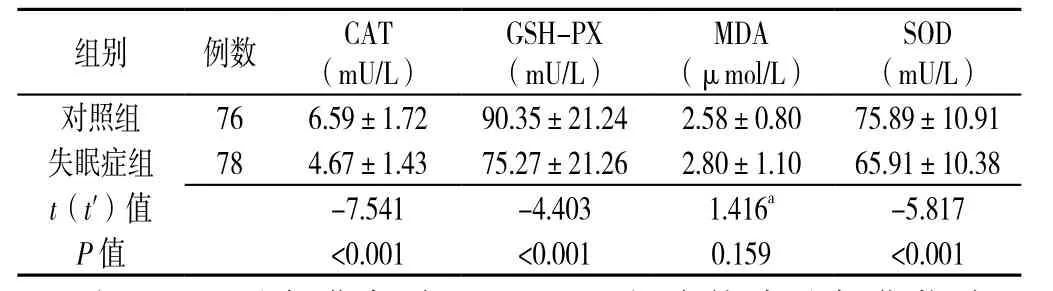
表3 失眠症组与对照组氧化应激指标比较s)Table3 Comparison of oxidative stress indices between nonorganic insomnia group and control group
注:CAT=过氧化氢酶,GSH-PX=谷胱甘肽过氧化物酶,MDA=丙二醛,SOD=超氧化物歧化酶;a为t'值
?
3 讨论
目前认为慢性失眠是过度警觉性障碍,与下丘脑-垂体-肾上腺素轴过度活动有关[6]。在生理状态下,氧化应激与抗氧化酶防御系统处于平衡状态。研究表明,氧化应激是抑郁症神经元的凋亡、神经退行性改变、神经元可塑性改变的重要原因[7];氧化应激可导致细胞发生线粒体等多方面的变化,修饰碱基,诱导其氧化损伤,造成复制及自我修复时发生错配[8]。脂质过氧化产物对细胞具有毒性作用,可诱发中枢神经系统疾病[2]。抗氧化酶防御系统包括CAT、GSH-PX及SOD,这些酶通过清除自由基保护机体免遭过氧化损伤,有清除氧化物、保护机体的作用。
既往研究显示氧化应激反应的影响因素很多,如感染、过敏、应激等躯体情况[9]。自由基及抗氧化酶水平的变化与年龄、生活习惯(如吸烟、饮酒)等因素有关[10]。本研究两组性别、年龄、吸烟情况、饮酒情况无差异,可排除这些因素的干扰。动物睡眠剥夺实验表明,睡眠剥夺与氧化应激关系密切,睡眠剥夺可引起大脑的氧化损伤。由于细胞膜存在高容量的不饱和脂肪酸和较低的抗氧化能力,大脑对氧化损伤极为敏感[11]。短期(1~2周)的睡眠剥夺与任何脑组织的蛋白氧化及脂质过氧化均没有关系[12-13]。大脑能对应激做出有效的反应,从而可以避免氧化损伤[14]。大脑细胞抗氧化成分水平的降低,可能引起外周血液抗氧化成分水平的降低[15]。本研究失眠症组患者失眠时间均在4周以上,结果表明除MDA外,CAT、GSH-PX及SOD的活性水平均降低,提示大脑存在氧化损伤。而失眠症组PSQI总分及各成分评分均高于对照组,提示失眠可能是大脑氧化损伤的危险因素,充分的睡眠有益于大脑功能恢复。
本研究存在一些不足:(1)缺乏多导睡眠(PSG)的筛查,此方法可对失眠症患者的临床诊断提供客观依据。(2)本研究结果未排除可能导致失眠症患者氧化应激水平升高的其他潜在影响因素,如大脑氧化损伤与失眠是否存在双向关系,是否可通过降低颅内氧化水平改善睡眠。
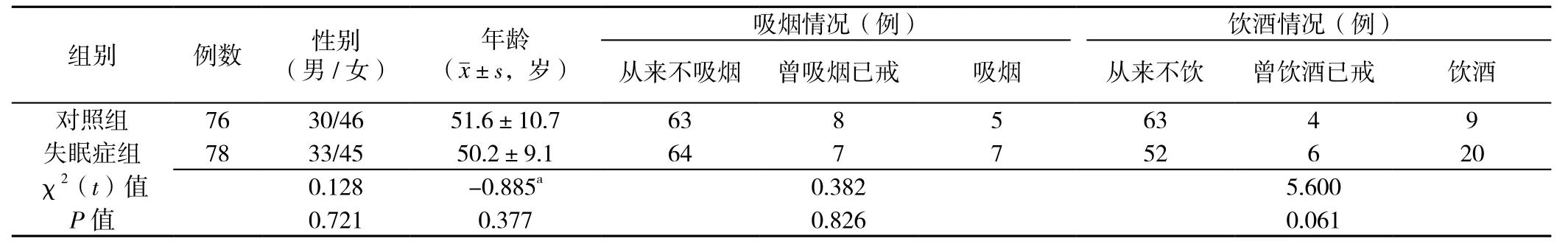
表1 失眠症组与对照组一般资料比较Table1 Comparison of general personal data between nonorganic insomnia group and control group
表2 失眠症组与对照组PSQI评分比较s,分)Table2 Comparison of PSQI score between nonorganic insomnia group and control group
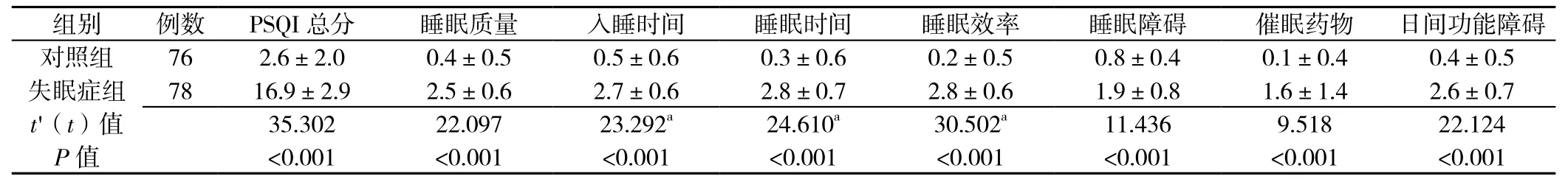
表2 失眠症组与对照组PSQI评分比较s,分)Table2 Comparison of PSQI score between nonorganic insomnia group and control group
注:PSQI=匹兹堡睡眠质量指数;a为t值
?
作者贡献:陈强负责文章的构思与设计、研究的实施与可行性分析、文章的质量控制及审校、论文撰写及修订;王新源、潘燕负责数据整理、统计学处理、结果的分析与解释;李玲、佘琴负责数据收集。
本文无利益冲突。

