迷迭香酸的添加对明胶凝胶体系的影响
张晓洁,马良,马明思,郑红,孙艺,张宇昊
(西南大学 食品科学学院,重庆,400715)
明胶是由动物皮肤、骨、肌膜、肌腱等结缔组织中的胶原部分降解而成的天然生物高分子材料之一,因其具有良好的胶凝性、溶胀性和成膜性等,被广泛应用于食品、材料、医药和摄影行业[1]。明胶属于热可逆型凝胶,环境温度的升高会降低明胶的凝胶特性,进而影响产品品质,这大大限制了明胶在食品工业的应用范围。因此如何改善明胶的凝胶特性成为该领域研究的热点。
目前,明胶凝胶特性的改善有化学和物理方法,物理方法主要包括紫外照射、γ辐照和超高压[2],KULISIEWICZ等[3]研究发现将明胶于200MPa下作用30min后,与对照相比,明胶的储能模量提高到四倍,凝胶特性也得到改善。物理方法虽不会引入外源性物质,但存在明胶复性和均一性较差等问题。化学方法主要是将戊二醛、碳化二亚胺、谷氨酰胺转氨酶和京尼平等化学交联剂加入到明胶中,通过与明胶链之间的交联作用来改善凝胶网络结构,使得明胶性能得以提高[4-5],MOHTAR等[6]将戊二醛加入鱼皮明胶中,发现明胶的凝胶强度和储能模量都有所提高,但是有些交联剂具有毒性,它们在食品和医药上的应用是不可接受的。近年来,将天然酚类提取物加入到明胶中,通过明胶与酚类物质之间的共价或非共价相互作用来提高明胶的机械和流变性能已得到广泛应用[7]。YASIN等[8]将柠檬草提取物加入鸡脚明胶中,发现明胶的凝胶强度、热稳定性和弹性模量都有所提高;TEMDEE等[9]将富含丹宁酸的腰果树皮提取物加入到乌贼皮明胶中,明胶的凝胶强度有显著性提高。
GMEZESTACA等[10]将迷迭香提取物加入到金枪鱼皮中,发现明胶凝胶强度和损耗模量都有提高,但由于迷迭香提取物为混合物,无法明确其改善明胶凝胶特性的成分及改善机制。迷迭香酸(RosA)是迷迭香提取中主要成分之一,属于天然多酚化合物[11],具有良好的抗氧化性、抗菌、抗炎和抗病毒活性[12]。本研究以RosA和兔皮明胶为原料,将不同质量浓度的RosA加入明胶中,通过荧光光谱、凝胶强度、流变学性能和圆二色谱等方法研究明胶与RosA之间的相互作用,分析该相互作用对明胶的影响,为提高明胶的理化性质和后期明胶-RosA可食性膜的制备提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
兔皮,购于重庆阿兴记食品有限公司,原料获取后洗净冻藏于-20 ℃冰箱中备用。Ca(OH)2、HCl、Na2S、Nacl、(NH4)2S2O8、二甲基硅油和十二烷基硫酸钠,成都市科龙化工试剂厂;迷迭香酸(纯度97%),上海阿拉丁生化科技股份有限公司;β-巯基乙醇(2-ME)、三羟甲基氨基甲烷(Tris)、考马斯亮蓝R-250和四甲基乙二胺(TEMED),加拿大BIO BASIC公司;质量分数30%丙烯酰胺,北京索莱宝科技有限公司;标准蛋白为(分子质量 10~200 kDa),加拿大Fermentas公司。其中Tris、考马斯亮蓝R-250、30%丙烯酰胺为优级纯,其他试剂均为分析纯。
1.2 主要仪器设备
JA3003B型电子天平,上海精天电子仪器有限公司;PE20型实验室pH计,上海梅特勒-托利多仪器有限公司;HX-1005恒温循环器,郑州长城科工贸有限公司;MOS-500圆二色谱仪,法国Bio-Logic公司;F-4500 荧光分光光度计,日本日立公司;Power PacTM基础电泳仪,美国Bio-Rad公司;G: BOX EF型凝胶成像系统,英国Syn-gene公司;DHR-1流变仪,美国TA公司;TA.XT2i物性测定仪,英国Stable Micro System公司。
1.3 试验方法
1.3.1 兔皮明胶的制备
兔皮明胶的提取方法主要参照杨晖等[13]报道的基础上,具体工艺如下:
新鲜兔皮→去除皮下脂肪→脱毛→清洗、剪切→除杂蛋白→清洗→稀酸处理(质量分数为1%的盐酸)→提胶→过滤(用1.6 μm孔径的滤膜真空过滤)→热风干燥→成品明胶。
所得明胶的提取率为(80.25±1.71)%,纯度为(93.55±1.42)%。
1.3.2 样品的制备
称取2 g明胶于烧杯中,加入20 mL蒸馏水于60 ℃下溶解,分别配制质量浓度为0、2.4、4.5、9.0和15 g/L的RosA溶液加入明胶溶液中,制成RosA的最终浓度为0、0.8、1.5、3.0和5.0 g/L的明胶溶液,明胶的最终浓度为66.7 g/L。以上溶液充分搅拌混匀后,于60 ℃下保温30 min得到明胶-RosA共混溶液,之后在室温下冷却成胶。
1.3.3 荧光光谱分析
按照1.3.2方法配制一系列所需浓度的RosA-明胶共混溶液。用蒸馏水将共混液稀释成明胶浓度为1 mg/mL,相应的RosA溶液浓度为0~0.07 mg/mL,分别于298、308和318 K下测定荧光光谱。荧光光谱条件为:激发波长λex=278 nm,发射波长λem=305 nm,波长范围280~400 nm,入射和发射狭缝宽均为5 nm。同时,为了明确RosA对明胶的荧光淬灭方式,采用Stern-Vomler方程计算[14]。
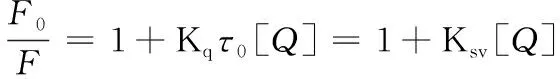
(1)
式中:F0和F分别为未加和加入RosA时明胶的荧光强度;[Q]为RosA的浓度,Ksv为Stern-Vomler猝灭常数,Kq为双分子作用的动态猝灭速率常数,τ0为荧光分子的平均寿命,一般为10-8s[15]。
1.3.4 凝胶强度的测定
参照GB 6783—2013[16]中凝胶强度的测定方法,将1.3.2配制的样品在(10±0.1)℃恒温循环器中凝冻16~18 h,采用TA.XT2i物性测定仪测定凝胶强度。用SMSP/0.5圆柱型探头以1 mm/s的下压速度压入凝胶4 mm,得出凝胶强度数值。以上试验重复3次。
1.3.5 流变性能的测定
采用DHR-1流变仪测定1.3.2配制的样品的黏弹性。流变仪的参数设置主要参照陈丽清等[17],测试夹具40 mm Al平板,板间距为0.10 mm,样品于流变仪上由40 ℃冷却到5 ℃,在5 ℃下保持2 min,然后由5 ℃加热到40 ℃,测定储能模量G′和损耗模量G″随温度扫描的变化并计算相角δ,在动态黏弹性分析中,通常以tanδ= 1作为明胶胶凝和熔化温度的转折点,分别对应于胶凝温度和熔化温度。
1.3.6 聚丙烯酰胺凝胶电泳分析(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)
将1.3.2配制的样品用蒸馏水稀释成明胶浓度为2 mg/mL,按体积比 4∶1添加样品缓冲液充分混匀,沸水浴5 min,冷却后上样[9]。上样量为10 μL,其中分离胶和浓缩胶的浓度分别为10%和5%,电流初始设置为 15 mA,待溴酚蓝跑到分离胶中后,电流调至 25 mA,电泳时间约1 h。电泳结束后用考马斯亮蓝R-250进行染色,2 h后用脱色液于30 ℃下振荡脱色,直至背景蓝色被脱净,然后用凝胶成像系统拍摄电泳图谱并用Gene Tools数据处理软件进行分析。
1.3.7 圆二色谱分析(circular dichroism, CD)
将1.3.2配制的样品用蒸馏水稀释成明胶浓度为1 mg/mL,并进行圆二色谱分析,每个实验重复3次。测定波长范围为190~240 nm,反应条件为25 ℃,比色皿光程为1 mm,扫描速度为50 nm/min,记录椭圆率并用圆二色软件CDPro计算蛋白二级结构组成。
1.3.8 数据分析
数据分析采用Origin 8.6和SPSS 17.0软件分析,每次试验设置3个平行实验,数据以平均值±标准偏差表示。
2 结果与分析
2.1 荧光光谱分析
在构成明胶分子的18种氨基酸中,只有酪氨酸有荧光产生,其中酪氨酸的发射波长在304 nm左右。如图1所示,RosA的加入造成荧光淬灭,使得荧光强度降低,说明两者可能存在相互作用。通常来讲,荧光淬灭可以分为动态淬灭和静态淬灭,动态猝灭依赖于扩散,即温度的上升能够增加分子的有效碰撞,因此Ksv也会随着温度的升高而增大,说明荧光淬灭主要是由分子碰撞造成,未产生分子间相互作用;而静态猝灭是由于猝灭分子和荧光发色团结合而生成了一种基态复合物,随着温度的升高基态复合物的稳定性将会降低,因此Ksv将会随着温度的升高而减小[18],说明分子间产生相互作用。
图1 RosA对明胶荧光光谱的影响Fig.1 Effects of RosA on the fluorescence spectra of gelatin 注:λex=278 nm,明胶浓度为1 mg/mL,a-g代表加入的RosA浓度 为0、0.004、0.007、0.01、0.02、0.04、0.07 mg/mL。
由图2和表1可知,随着温度的升高,Ksv在逐渐减少,说明明胶与RosA之间发生了相互作用,形成复合物,此外,Kq值(表1)的数量级远大于动态猝灭的最大猝灭速率常数2.0×1010L/(mol·s),同样说明两者之间为静态猝灭方式,产生了分子间的相互作用。
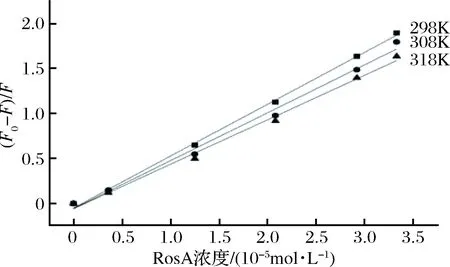
图2 不同温度下RosA对明胶荧光光谱的影响Fig.2 Effects of RosA on the fluorescence spectra of gelatin at different temperatures
表1 三种温度下RosA与明胶相互作用的猝灭常数 (Ksv)和速率常数(Kq)Table 1 The stern-volmer quenching constants and rate constants of gelatin quenched by RosA at different temperatures
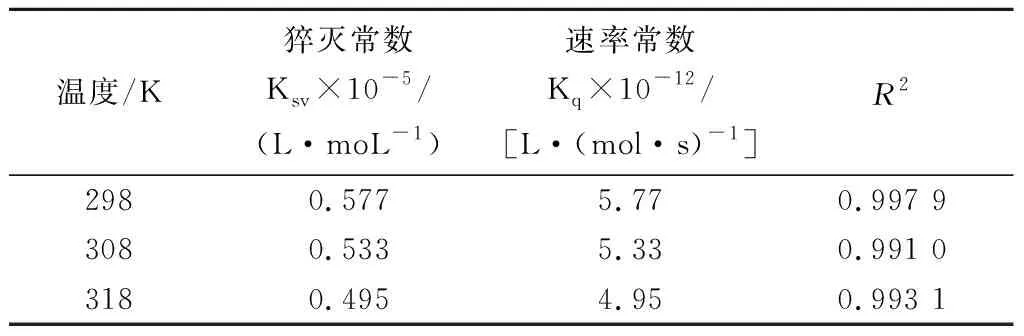
温度/K猝灭常数Ksv×10-5/(L·moL-1)速率常数Kq×10-12/[L·(mol·s)-1]R22980.5775.770.997 93080.5335.330.991 03180.4954.950.993 1
2.2 凝胶强度
如图3所示,当RosA质量浓度为0.8 g/L时,凝胶强度无显著性变化(p>0.05),随着RosA质量浓度继续增大,明胶凝胶强度显著增加(p<0.05),当浓度为5 g/L时,凝胶强度由459.547 g增至548.01 g,与GMEZESTACA等[10]研究结果一致。GMEZESTACA等[10]将迷迭香提取物加入到鱼皮和牛皮明胶,凝胶强度都有显著提高,这归因于明胶与酚类物质之间的非共价相互作用。RosA的添加可以增强明胶凝胶强度,可能是因为一分子RosA中含有的4个酚羟基和1个羧基,可能分别与明胶分子中N-H基团结合形成氢键,从而起到了明胶分子间“桥梁”的作用,增加了凝胶体系的紧密度,使得凝胶强度增加[19]。也就是说明胶与酚类之间的非共价作用在其中起到主导。KAEWDANG等[20]研究发现,添加一定浓度的椰子壳提取物可以显著提高金枪鱼鳔明胶的凝胶强度,这是由于椰子壳中主要物质是丹宁酸,丹宁酸与明胶之间主要通过氢键或疏水作用产生相互作用,有助于形成更强的凝胶网络,使得凝胶强度增加,该结论与本研究分析一致。
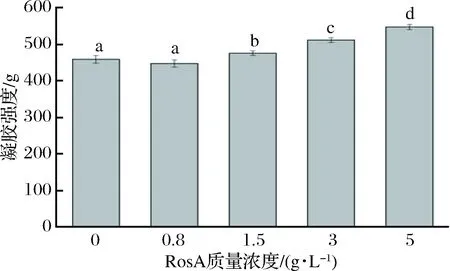
图3 含有不同浓度RosA的明胶的凝胶强度Fig.3 Gel strength of gelatin incorporated with RosA at different concentrations
2.3 流变性能
如图4所示,在凝胶体系下(低温),RosA的添加可以增加明胶的G′和G″,但G′和G″随RosA的添加量的增加变化趋势不同,随着RosA质量浓度的增加,明胶样品的G′呈先增加后下降的趋势,G″呈现单纯上升趋势。MOHTAR等[6]研究表明将咖啡酸加入到鱼皮明胶中,明胶样品的G′随着咖啡酸浓度的增加先升高后降低;GMEZESTACA等[10]研究表明将高浓度的迷迭香提取物加入到金枪鱼皮明胶中,明胶样品的G″有明显提高,这是由于明胶部分肽链在形成凝胶过程中并没有直接参与到蛋白凝胶基质中,而是与酚类物质之间发生了相互作用。这些均与本研究结果一致。
这可能是因为当RosA添加量达到5 g/L时,由于大量的酚羟基和羧基造成了明胶链的凝聚,形成了明胶-RosA的络合物,此时明胶凝胶的透明度降低可以说明这一推测的合理性。络合物的形成可能影响了明胶分子形成类三螺旋结构的形成,从而降低了凝胶体系的弹性,造成G′的降低。但是由于RosA为连接的蛋白聚集体的大量存在,赋予了凝胶更好的黏性,使得G″进一步升高。
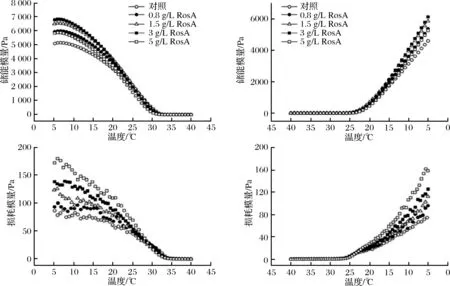
图4 含有不同浓度RosA明胶在升温和降温过程中的储能模量和损耗模量的变化Fig.4 Evolution of G′ and G″ during heating and cooling processes of gelatin incorporated with RosA at different concentrations
由图5可知,RosA的加入并没有显著性地改变明胶样品的的胶凝和熔化温度,这说明明胶在形成凝胶和溶胶过程中,RosA并未参与类三螺旋结构的形成,GMEZESTACA等[10]将迷迭香提取物分别加入到鱼皮和牛皮明胶中,发现明胶样品的胶凝和熔化温度并未发生显著性变化,说明添加迷迭香提取物对明胶类三螺旋结构的形成只有微小干扰;GMEZGUILLÉN等[21]将默塔叶提取物加入到鱼皮明胶中也得到相似的结果,含有默塔叶提取物的明胶与单纯明胶都具有相同的熔化温度。此结果与本研究结果一致。
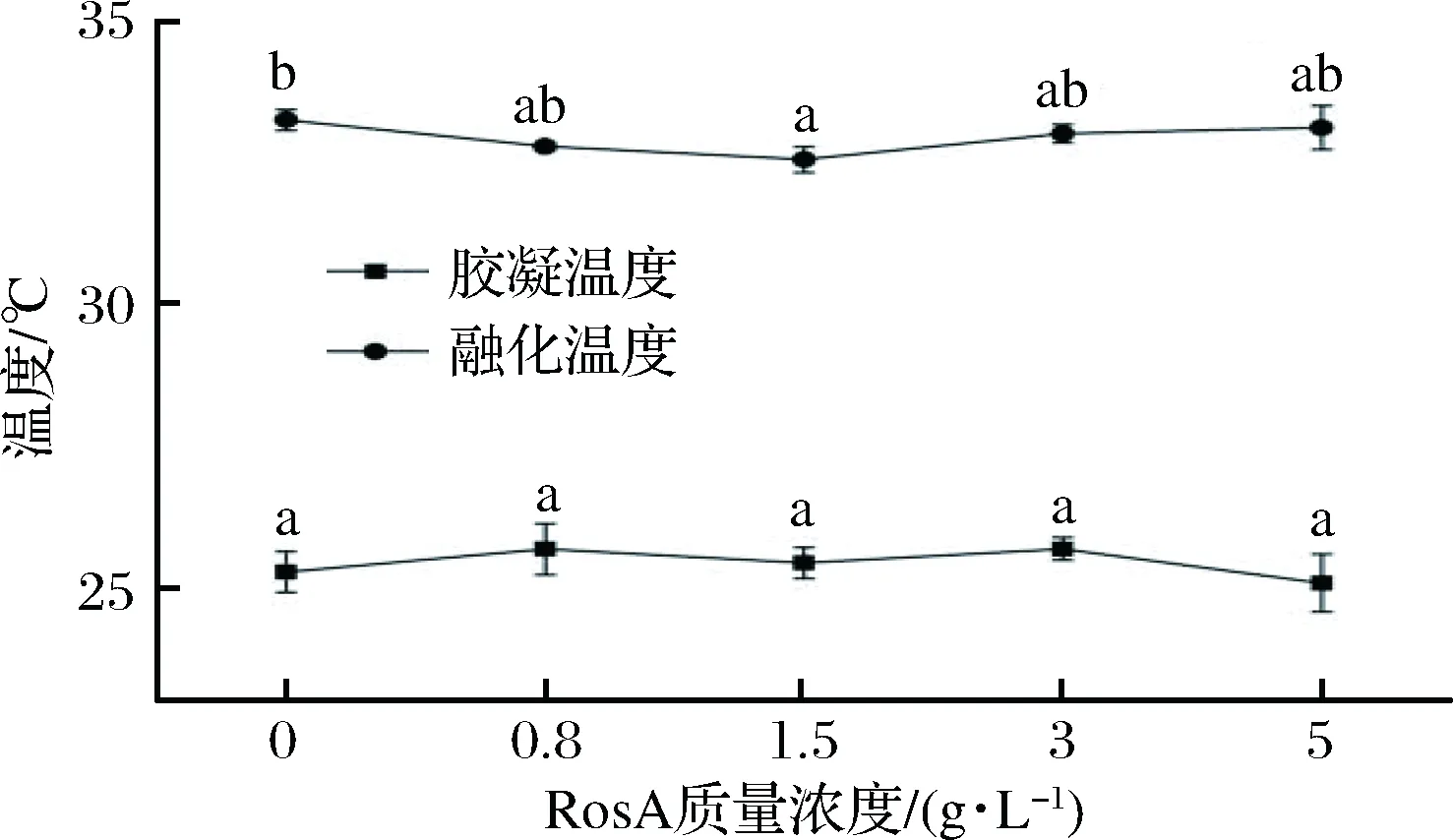
图5 含有不同浓度RosA明胶的胶凝和熔化温度Fig.5 Gelation and melting temperature of gelatin incorpo- rated with RosA at different concentrations
2.4 凝胶电泳分析
如图6所示,不同的明胶样品均含有明显的β、α1和α2链,与对照相比,含有RosA的明胶样品并无明显区别,这是因为RosA与明胶之间主要是形成氢键等非共价作用,在电泳条件下,全部被SDS破坏。KAEWDANG等[21]将一定浓度的椰子壳提取物(主要物质是丹宁酸)加入到金枪鱼鳔明胶中,同样发现电泳图谱并无明显区别,这是因为椰子壳提取物与鱼鳔明胶之间主要发生氢键或疏水相互作用,SDS溶液能够破坏这些弱键,使得图谱没有明显差异。
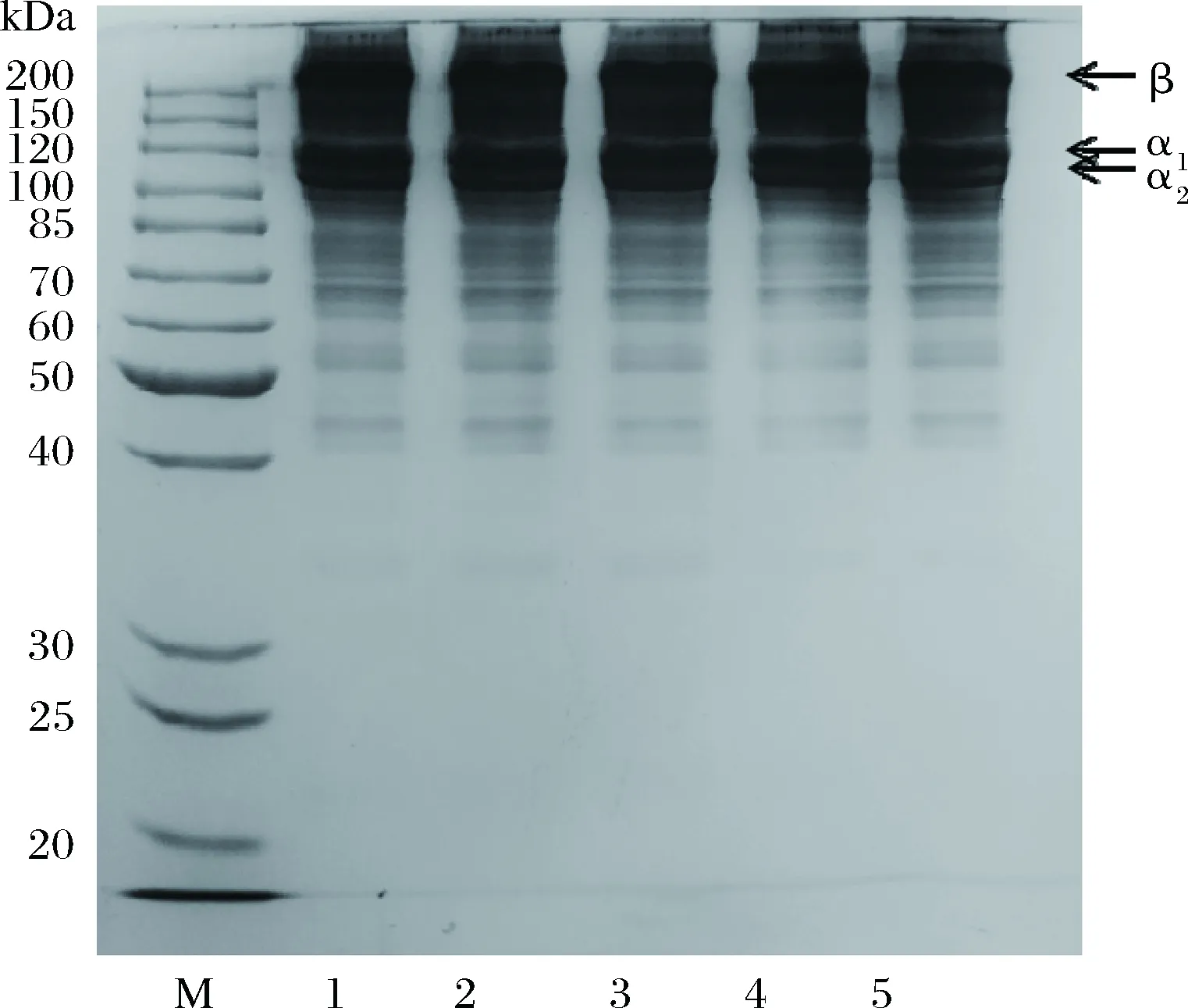
图6 含有不同浓度RosA明胶的SDS电泳图谱Fig.6 SDS-PAGE pattern of gelatin incorporated with RosA at different concentrations 注:M代表Maker,1,2,3,4,5分别代表迷迭香酸质量浓度为 0、0.8、1.5、3、5 g/L。
2.5 圆二色谱分析
圆二色谱法可以有效测定蛋白质的二级结构而广泛应用于研究蛋白质与小分子物质之间的相互作用。研究表明[22],明胶通常在198 nm处有一负峰,在220 nm处有一正峰,不同的出峰位置可能与明胶的种类和提取方法有关。此外,在208 nm和222 nm处负特征峰与α螺旋结构的存在有关,在195 nm处正峰和216 nm处负峰与β折叠有关[23]。
由图7和表2可知,所有的明胶样品均在210 nm和222 nm处有明显的负峰和正峰,RosA的加入并没有使明胶样品的正负吸收峰位置发生偏移,但随着RosA浓度的增加,吸收峰的强度在逐渐减少。
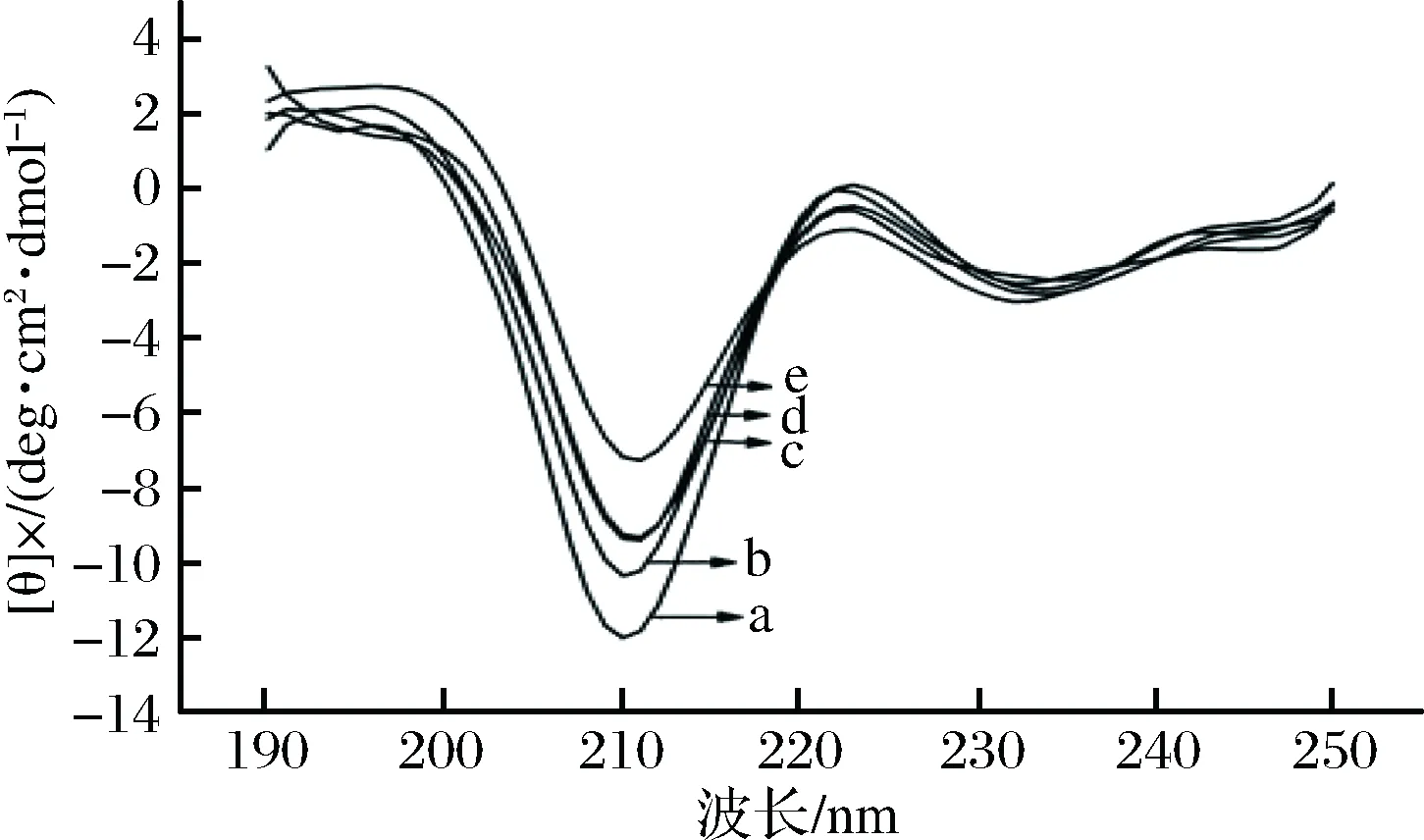
图7 含有不同浓度RosA明胶的圆二色谱图Fig.7 CD spectra of gelatin incorporated with RosA at different concentrations 注:a-e分别代表RosA质量浓度为0、0.8、1.5、3、5 g/L。
RosA的加入使得α螺旋结构部分解旋,α螺旋含量降低,β折叠含量升高,这可能是因为RosA的加入使得明胶肽链结构部分展开。α螺旋主要靠分子内的羰基氧和氨基氢之间形成的氢键维持稳定[24], RosA含有的酚羟基和羧基与明胶的氨基之间形成新的氢键,进而破坏明胶原有的氢键平衡,从而导致α螺旋的解旋,同时伴随着β折叠的形成。
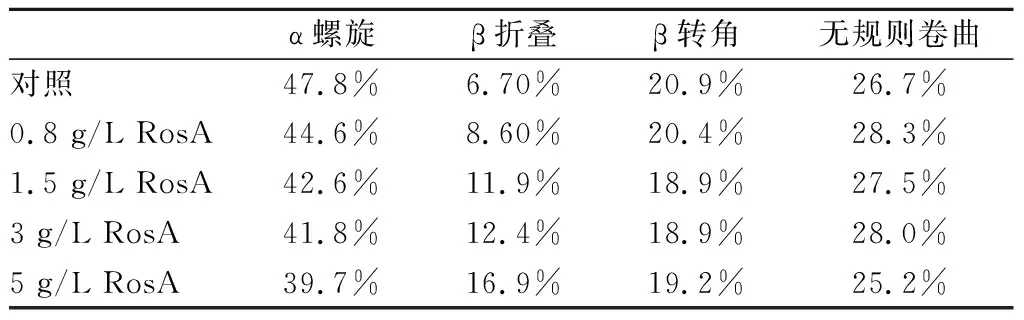
表2 含有不同浓度RosA明胶的二级结构分析Table 2 Secondary structural analysis of gelatin incorpo- rated with RosA at different concentrations
3 结论
本研究分析了兔皮明胶与RosA之间的相互作用。研究发现RosA能对明胶产生很强的猝灭效果,且猝灭机制为生成复合物的静态猝灭。RosA可以提高明胶的凝胶强度,使明胶的黏性和弹性都有所增加,但对胶凝和熔化温度没有明显影响,这可能是由于RosA与明胶之间通过氢键发生作用,并在明胶分子间起到“桥梁作用”,但对于明胶类三螺旋结构的形成没有明显影响。SDS-PAGE结果也证实了经过前处理后,RosA与明胶的相互作用全被破坏,使得电泳图谱没有明显区别,说明它们之间相互作用为非共价作用。圆二色谱分析表明,随着RosA的添加量增加,明胶结构展开,α螺旋含量减少,β折叠含量增加。

