约氏乳酸杆菌中一种新的阿魏酸酯酶基因的克隆表达与性质研究
张 强, 白亚军, 蔡宇杰*, 郑晓晖
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.西北大学 生命科学学院,陕西 西安710069)
阿魏酸酯酶(Feruloyl esterases,FAEs),另一名称是肉桂酸酯酶,它属于羧酸酯水解酶类,通常植物细胞中的阿魏酸与多糖连接的酯键就是由它水解的,释放出游离的阿魏酸。它可以裂解植物细胞壁中的酯键,破坏细胞壁结构,从而可以创造出更多的生物资源,因此在生物资源开发方面具有一定的应用价值。自从1987年第一次从Streptomyces olivochromogenes中发现以来,相继已经发现有多种真菌,细菌都能分泌FAEs。目前已知的产FAEs的微生物主要有乳酸杆菌 (Lactobacilli), 黑曲霉(Aaspergillusniger), 链 霉 菌 (Streptomyces avermitilis),黄柄曲霉(Aspergillus flavipes)等[1]。 并且大部分的FAEs是从真菌中分离出来的[2]。
自1991年第一个FAEs纯化以来,现如今已有30多种FAEs得到了纯化[3]。纯化的FAEs在分子量、等电点、最适反应条件等物理化学特性方面都各不相同[4]。有报道表明单糖和双糖不支持微生物产FAEs,含有阿魏酸酯键的底物能诱导产FAEs。
植物细胞壁之所以这么坚硬,就是阿魏酸在其中起着举足轻重的作用。它可以在半纤维素与半纤维素之间,木质素与木质素之间,半纤维素与木质素之间形成连接,形成一个网状的骨架结构[5]。此外,释放的阿魏酸是一种生理活性物质,对它可以进行进一步的加工处理,开发出更多的药用或保健等经济产品[6]。
本文从实验室保藏菌中筛选产阿魏酸酯酶的乳酸杆菌,对其基因组序列进行对比分析。并利用大肠杆菌工程菌异源表达可能的阿魏酸酯酶基因以验证其酶活活性,对其分离纯化后,进一步研究其酶学性质。
1 材料与方法
1.1 材料和仪器
1.1.1 菌株和质粒 菌株为约氏乳酸杆菌株,Lactobacillus johnsoniiNBC455(由江南大学食品学院陈卫课题组惠赠)。大肠杆菌E.coliBL21(DE3)、E.coliDH5α、质粒 pColdⅡ。
1.1.2 培养基 LB液体培养基(g/L):胰蛋白胨10,酵母粉 5,NaCl 10,pH 7.0~7.4,115 ℃灭菌 20 min,LB平板需添加额外2%的琼脂。
LB-氨苄青霉素(Amp)培养基(g/L):LB 培养基灭菌冷却至40~50℃后加入Amp,终质量浓度为0.1 mg/L。
1.1.3 主要试剂 基因工程操作用酶,包括限制性内切酶 (XbaⅠ、BamHⅠ)、T4DNA 连接酶、DNA 聚合酶、核酸电泳DNA marker、核酸电泳 Loading Buffer、标准分子量蛋白购于大连TaKaRa公司;氨苄青霉素、异丙基硫代半乳糖(IPTG)、引物、柱式细菌DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒、质粒小量纯化试剂盒Plasmid Purification Kit均从上海生工购买;其余试剂均为国产分析纯。
1.1.4 主要仪器 超净工作台(苏州净化设备有限公司);立式自动压力蒸汽灭菌锅(厦门致微仪器有限公司);高压细胞破碎仪(宁波新芝生物科技有限公司);HYL-C组合式摇床(太仓市强乐实验设备有限公司);DYY-8C型电泳仪 (北京市六一仪器厂);台式高速冷冻离心机(TGL-16M湘仪);AKTA avant蛋白纯化系统(美国通用公司);凝胶成像仪(美国Bio-Rad);PCR 仪(美国 Applied Biosystems);高效液相色谱PerkinElmer Series225(广东省设备厂);扫描型紫外可见分光光度计 UV-3900(日本日立)。
1.2 方法
1.2.1 约氏乳酸杆菌总DNA的提取 (1)在3 mL LB培养基中加3 μL氨苄青霉素,加3 μL甘油管中的菌液,37℃培养 12 h。(2)取2 mL菌液,12 000 r/min离心2 min,弃上清。(3)按柱式细菌DNAout试剂盒的方法提取基因组DNA,保存在-20℃冰箱中。(4)通过琼脂糖凝胶电泳鉴定其质量和纯度,用紫外分光光度计测定其浓度大小。
1.2.2 设计引物及PCR扩增 通过序列比对,根据保守氨基酸序列,设计引物,划线处的两个酶切位点分别为SacⅠ和XbaⅠ。
引 物 1:5'GCCGGAGCTCATGAGAACTGGTAC TAAAATTATTA 3'
引 物 2:5'GCCGTCTAGACTATTCACCTTTAAA CCTACCA 3'
以Lactobacillus johnsoniiNBC455基因组DNA为模板进行PCR扩增,1%琼脂糖凝胶电泳,切胶纯化回收,电泳验证一条带。
1.2.3 PCR产物及质粒的双酶切和连接 将质粒和PCR产物进行双酶切。质粒酶切体系:10×cut buffer 5 μL,质粒 10 μL,SacⅠ和 XbaⅠ各 0.5 μL,无菌水 34 μL 共 50 μL。 PCR 产物酶切体系:10×cut buffer 3 μL,DNA 4 μL,NdeⅠ和XbaⅠ各 0.5μL,无菌水 2 μL 共 30 μL。 37 ℃水浴中切 1 h。将DNA片段克隆到pCold-ⅡVector上,并转化到E.coli DH5α感受态细胞中。连接体系:10×DNA ligase buffer 2.5 μL,DNA 片段 8 μL,载体 DNA 2 μL,T4DNA ligase 1 μL,无菌水 11.5 μL 共 25 μL。16 ℃水浴下连接12~16 h。
1.2.4 制备大肠杆菌感受态 (1)接种E.coli DH5α和 BL21(DE3)分别于含有20 mL LB培养基的250 mL摇瓶中,37℃、200 r/min培养过夜。(2)按1%接种量接种于50 mL LB培养基中,37℃培养至 OD600约 0.6(约 2~3 h)。(3)将菌液转移到 50 mL预冷的离心管中,冰上放置30 min,8 000 r/min、4℃离心 5 min。(4)弃上清,加入 5 mL预冷的0.1 mol/L CaCl2溶液,使菌体悬浮,冰上放置20 min,8 000 r/min、4 ℃离心 5 min。重复 2次。(5)弃上清,加入1.5 mL预冷的0.1 mol/L CaCl2溶液,含有15%的甘油,轻轻悬浮菌体,然后100 μL分装到1.5 mL离心管中,-70℃冰箱保藏备用。
1.2.5 重组大肠杆菌的诱导表达 (1)重组质粒导入BL2L大肠杆菌感受态中。(2)加入1 mL不含抗生素的LB培养液,37℃摇1 h使菌复苏。(3)取50 μL涂布在含氨苄的LB琼脂平板培养基上。(4)37℃培养12 h左右。(5)挑平板上菌接到小试管37℃培养过夜。(6)部分保存甘油管,加500 μL到50 mL摇瓶,之前加50 μL氨苄。37℃培养2.5 h,15℃下静置0.5 h,在超净工作台中加20 μL的IPTG。15℃下培养24 h(摇床均设置为250 r/min)。空载体转化的BL21同时诱导表达。(7)离心收集菌体(8 000 r/min,5 min),20 mmol缓冲液复溶。
1.2.6 SDS-PAGE及蛋白含量的检测 (1)SDSPAGE凝胶电泳。根据Laemmli[7]方法,在1 mL小试管中加入10 μL上样buffer,加40 μL细胞破碎上清液,煮沸10 min。同时空质粒表达的也要进行电泳检测。用12%的分离胶进行聚丙烯酰胺凝胶电泳,可以用来初步判定蛋白表达情况和后面纯化分离情况。(2)蛋白浓度检测。根据Bradford考马斯亮蓝法[8],以牛血清蛋白为标准蛋白测定标准曲线,测定蛋白浓度。取0.1 mL酶液,0.9 mL蒸馏水,加5 mL考马斯亮蓝试剂盒染液,反应5 min后测定OD595的吸光值。同时测定纯酶的蛋白浓度。
1.2.7 酶活测定方法 酶活测定方法为:4 mL反应体系,包含 3 mL 磷酸缓冲液(0.02 mol/L,pH 6.0),0.5 mL底物溶液(4 mg/mL),0.5 mL酶液,35℃反应4 h,高温100℃加热终止反应,以缓冲液替换酶液作为对照反应。用高效液相色谱[9]检测底物和产物的含量。高效液相色谱检测条件为:0~15 min为10%乙腈,90%水 (0.1%甲酸);15~20 min为100%乙腈,0%水;20~30 min为 10%乙腈,90%水(0.1%甲酸)。定义酶活力:每分钟氧化1 μmol底物为产物所需的酶量为一个酶活力单位。
1.2.8 重组蛋白的初步分离纯化 得到的粗酶液用AKTA avant蛋白纯化仪[10]进行镍柱纯化,将A1、A2、B1、B2四根管路都放进水里,设置system flow 20 mL/min流速,进行排气。之后把A1放进结合液中,B1放进洗脱液中,再进行排气一次,然后设置system flow 1 mL/min、flow path(column position 3)、delta pressure 0.3、pre-pressure 0.5、Gradient 0,inset A1平衡10 min后装柱子。然后上样粗酶液,用500 mmol/L的高浓度咪唑缓冲液B1洗脱目的蛋白,将吸附在离子柱上的蛋白洗脱下来,收集有酶活的洗脱液用超滤管(30 kDa)进行浓缩。SDS-PAGE验证纯化后蛋白条带是否单一。
1.2.9 酶学性质 (1)最适温度分析。以阿魏酸甲酯为底物研究温度对本发明所述酯酶酶活的影响,将酯酶分别在20~70℃下测定其酶活,将酯酶置于40、50、60与70℃下处理3 h,分别测定剩余酶活。(2)最适pH分析。以阿魏酸甲酯为底物研究pH对本发明所述酯酶酶活的影响,将酯酶分别置于pH值为3~9的缓冲液中处理96 h,测定剩余酶活。(3)反应动力学常数的测定。加相同量的酶液到不同底物浓度的反应液中,在最适温度和pH下测定酶活,使用Lineweaver-Burk[11]双倒数法做曲线计算Km和Vmax。
2 结果与分析
2.1 基因的克隆
通过序列比对,根据保守氨基酸序列,预测一段酯酶基因命名Lj0900,利用PCR技术成功扩增,将质粒pColdⅡ和经割胶回收的PCR目的片段进行双酶切,酶切后在16℃条件下过夜连接。之后把连接产物导入E.coli DH5α感受态细胞中,挑取形态较好的单菌落进行菌落PCR后对其结果呈阳性克隆的转化子接种到含Amp的LB小试管中培养过夜,提取重组质粒送往上海桑尼测序,测序结果与预期的目的基因序列一致,说明重组质粒构建成功。双酶切结果见图1。
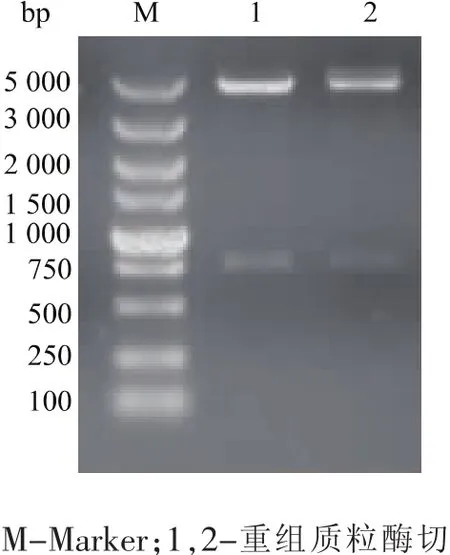
图1 重组质粒双酶切图Fig.1 Result of use enzyme to cut recombinant plasmid
测序结果如图2所示。

图2 重组基因测序Fig.2 Recombinant gene sequence
2.2 重组质粒的表达及纯化
按照1.2.5节方法对重组大肠和空质粒大肠进行诱导表达,培养24 h后,对表达后的菌体破碎,对上清液进行SDS-PAGE验证和酶活验证。对比发现重组大肠酶量得到很好的表达,并且按照1.2.7节方法,测定重组菌具有阿魏酸酯酶活性,而空质粒菌没有发现酶活。按照1.2.8节方法,重组蛋白经HisTrapHP组氨酸标记亲和层析柱纯化,收集峰位置的蛋白,进行SDS-PAGE验证和酶活验证,结果显示收集峰位置的蛋白具有阿魏酸酯酶的活性,并且呈单一的条带,达到了下一步实验的要求。表达及纯化结果如图3所示。

图3 SDS-PAGE验证酶的诱导表达和纯化Fig.3 To verify the result of induced expression and purification by using SDS-PAGE
2.3 酶学性质测定
2.3.1 最适温度的测定 不同温度下,阿魏酸酯酶的火力会有很大的影响,在以阿魏酸甲酯为底物时测定该酶在 20、30、40、50、60、70 ℃下的酶活,以最高酶活为100%计算相对酶活。从图4中可以看出其最适温度为30℃,在低温下呈上升趋势,但超过40℃时酶活急剧下降,其与方园等人[12]研究的最适温度25℃也相差无几。

图4 酶的最适温度Fig.4 Optimum temperature of enzyme
2.3.2 最适pH的测定pH对酶催化反应的影响也很大,pH过大(偏碱)或过小(偏酸)都会使酶失活。pH的改变能影响酶活性中心上必须基团的解离程度,同时影响底物与辅酶的解离程度,从而影响酶分子与底物分子的结合和催化。在以阿魏酸甲酯为底物时测定该酶在 pH 为 3、4、5、6、7、8、9 时的活性,发现在低pH下,pH越大,活性越高,在pH超过6时,活性开始下降,中性条件下活性比较高。其最适pH为6。其最适pH与方园等人[12]研究的阿魏酸酯酶基本一致。结果如图5所示。
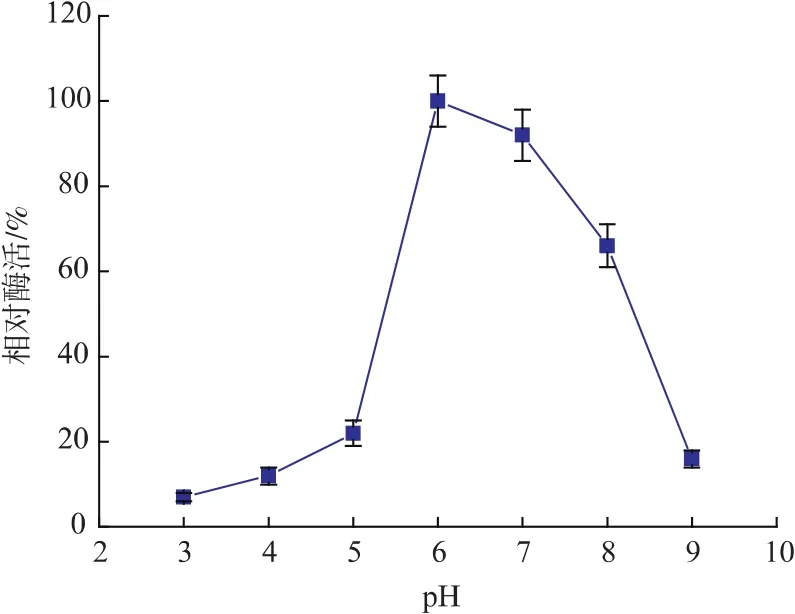
图5 酶的最适pHFig.5 Optimum pH of enzyme
2.3.3 酶的反应动力学常数 Km是极为重要的反应动力学参数,1/Km表示酶分子与底物之间亲和力的大小。1/Km值越大,酶与底物的亲和力越大。kcat/Km大小反映酶对底物的催化能力,值越高说明催化效率越高。分别以阿魏酸甲酯、阿魏酸乙酯、绿原酸、咖啡酸乙酯、对羟基肉桂酸甲酯为底物,测定该酶的Km及kcat/Km值,如表1所示。发现以绿原酸为底物时,Km值最小,且催化效率最高,kcat/Km达到1.13×103L/(mol·s)。在以阿魏酸甲酯为底物时,其kcat/Km值高于 Topakas等[13]研究的 2.79×102L/(mol·s),但低于 Rumbold 等人[14]的 3×105L/(mol·s)。 在以绿原酸为底物时,发现其kcat/Km小于Lai等人[15]研究的数值。

表1 反应动力学参数Table 1 Kinetics parameters
3 结 语
龚燕燕等人[16]从宁佐美曲美中克隆了编码阿魏酸酯酶A的基因,并成功在毕赤酵母中得到了异源表达。先前的研究已经在约氏乳酸杆菌中发现两个阿魏酸酯酶[15],本文根据菌株的全基因组序列和阿魏酸酯酶的保守序列又发现了一个新的阿魏酸酯酶,是约氏乳酸杆菌杆菌中第三个阿魏酸酯酶。对其成功克隆表达,并具有较高的活性,对其酶学性质进行了初步的研究,发现其最适温度为30℃,最适pH为6。新发现的阿魏酸酯酶为后人进一步研究阿魏酸酯酶奠定了一定的基础。现在随着分子技术的日益成熟,为FAEs找到更好的受体菌,从而实现更高效、高量的表达奠定了一定的基础。但是,不同菌株来源的FAEs在性质、作用等方面还是参差不齐的,况且这种酶主要是应用于医药、化妆品、食品等行业,更要对其安全性要求高,对此,尤其还要研究该酶的微生物安全性。所以说要实现工业化生产还是很难的。另一方面还可以结合微生物信息学研究其基因与酶学性质的关系。总而言之,阿魏酸酯酶具有广泛的应用前景,但距离实际的工业化生产还有不少的路要走,仍需要对其进行更深的研究。

