真空冷冻干燥棘孢木霉菌株工艺优化研究
龙艳珍,吴菲菲,2,李化强,2,*,赵良忠,2
(1.邵阳学院食品与化学工程学院,湖南邵阳422000;2.湖南省果蔬清洁加工工程技术研究中心,湖南邵阳422000)
酶法加工已遍布各行各业,而在果蔬加工中主要应用到的许多重要酶制剂,如果胶酶、纤维素酶等都依赖进口,进口意味着果蔬加工生产成本高,行业发展受到严重限制,而棘孢木霉(Trichoderma asperelham)发酵可产生一系列对细胞壁具有水解作用的水解酶,如纤维素酶、果胶酯酶、果胶裂解酶等[1],另外,棘孢木霉菌株还可应用于生物防治方面[2-4],且效果良好。在团队前期的研究中发现,所筛选出的棘孢木霉菌株发酵液[5]具有降解柑橘白皮层和囊衣的作用且降解效果较好,这与前人对棘孢木霉菌株产纤维素酶、半纤维素酶、N-乙酰-氨基葡萄糖苷酶、几丁质酶、果胶酶等[6-9]的研究一致。另外,在将棘孢木霉应用到产业化生产的过程中发现,菌株的贮藏、活化、制备及运输,都存在诸多问题,如活化时间长、贮藏条件要求高、需要冷链运输等情况。综上,采用真空冷冻干燥技术对菌株进行冻干处理,以便保藏及应用。
常见且易于实现的菌种保藏法为甘油法[10-11],其操作相对比较简单,适用范围广[12],但需要低温冰箱常年冷冻且菌种的保藏期限不确定。真空冷冻干燥技术是既能完成冻干任务又能很好的保护目标物活性的一种技术[13]。在九十多年的研究中,真空冷冻干燥技术的应用潜力被大量的开发,其中有人用于研究菌种的保藏[14-17]、食品原料的干制[18-19]、活性成分的干制[20-22]等方面,取得了良好的效果。与其他方法相比,真空冷冻干燥技术处理菌株存活率较高,菌株活性保持较好,遗传特性较为稳定,复水再生性良好、便于长期储存和不易变质等[23-24]。近些年,前人将真空冷冻干燥技术用于保藏霉菌菌种如白地霉[25]、黑曲霉[15]、棒曲霉[14]等,但关于棘孢木霉真空冷冻干燥的研究鲜有报道。
本文主要是通过真空冷冻干燥技术将棘孢木霉菌液有效的转化成相对稳定、易于运输的棘孢木霉菌粉,此状态下的菌种轻便、干燥,在运输、应用及保藏方面相当便捷。另外,通过将冻干后的菌粉进行复苏发酵培养,探究冻干处理对棘孢木霉发酵稳定性的影响。
1 材料与方法
1.1 材料与仪器
棘孢木霉菌Trichoderma asperelham(中国普通微生物菌种保藏管理中心保藏号为CGMCC No:14636)作为本试验的目的菌株,由湖南省果蔬清洁加工工程技术中心从湖南邵阳柑桔园中采样获得,再从以桔皮粉为主要成分的选择性培养基[26]中分离得出。挑选品质相同、大小相似的市售湘西椪柑为供试果实。
脱脂牛奶:莫莱高博恩共营有限公司;Evans blue:生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
SCIENTZ-18N真空冷冻干燥机:宁波新芝生物科技股份有限公司;银湖SP-780加氧泵:中山市日胜电器制品有限公司;DW-FL450A1超低温冷冻储存箱:中科美菱低温科技股份有限公司;BA310 Digital显微镜:麦克奥迪实业集团有限公司;SW-CJ-1D净化工作台:苏州智净净化设备有限公司;IS-RDD3恒温振荡培养箱:美国精骐仪器公司。
1.2 方法
1.2.1 制备冻干菌粉的工艺流程
取-40℃40%甘油管保藏的棘孢木霉菌,溶解,在无菌条件下接入液体培养基[26]中,在30℃、160 r/min下培养48 h,活化培养两次,然后用接种环将棘孢木霉菌接种于斜面培养基中,置于恒温培养箱内,30℃培养6 d,备用。挑取斜面培养基中的棘孢木霉划入空白平板中,30℃下培养6 d,然后,在无菌工作台中,以5 mL无菌水将成熟的孢子洗出,装入10 mL无菌螺口试管中,制取得孢子悬液,根据血球计数板法测定孢子的数量,用以确定孢子浓度,按要求调配脱脂牛奶的添加量,然后在-40℃冰箱中进行预冻,再进行真空冷冻干燥,收集干粉,制备得发酵剂。
1.2.2 菌液浓度测定
选用血球计数板法对菌悬液进行计数,即将菌悬浮液放在血球计数板与盖片之间的计数室中,使用计数板25×16规格进行计数,每个样品重复计数3次,取其平均值。公式如下:

1.2.3 菌种存活率测定
采用伊文思蓝作为活菌计数的染色剂[27],伊文思蓝作为一种活性染料,可对死细胞进行着色,而未失活的细胞由于排异的作用而出现透明的情况,从而实现活菌计数。通过血球计数板法进行计数,计算得活菌数。菌种冻干存活率的计算:W/%=n2/n1×100式中:n1为未进行冷冻干燥前活菌数,个/mL;n2为冻干菌粉复水至冻干前体积活菌数,个/mL。
1.2.4 发酵液制备
冻干结束后,将菌粉以冻干前相同体积的无菌水在无菌条件下复溶,取出5 mL计数用,取1 mL 1×107个/mL加入到装有500 mL桔皮粉液体培养基的1 000 mL锥形瓶中,在30℃、160 r/min条件下,培养时间 72 h,离心取上清液(4℃,10 min,3 800 r/min),备用。
1.2.5 发酵液降解试验
采用8瓣/200mL(500mL塑料烧杯),功率为5W、气压为0.025MPa的加氧泵进行鼓泡,降解温度为50℃,待其达到70%降解效果后,取出,记录降解所需时间。
1.2.6 发酵液降解效果评价指标
参考李杰等[28]对柑橘橘皮及囊衣降解效果的评价标准并做相应修改,感官评价标准如下:

表1 感官评价标准Table 1 Criteria for sensory evaluation of Ponkan segments
1.2.7 单因素试验
1.2.7.1 保护剂添加量的确定
在菌液浓度为1×108个/mL,预冻时间为12 h的情况下,选定冻干保护剂添加量分别为14、16、18、20、22%5个水平进行真空冷冻干燥,每个水平3组平行,以存活率、橘瓣降解时间为指标,获得最佳的保护剂添加量。
1.2.7.2 菌液浓度的确定
在保护剂添加量为20%,预冻时间为12 h的情况下,将菌液的浓度分别调配成 1×106、1×107、1×108、1×109个/mL 4个水平进行冻干处理,每个水平3组平行,以存活率、降解时间为指标确定最佳菌液浓度。
1.2.7.3 预冻时间的确定
在保护剂添加量为20%、菌液浓度为1×108个/mL的情况下,选定预冻时间为12、18、24、30 h 4个水平进行真空冷冻干燥处理,每个水平3组平行,以存活率、降解时间为指标确定最佳真空冷冻干燥预冻时间。
1.2.8 正交试验
在单因素试验的基础上,进行三因素三水平的正交试验优化,确定最佳真空冷冻干燥工艺条件,因素水平表见表2。

表2 正交试验水平表Table 2 Factors and levels of orthogonal experiments
1.3 数据处理
试验结果以均值±标准差(mean±SD)表示,每个处理重复3次,采用Eexcel进行数据统计。
2 结果与分析
2.1 单因素试验
2.1.1 保护剂添加量
保护剂添加量与存活率及橘瓣降解时间的关系见图1。
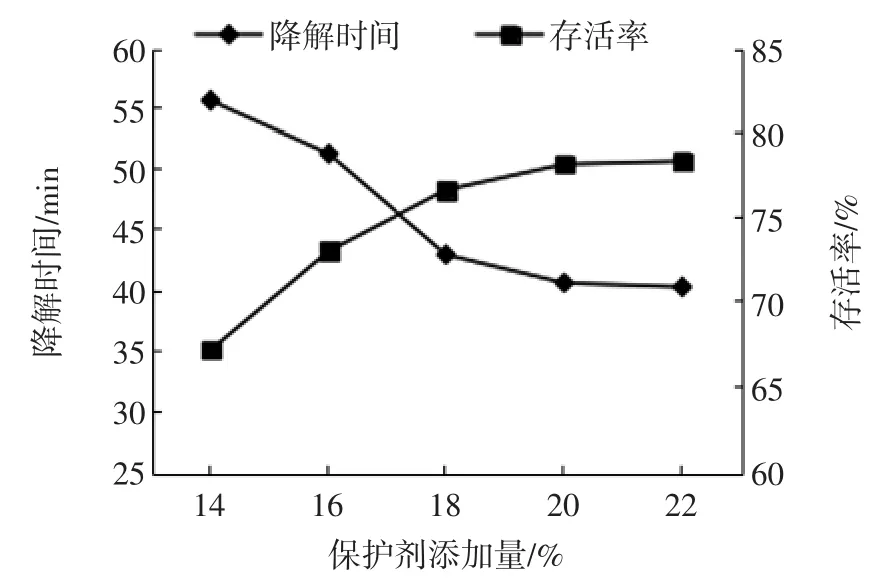
图1 保护剂添加量与存活率及橘瓣降解时间的关系Fig.1 The relationship between content of cryoprotectant and servival rate and the degradation time of Ponkan segments
由图1可知,保护剂添加量从14%到20%之间,菌株的存活率上升速度最快,降解时间也逐渐变短,而20%之后菌株的存活率增长缓慢,降解时间逐渐趋于稳定。综上,选择冻干保护剂添加量为20%进行后续的试验。
2.1.2 菌液浓度
菌液浓度与存活率及橘瓣降解时间的关系见图2。
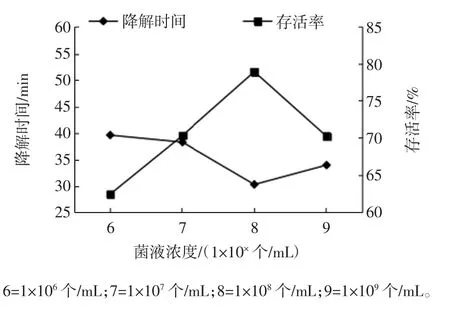
图2 菌液浓度与存活率及橘瓣降解时间的关系Fig.2 The relationship between the concentration of bacterial solution and servival rate and the degradation time of Ponkan segments
由图2可知,菌液浓度从1×106个/mL到1×108个/mL之间,菌株的存活率呈急剧上升的趋势,降解时间逐渐变短,在1×108个/mL时,存活率达到最大值,降解时间达到最小值,而1×108个/mL之后菌株的存活率下降,降解时间加长。综上,选择菌液浓度为1×108个/mL进行后续的试验。
2.1.3 预冻时间
预冻时间与存活率及橘瓣降解时间的关系见图3。
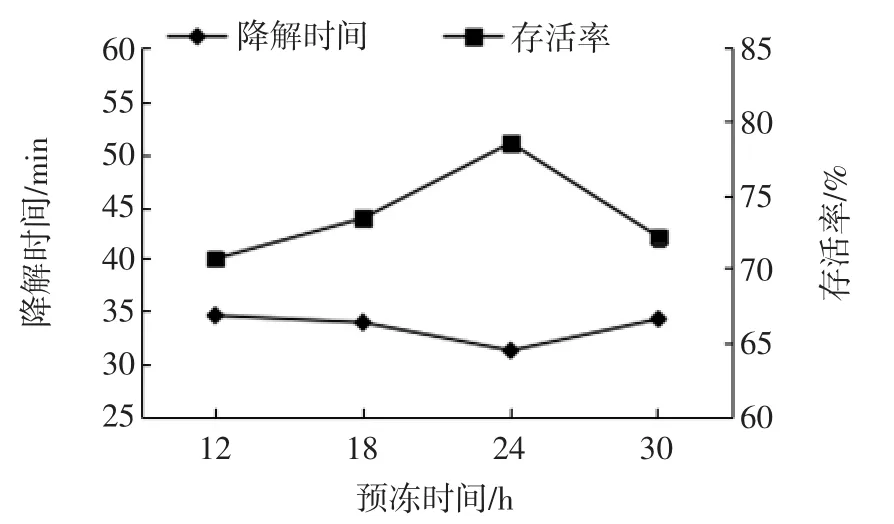
图3 预冻时间与存活率及橘瓣降解时间的关系Fig.3 The relationship between pre-freezing time andand servival rate and the degradation time of Ponkan segments
由图3可知,预冻时间在24 h时,存活率达到最大值,降解时间达到最小值,而少于或超过24 h菌株的存活率下降,降解时间延长。可能的原因是预冻时间太长导致菌株死亡或失去活性,而预冻时间短物料未能预冻完全,在抽真空的过程中发生飞洒而导致其损失。综上,选择最佳预冻时间为24 h。
2.2 正交试验
正交试验结果及数据分析见表3。
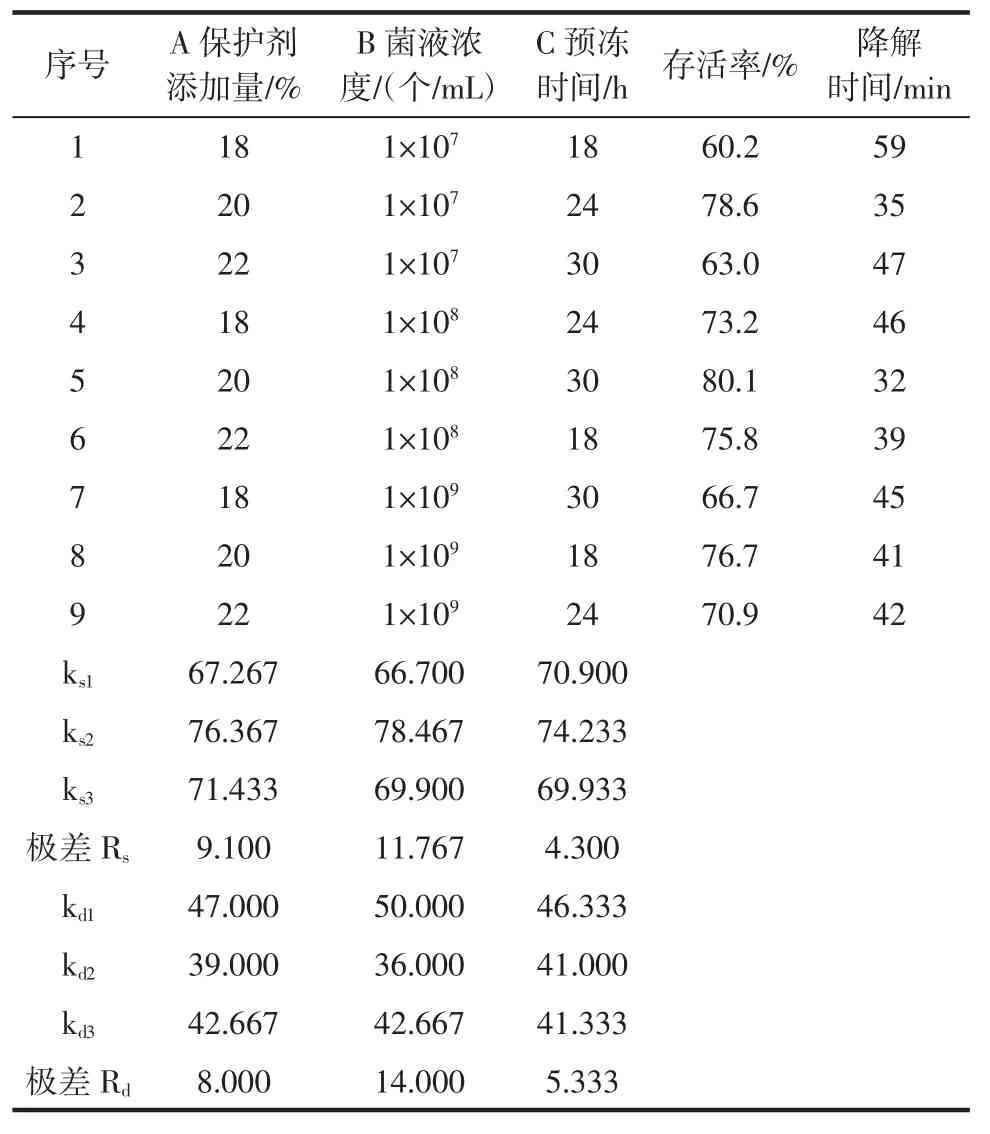
表3 正交试验结果及数据分析Table 3 Experimental design and result of orthogonal experiments
根据极差Rs、Rd可判断出各因素对真空冷冻干燥工艺的影响为:B>A>C(菌液浓度>保护剂添加量>预冻时间)。从表3中我们看出,棘孢木霉的最佳冻干工艺为A2B2C2,即菌液浓度为1×108个/mL,脱脂牛奶保护剂添加量为20%,预冻时间为24 h。
2.3 验证试验
在最佳条件下,即菌液浓度为1×108个/mL,脱脂牛奶保护剂添加量为20%,预冻时间为24 h,进行真空冷冻干燥处理,重复3次,菌株的存活率达到81.25%,橘瓣的降解时间为31 min,由此可见,经过真空冷冻干燥处理后,棘孢木霉活性保持良好。
3 结论
通过单因素试验和正交试验,确定棘孢木霉菌株的最佳真空冷冻干燥工艺参数为:保护剂添加量为20%,预冻时间为 24 h,菌液浓度为 1×108个/mL,在最优条件下,菌株的存活率达到81.25%,橘瓣降解所需时间为31 min为木霉菌的真空冷冻干燥提供参考依据,也为菌株保藏和运输带来了便捷。

