丙烯酰胺和苯并芘诱导秀丽隐杆线虫生殖腺细胞凋亡研究
聂文,屠泽慧,郭肖颖,蔡克周,*
(1.合肥工业大学 食品与生物工程学院,安徽合肥230009;2.安徽省农业科学院农业工程研究所,安徽合肥230001)
丙烯酰胺(Acrylamide,AA)是一种无色无味的结晶固体,可溶于水、丙酮和乙醇中,20世纪50年代以来,它被广泛应用于聚丙烯酰胺的工业化生产和实验室的电泳和分析研究[1]。AA对动物具有公认的神经毒性和生殖毒性[2],还可诱发小鼠、大鼠和斑马鱼等多种动物肿瘤[3-4],也是一种可能的人类致癌物(2A类)[5]。2002年,瑞典科学家最先发现富含碳水化合物的食品在高于120℃的加工(如烹饪,油炸或烘烤)过程中,能生成μg/kg级的AA[6],这些AA主要是由食物中游离的天冬酰胺和还原糖在高温条件通过美拉德反应形成[7-9],同年,WHO对全球2000多个食品抽检显示,许多高温加工食品中AA含量高达饮用水限定标准的500倍,基于此,瑞典国家食品管理局向全世界发出食用高温油炸和烘烤食品可能会导致的AA暴露健康风险的警告[10]。2018年3月28日,美国加利福尼亚州洛杉矶高等法院裁定,在加利福尼亚州出售咖啡的企业必须在咖啡产品包装上,须标注““致癌警示””信息,原因是咖啡豆在烘焙过程中产生可能致癌的AA。这一新闻再次激起人们对食品内源化学危害物的关注。
苯并芘(Benzo(a)pyrene,BaP)是另外一个普遍关注的化学性危害物,BaP是由一个苯环和一个芘分子稠合而成的多环芳烃类化合物,是最早发现的环境致癌物。BaP最初是在化石燃料和木材等有机物燃烧烟雾中发现,后发现广泛分布在自然环境中。上世纪80年代在熏鱼中检出BaP后,陆续在多种食品中经检测出,尤其是在熏鱼、烤肠、炸鸡、植物油、谷物和经过高温热加工处理的食品[11-13]。人类可通过皮肤、呼吸、饮水和食物等多种途径接触到BaP,其中通过食品途径摄入BaP占90%以上[14]。世界各国均对食品中BaP的残留量进行了严格限制。我国对食品中BaP的限量标准为肉制品、熏烤动物性食品及粮食小于5.0 μg/kg、植物油小于10 μg/kg[15]。欧盟对BaP的最大限量为熏烤肉制品 5.0 μg/kg、食用油 2.0 μg/kg、谷类及婴幼儿食品 1.0 μg/kg[16]。
由于食品摄入造成AA和BaP对人的广泛暴露,科学家们围绕AA和BaP的快速检测、形成机制和控制措施方面开展了大量工作,此外,以离体细胞、啮齿动物和其他生物模型为对象,在AA和BaP致毒特点和机理方面做了大量研究,但现有研究都是独立以AA或BaP暴露染毒为研究对象,综合考虑AA和BaP通过食物摄入造成共同暴露的普遍性,研究AA和BaP共同暴露染毒的协同作用至今尚未见报道。本文以经典模式生物秀丽隐杆线虫为模型,线虫是一种开展化学污染物生物学毒性评价的好材料,选取简单、直接、易测的生物学终点是利用好模式生物的重要前提,线虫生殖腺具有良好的发育延展性,细胞凋亡具有稳定的规律,受到环境应激或毒物损失,会诱发细胞凋亡增加,性腺细胞凋亡终点已被应用于重金属、农残、化学药物和活性提取物的毒理和活性评价[17]。本试验选择秀丽隐杆线虫性腺细胞凋亡和后代数量为生物学终点,研究AA和BaP诱导生殖腺细胞凋亡的剂量和时间效应,考察AA和BaP的协同致毒性,为AA合理评估提供更多理论依据。
1 材料与方法
1.1 试剂与线虫
AA(超纯级,≥99.9%):阿拉丁试剂公司,用双蒸水配制成2.0 g/L溶液过滤灭菌后分装在1.5 mL离心管;BaP(色谱级,≥99.9%):sigma试剂公司,用无水乙醇配制成0.01 g/L溶液过滤灭菌后分装在1.5 mL离心管,每次使用前取样稀释。
野生型秀丽隐杆线虫N2、线虫食物大肠杆菌OP50:国际线虫中心(Caenorhabditis Genetics Center,CGC)提供,在实验室里,线虫正常在(20±1)℃温度范围内培养。
1.2 线虫的同步化处理
用线虫基础培养液(2.922 g NaCl,2.236 g KCl,溶于1 000 mL双蒸水,高压灭菌)将怀卵成虫从线虫生长培养基(nematode growth media,NGM)平板洗下,加入到1.5 mL离心管中,使总体积达到0.7 mL,然后加入0.3 mL裂解液(5 mol/L NaOH∶5%NaClO=1∶2,体积比,现配现用),间歇弹击混匀,裂解结束后立即在1 400 g离心力下离心,移上清,再用线虫基础培养液清洗2次,最后将虫卵于线虫基础培养液中过夜孵化,由于没有添加食物,线虫全部滞留在L1期[18]。
1.3 生殖腺细胞凋亡数的测定
细胞凋亡的测定依Wang所采用方法进行修改[17],将处理后的线虫置于24孔板内,加入500 μL含少量OP50的线虫基础培养液,以25 μg/mL的吖啶橙染色1 h,将虫吸出于Ф35 mm NGM板上恢复45 min,挑取20条线虫于30 μL NaN3的载玻片中央,荧光显微镜观察,凋亡的细胞呈亮黄色或橙黄色,这是DNA片断化的一个重要标志,而未凋亡的细胞呈现均匀的浅绿色,改进后的方法染色更加清楚。
1.4 线虫后代数目测定
线虫后代数量目的测定参考前人方法[17],将15只同步化早期成虫分别单个移入24孔板内,加入500 μL不同浓度AA和BaP含少量OP50的线虫基础培养液,1天后将成虫移入新孔板内,以保证不被后代线虫所混淆,直到线虫停止产卵,线虫在24孔板内所产虫卵经培养1天后对孵化线虫进行计数,即为后代数量。
1.5 数据处理
试验数据采用OriginPro 7.0进行统计分析,以平均值±标准误表示,显著性检验采用Student’s t-tests方法,p<0.05表示差异显著。所有数据均以平均数±标准误的形式表示,利用双尾t检验检测不同品系线虫重金属暴露所导致的细胞凋亡的差异,显著性水平为p<0.05。
2 结果分析
2.1 AA暴露诱导线虫生殖细胞凋亡
不同浓度AA暴露线虫12小时后性腺细胞凋亡的情况如图1所示。
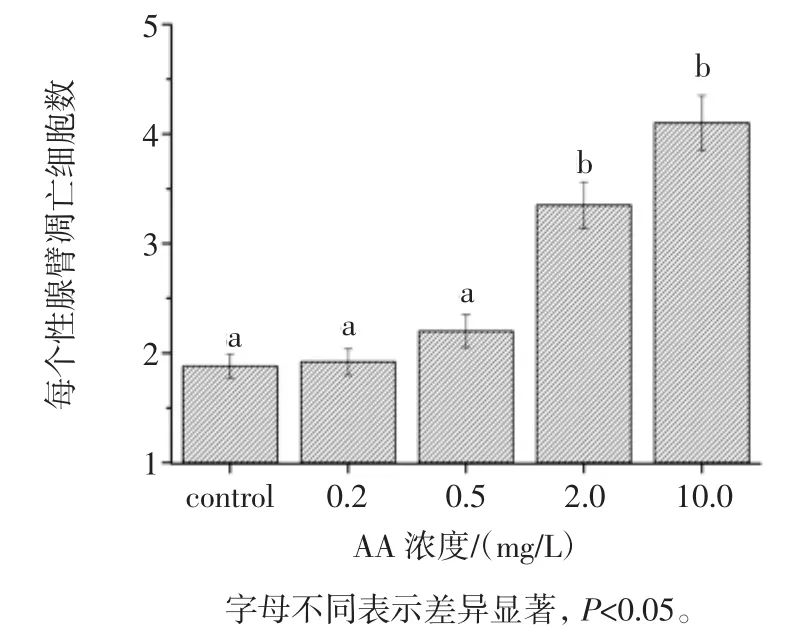
图1 不同AA浓度对线虫生殖腺细胞凋亡的影响Fig.1 Effect on the gonad cells apoptosis of C.elegans with different concentration of AA
如图1所示,随着AA浓度的增加,线虫性腺细胞凋亡呈现增加趋势,当AA浓度在0.5 mg/L浓度范围以内时,细胞凋亡增加不明显,当暴露浓度达到2.0 mg/L和10.0 mg/L时,线虫性腺细胞凋亡数目由对照组1.88±0.11分别增加到 3.35±0.21 和 4.1±0.25,差异均显著(p<0.05)。进一步研究较低AA剂量暴露对线虫性腺细胞凋亡作用的时间效应,线虫于0.2 mg/L AA浓度下暴露不同时间效应如图2所示。
如图2所示,无论线虫是否有AA暴露处理,其性腺细胞凋亡均随时间延长而增加,24小时后各组线虫性腺细胞凋亡数均较0 h组显著增加(p<0.05),但是整个暴露时间内(36 h),相比对照组,AA暴露并不能诱发性腺细胞凋亡数显著增加(p>0.05)。
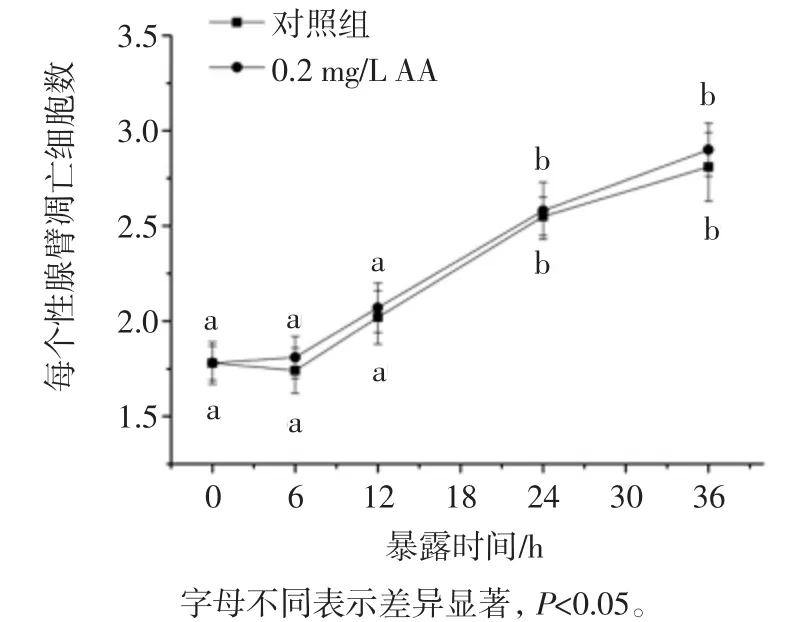
图2 低浓度AA暴露诱发线虫性腺细胞凋亡的时间效应Fig.1 Effect on the gonad cells apoptosis of C.elegans induced by AA with exposure time
2.2 BaP暴露诱导线虫生殖细胞凋亡
不同浓度BaP暴露线虫12小时后性腺细胞凋亡的情况如图3所示。
如图3所示,在考察的BaP浓度(0~0.005 mg/L)范围内,线虫性腺细胞凋亡呈现先增加后降低的情况,0.000 5 mg/L浓度范围内BaP没有诱发性腺细胞凋亡显著增加,0.001 mg/L BaP处理组线虫性腺细胞凋亡数由对照组1.85±0.11增加到3.2±0.18,差异显著(p<0.05),而在0.005 mg/L剂量条件下,性腺细胞凋亡水平反而下降,这可能是过高的浓度可能导致性腺发育的阻滞。0.000 2 mg/L浓度BaP暴露对线虫性腺细胞凋亡的时间效应如图4所示。
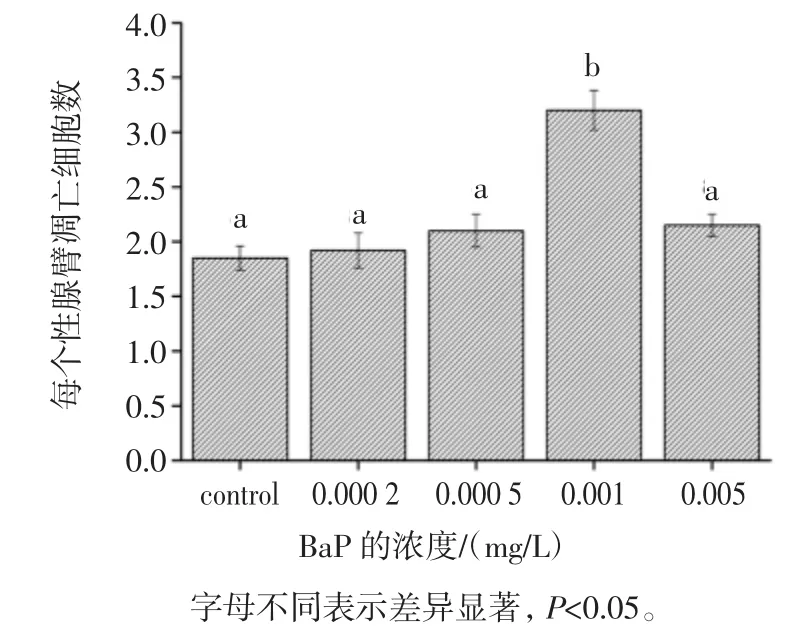
图3 不同BaP浓度对线虫性腺细胞凋亡的影响Fig.3 Effect on the gonad cells apoptosis of C.elegans with different concentration of BaP
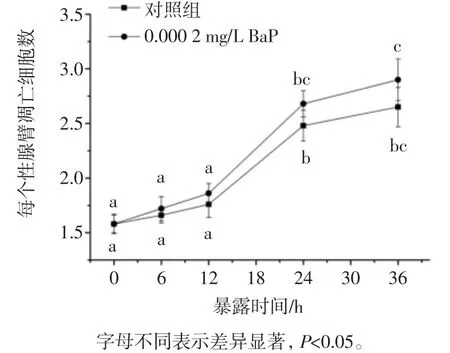
图4 低浓度BaP暴露诱发线虫性腺细胞凋亡的时间效应Fig.4 Effect on the gonad cells apoptosis of C.elegans induced by BaP with exposure time
如图4所示,线虫性腺细胞凋亡均随时间延长而增加,24 h和36 h检测点相比0 h检测点,线虫性腺细胞凋亡数均显著增加(p<0.05),但是整个暴露时间内(36 h),0.000 2 mg/L浓度BaP暴露处理并不能诱发性腺细胞凋亡数显著增加(p>0.05)。
2.3 AA和BaP暴露协同诱导线虫生殖细胞损伤
为了研究AA和BaP暴露对性腺细胞的协同损伤作用,将线虫暴露于含有0.2 mg/L AA和0.000 2 mg/L BaP环境中,结果如图5所示。
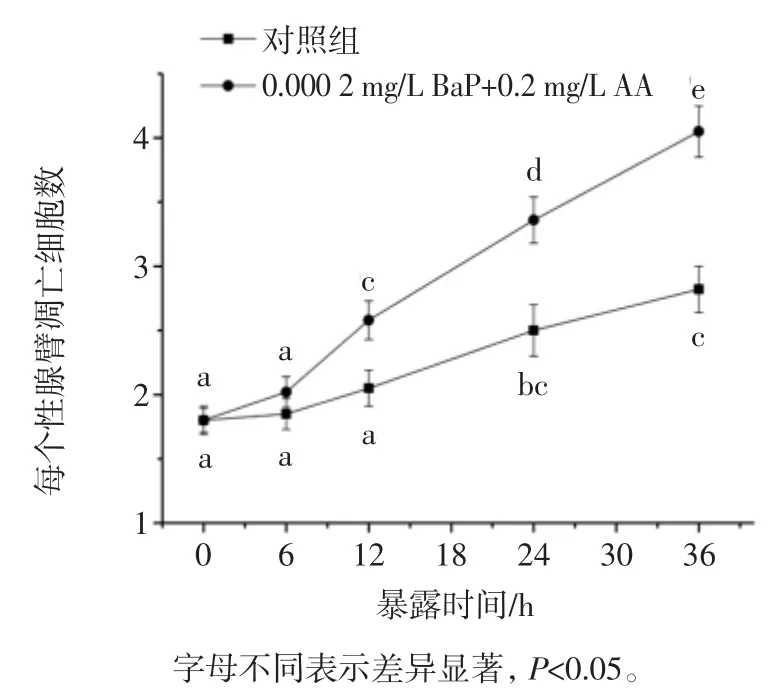
图5 AA和BaP暴露协同诱导线虫性腺细胞凋亡的时间效应Fig.5 Effect on the gonad cells apoptosis of C.elegans induced by AA and BaP
如图5所示,与前面研究相同的是处理组和对照组线虫性腺细胞凋亡均随时间延伸而呈现增加趋势,相比对照组,在12小时后染毒组性腺细胞凋亡显著增加(p<0.05),其后尽管对照组凋亡细胞数也有明显增加,但是染毒组增加更加明显,结果表明AA和BaP暴露对线虫性腺具有明显的协同作用。进一步考察低浓度AA和BaP暴露对线虫后代数量的影响,结果如图6所示。
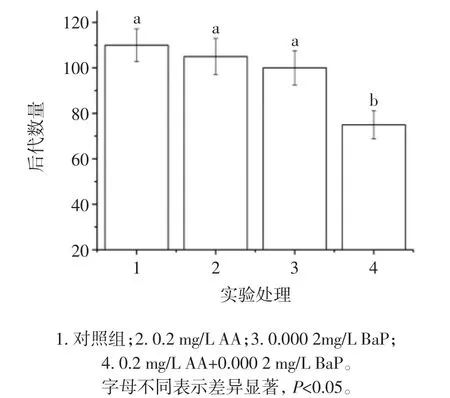
图6 AA和BaP暴露诱导线虫后代数量降低Fig.6 Effectonthebroodsizeof C.elegans inducedbyAAandBaP
如图6所示,0.2 mg/L水平AA和0.000 2 mg/L水平BaP均不能诱发线虫后代数量的显著降低,但共同染毒处理则导致后代数量由对照组110±7.2降低到75±6.2,差异显著(p<0.05),结果进一步验证了 AA 和BaP能协同诱发线虫生殖损伤。
3 讨论
线虫生殖腺是AA和BaP暴露毒性良好的生物学检测终点。自1974年Brenner[19]最先提出利用秀丽隐杆线虫进行环境毒理学研究的可行性,作为一种活体生物,其3 d~4 d相对较短的生殖周期和4周左右的寿命,是一种良好的开展活体研究的生物模型,经过多年发展,线虫已经广泛应用于环境化学污染物毒理评价等方面的研究。早期,主要以线虫致死或半致死为检测终点,评价化学污染物的急性毒性[20],后来发展了以线虫发育状况[21]、繁殖性能[22]、寿命[23]和摄食行为[24]等非致死生物学终点,应用于重金属、农残、化学药物和空气负离子等环境因子的生物学评价。但是急性致死试验所暴露剂量通常较高,与实际环境中污染物浓度相差甚远,而非致死性检测点,如寿命和摄食行为等有存在周期相对较长和难以控制等不利因素。Kazuhiro等将线虫进行BaP急性染毒,检测其半致死剂量为0.05 mg/L[25],而Li检测线虫暴露染毒AA的半致死剂量高达897 mg/L,诱发摄食行为发生明显变化的剂量为10 mg/L[26],Wang以线虫生殖腺为研究体系,研究了重金属砷对生殖腺的影响,结果发现较低浓度砷即可诱导性腺周期阻滞和细胞凋亡,表明线虫的生殖腺是研究化学污染物毒性的良好模型[27]。
线虫具有一对U形的生殖腺,两个生殖腺臂通过中央的子宫相连。成体线虫生殖腺的远端细胞是生殖干细胞,终身具有丝分裂能力,远端往后是一段约20个细胞直径的过渡区,有丝分裂和减数分裂同时存在,过渡区之后是减数分裂区,染色体在此区域形成联会复合体。在正常生理条件下,为维持生殖细胞的稳态,约50%的有丝分裂细胞会在发育过程中凋亡,这一过程谓之“生理性细胞凋亡”,当受到环境危害物胁迫时,细胞凋亡数目显著增加[28]。在本试验中,我们测定了AA和BaP暴露下线虫生殖细胞凋亡,通过对不同浓度(0~0.005 mg/L)AA 和(0~10.0 mg/L)BaP 暴露的研究发现,它们均可诱导线虫生殖细胞凋亡增加,并与浓度密切相关,2.0 mg/L的AA暴露12 h可诱发线虫生殖腺细胞显著增加,而对于BaP在相同处理时间内诱发生殖腺细胞显著增加的剂量只要0.001 mg/L,这也表明BaP的生物学毒性要高AA达千倍以上。此外,BaP诱发的生殖细胞具有多效性,较低浓度(0.000 2 mg/L)BaP暴露诱导生殖细胞凋亡增加,而较高浓度(0.001 mg/L)暴露对细胞凋亡具有抑制作用。产生这种效应的原因可能与诱发生殖腺的发育阻滞有关,发育阻滞导致生殖细胞总数的降低,从而表现出凋亡细胞数目的下降。相比BaP半致死剂量为0.05 mg/L和AA半致死剂量897 mg/L,线虫生殖腺细胞凋亡检测点敏感浓度分别降低了50倍和450倍。这也表明线虫生殖腺是AA和BaP暴露毒性良好的生物学检测终点。
流行病学研究显示,由于食品造成AA和BaP的摄入占据化学污染物接触的主要部分,油炸和烘烤食品因其固有风味和便捷性特点,是被世界各国广为喜爱的食品,这些食品也是人们主要的AA摄入源,此外高温加工过程中,脂肪酸环化和蛋白质的裂解也可以生产不同水平的BaP[15,29]。同样,烟熏和烧烤类食品的摄入与烟草的消费也会伴随着化学危害物BaP的接触[11,14]。AA和BaP在动物和人体内或离体的生物学作用是否存在协同目前还没有报道。在本试验中,我们测定了0.2 mg/L的AA和0.000 2 mg/L的BaP单独暴露时,在36 h内都不能诱发线虫生殖腺细胞凋亡的显著增加,但是将这一剂量的AA和BaP共同暴露线虫时,在暴露12 h时,就检测到生殖腺细胞凋亡的显著增加,并随着暴露时间的延长,处理组线虫生殖腺细胞凋亡较生理性凋亡呈现明显的增加趋势,这表明AA和BaP对生殖腺的毒理作用存在协同作用,而后代数量的显著下降对这一协同作用更进一步验证。

