LED蓝光对辣椒采后色泽及品质的影响
王晓芬 郜海燕 吴伟杰 徐非非 王绍金 陈杭君 寇莉萍
(1浙江省农业科学院食品科学研究所/农业部果品产后处理重点实验室/浙江省果蔬保鲜与加工技术研究重点实验室/中国轻工业果蔬保鲜与加工重点实验室/浙江省植物有害生物防控重点实验室,浙江杭州 310021;2西北农林科技大学食品科学与工程学院,陕西杨凌 712100;3西北农林科技大学机械与电子工程学院,陕西杨凌 712100)
辣椒(Capsicum annuumL.),茄科辣椒属一年或多年生草本植物,富含多种对人体有益的活性成分。辣椒红素和辣椒碱是辣椒的特征成分,其中辣椒红素是一种四萜类天然色素,具有色泽鲜艳、色价高、着色力强、保色效果好、安全性高等优点,是天然红色素中最好的色素之一,且兼具药用价值;辣椒碱是辣椒的主要呈味物质,天然辣椒碱具有镇痛止痒、抗菌消炎、清除自由基、促进脂肪代谢、预防肿瘤和保护心血管系统等作用[1-3]。
LED蓝光是指波长在430~470 nm范围的短波光。研究发现,适量强度的蓝光照射可以诱导果蔬中色素物质(如叶绿素、花青素)的积累,且可以促进果实的成熟。 杜洪涛等[4]分别采用 30 μmol·m-2·s-1的红、黄、蓝、绿、白光照射不同品种的彩色甜椒幼苗,发现与其他光处理相比,LED蓝光能有效促进各品种彩色甜椒幼苗的叶绿素含量的积累,这与李雯琳[5]、Hoffmann等[6]的研究结果相似。Shi等[7-8]、Xu等[9-10]发现 40 μmol·m-2·s-1蓝光照射可诱导采后草莓、蓝莓、杨梅等的花青素含量显著增加;Gong等[11]发现 40 μmol·m-2·s-1蓝光照射加快了碧桃果实中乙烯的生成速率,促进了碧桃成熟。目前,有关LED蓝光对辣椒的研究多集中于照射辣椒种子、幼苗、未采收的辣椒等,以此来提高辣椒苗的质量和辣椒的品质及产量[12-15],但对采后辣椒色泽和营养成分等方面的研究尚鲜见报道。 本试验采用14 μmol·m-2·s-1LED蓝光照射采后新鲜红辣椒和绿辣椒,分析蓝光照射对采后红辣椒和绿辣椒的色泽、叶绿素含量、辣椒红素含量、辣椒碱含量、Vc含量及 Caspsanthin/capsorubin synthase(Ccs)基因表达量的影响规律,以期为LED蓝光照射对辣椒品质影响提供理论参考。
1 材料与方法
1.1 材料
新鲜辣椒于2016年10月购自杭州市江干区杨家村农贸市场,其中绿辣椒的品种为西洋大牛椒,红辣椒的品种为大红袍。绿、红辣椒的大小基本一致(每颗鲜重50±2.5 g)、成熟度基本一致、无腐烂病害、无机械损伤。
辣椒红素标准品(≥98%),哈维生物科技有限公司;辣椒碱标准品(≥95%),上海阿拉丁试剂有限公司;RNAplant plus,天根生化科技有限公司;丙酮(分析纯),上海凌峰化学试剂有限公司;乙醇(分析纯),上海凌峰化学试剂有限公司。
1.2 仪器与设备
MRC-250B LED冷光源气候培养箱,上海百典仪器设备有限公司;Cintra404紫外-可见分光光度计,澳大利亚 GBC公司;实时荧光定量 PCR仪,美国Applied Biosystems;KQ5200DE型数控超声波清洗器,昆山超声仪器有限公司;DK-8D电热恒温水槽,上海精宏实验设备有限公司;PAL-1型手持折射仪,日本SANYO公司。
1.3 试验方法
1.3.1 处理方法 试验分为LED蓝光处理组(LED)和对照组(CK),其中LED又分为半光照组和整体光照组:半光照组:将250根辣椒平铺在蓝光箱中,贮藏温度和相对湿度分别为 25℃、80%,上面用 14 μmol·m-2·s-1的 LED 蓝光照射,每个辣椒的下面用锡箔纸包裹严实,背对蓝光灯,形成避光对照组,每2 d取一次样,每次取样量为50根;整体光照组:试验组辣椒(250 根)上、下面均用 14 μmol·m-2·s-1的 LED 蓝光照射,对照组为避光贮藏(250根),贮藏温度和相对湿度分别为25℃、80%。半光照组取样时以锡箔纸包裹边缘位置为切割线,并与整体光照组混匀,分别对蓝光处理及避光对照的红(R)绿辣椒(G)色泽、叶绿素含量、辣椒红素含量、辣椒碱含量、Vc含量及Ccs基因表达量等指标进行测定。
1.3.2 辣椒色泽的测定 采用手持色差仪,分别测定红辣椒和绿辣椒光照组和避光组的L∗、a∗值,每个样品处理测6个点,取平均值。
1.3.3 辣椒叶绿素含量的测定 叶绿素含量测定参照曹建康[16]的方法进行,结果以mg·g-1FW表示。每次取样时测定辣椒中的叶绿素含量,用80%的丙酮作为提取溶剂,并测定652 nm处的史光值(A652),重复测定3次,取平均值。
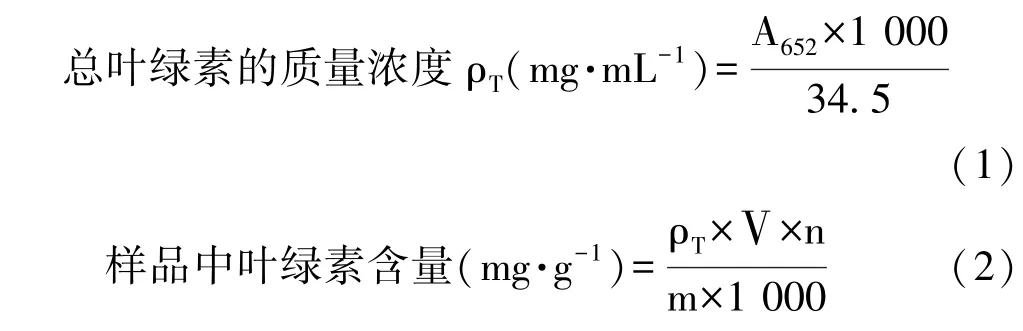
式中,Ⅴ:样品提取液总体积,mL;m:样品质量,g;n:稀释倍数。
1.3.4 辣椒辣椒红素含量的测定 辣椒红素的提取:准确称取辣椒样品1.000 0 g,加入10 mL 95%乙醇,设置超声功率600 W、温度60℃,超声时间100 min,过滤得上清液,置于4℃保存备用。
辣椒红素含量的测定:参照钱宗耀等[17]的方法并略作改动。准确称取一定量的辣椒红素标准品,用95%的乙醇定容至 100 mL,配成 300 μg·mL-1的标准品溶液;分别准确移取标准品溶液2.00、4.00、6.00、8.00、10.00 mL于25 mL容量瓶中,用乙醇定容至100 mL,95%乙醇调零,在460 nm波长下测定吸光值,然后以标准质量为横坐标,相对应的吸光值为纵坐标,绘制标准曲线,简称A-G标准曲线。用95%乙醇溶液将超声提取的辣椒滤液稀释一定倍数后,在460 nm波长下测定吸光值。根据标准曲线获得各样品中的辣椒红素含量,计算公式如下:
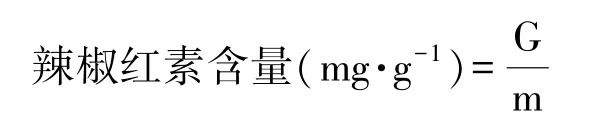
式中,G:从A-G标准曲线中查到的标准质量,mg;m:测定所取样品的质量,g。
1.3.5 辣椒辣椒碱含量的测定 辣椒碱的提取:准确称取辣椒样品1 g,加入35 mL 95%乙醇,设置超声功率为600 W,温度60℃,超声时间45 min,取上清液备用。
辣椒碱含量的测定:采用分光光度计法(钼酸钠-亚硝酸钠法),参照董力玮等[18]的方法并略作改动。准确称取辣椒碱标品0.011 8 g,用适量95%乙醇溶解并定容至 100 mL;准确吸取标液 0、0.2、0.4、0.8、1.2、1.6、2.0 mL于10 mL容量瓶中,然后依次加入2 mL 0.5 mol·L-1的盐酸溶液和1 mL亚硝酸钠-钼酸钠(亚硝酸钠 0.5 mol·L-1,钼酸钠为 0.025 mol·L-1),充分混匀,静止15 min后加入2 mL 1.0 mol·L-1的氢氧化钠溶液,再用95%乙醇定容至10 mL,显色20 min,以0 mL瓶为参照,在436 nm处测定吸光度值。以标准质量为横坐标,相对应的吸光值为纵坐标,绘制标准曲线,简称A-G标准曲线。取超声所得辣椒上清液5 mL于10 mL容量瓶,依次加入2 mL盐酸溶液和1 mL亚硝酸钠-钼酸钠,充分混匀,静止15 min后加入2 mL氢氧化钠溶液,用95%乙醇定容至刻线,显色20 min。以0 mL瓶为参照,在436 nm处测定吸光度值。按照公式计算辣椒碱含量:

式中,G:从A-G标准曲线中查到的标准质量,mg;m:测定所取样品的质量,g。
1.3.6 辣椒红素合成关键基因的表达Ccs基因是控制辣椒果实中辣椒红素合成和果实红色形成的关键基因,运用实时定量PCR技术可分析LED蓝光对辣椒红素合成关键基因表达的影响。利用RNAplant Plus试剂提取不同处理时间红、绿辣椒中的总RNA,并以RNA为模板,参照 PrimeScript RT reagent Kit with gDNA Eraser试剂盒(TaKaRa,大连)的操作,反转录合成cDNA,并以反转录获得的 cDNA为模板,使用SYBR Premix Ex Taq试剂盒 (TaKaRa,大连)在 ABI StepOne Plus实时定量PCR分析仪上进行实时荧光定量PCR分析。辣椒红素合成关键基因Ccs的引物序列如下:CTTTGAACAAGTCGATCGGCTTCG(Ccs-F);C AGATCTAGTATTCACCGGACACTC(Ccs-R)。具体反应程序及基因表达分析算法参照田士林[19]的方法,每个样品均重复3次。
1.3.7 辣椒Vc含量的测定 参照曹建康[16]的方法,结果以mg·100 g-1表示。 用5 mL 50 g·L-1的三氯乙酸(trichloroacetic acid,TCA)溶液提取Vc。测定时取1 mL提取液的上清液,再分别加入1 mL 50 g·L-1TCA溶液、1.0 mL无水乙醇、0.5 mL 0.4%磷酸-乙醇溶液、1.0 mL 5g·L-1红菲罗啉-乙醇溶液、0.5 mL 0.3 g·L-1FeCl3-乙醇溶液,30℃水浴 60 min,于 534 nm 波长下测定吸光值,重复3次。
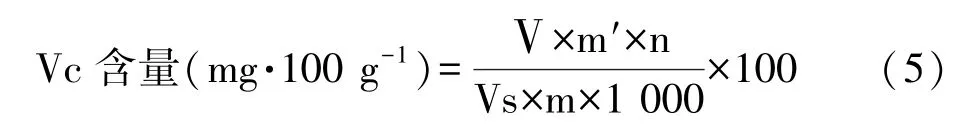
式中,Ⅴ:提取液总体积,mL;m′:由标准曲线求得的 VC质量,μg;Vs:测定时提取液体积,mL;m:样品质量,g;n:稀释倍数。
1.4 数据处理
运用Microsoft Excel 2003和Minitab 16.2.3软件进行数据处理,并对试验数据进行显著性检验分析。
2 结果与分析
2.1 LED蓝光对辣椒色泽的影响
由图1可知,绿辣椒在贮藏初期(0 d)为绿色,贮藏8 d内,对照组(避光面,CK)色泽变化不显著,而LED蓝光组(LED)的绿辣椒从第2天开始变红,到第8天时整个光照面全部变红;红辣椒在贮藏初期为黄红色,经过8 d贮藏后,均逐渐变红,且LED从第2天开始红色明显深于CK。

图1 LED蓝光处理对辣椒色泽影响Fig.1 Effect of light-emitting diode blue light treatment on the color of peppers
由图2-A、C可知,随着贮藏时间的延长,辣椒的亮度(L∗)值呈下降趋势。与CK相比,LED蓝光处理加快了绿辣椒和红辣椒L∗值的下降速率。CK(G)和LED(G)均在第4天表现出L∗值明显下降。CK(R)和LED(R)均在第2天表现出L∗值明显下降。其中CK(G)的L∗值变化程度最小。除第0、第2天外,绿辣椒L∗值在LED(G)和 CK(G)(第 4、第 6、第 8天)之间均存在显著差异。在第0、第4、第6和第8天时,红辣椒L∗值在LED(R)和CK(R)之间无显著差异,在第2天时差异显著,说明红辣椒中辣椒红素的加速积累主要发生在第2天。
由图2-B、D可知,LED蓝光处理促进了绿辣椒和红辣椒的快速变红,尤其是绿辣椒。LED蓝光处理组在第4天时,绿辣椒a∗值由负值变为正值,第8天时a∗值达到33.2,接近红辣椒的a∗值,CK(G)的a∗值变化较小,第8天也仅为-18.1,说明LED蓝光对绿辣椒色泽影响极显著(P<0.01)。对红辣椒而言,0~6 d时LED(R)的a∗值高于CK(R),但差异不显著,直到第8天时LED(R)a∗值显著高于CK(R)(P<0.05),这一变化规律与色泽(图1)变化完全相符。此外,L∗值的下降与辣椒a∗值的上升是相对的,即a∗值越高,L∗值越低。
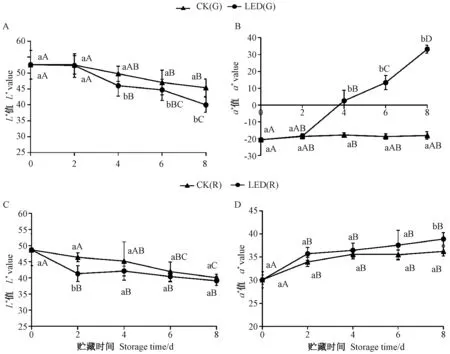
图2 LED蓝光处理对辣椒色泽的影响Fig.2 Effect of light-emitting diode blue light treatment on the color of peppers
2.2 LED蓝光对辣椒叶绿素含量的影响
辣椒在绿果期主要呈色物质为叶绿素。本研究中,红辣椒的叶绿素含量极低,几乎无法检测到,故仅对绿辣椒的叶绿素含量进行分析。由图3可知,随着贮藏时间的延长,LED(G)和CK(G)的叶绿素含量均呈下降趋势。LED(G)的叶绿素含量下降速率非常快,叶绿素每2天的含量变化差异显著(P<0.01),到第8天时下降至0.033 mg·g-1,仅为初始值(0 d)的17%;CK(G)叶绿素含量下降速率相对缓慢,从第0~第2天叶绿素含量下降相对较快,之后变化不明显,至第8天时叶绿素含量仍然为初始值(0 d)的82%。在整个过程中,LED(G)的叶绿素含量均显著低于同一时期CK(G)的含量,说明LED(G)的绿辣椒退绿速度显著高于同一时期CK(G)的退绿速度(P<0.01)。由此可知,LED(G)可显著加快绿辣椒的退绿,降低绿辣椒中叶绿素含量,此结果与LED蓝光对绿辣椒a∗值的影响规律一致(图2-B)。
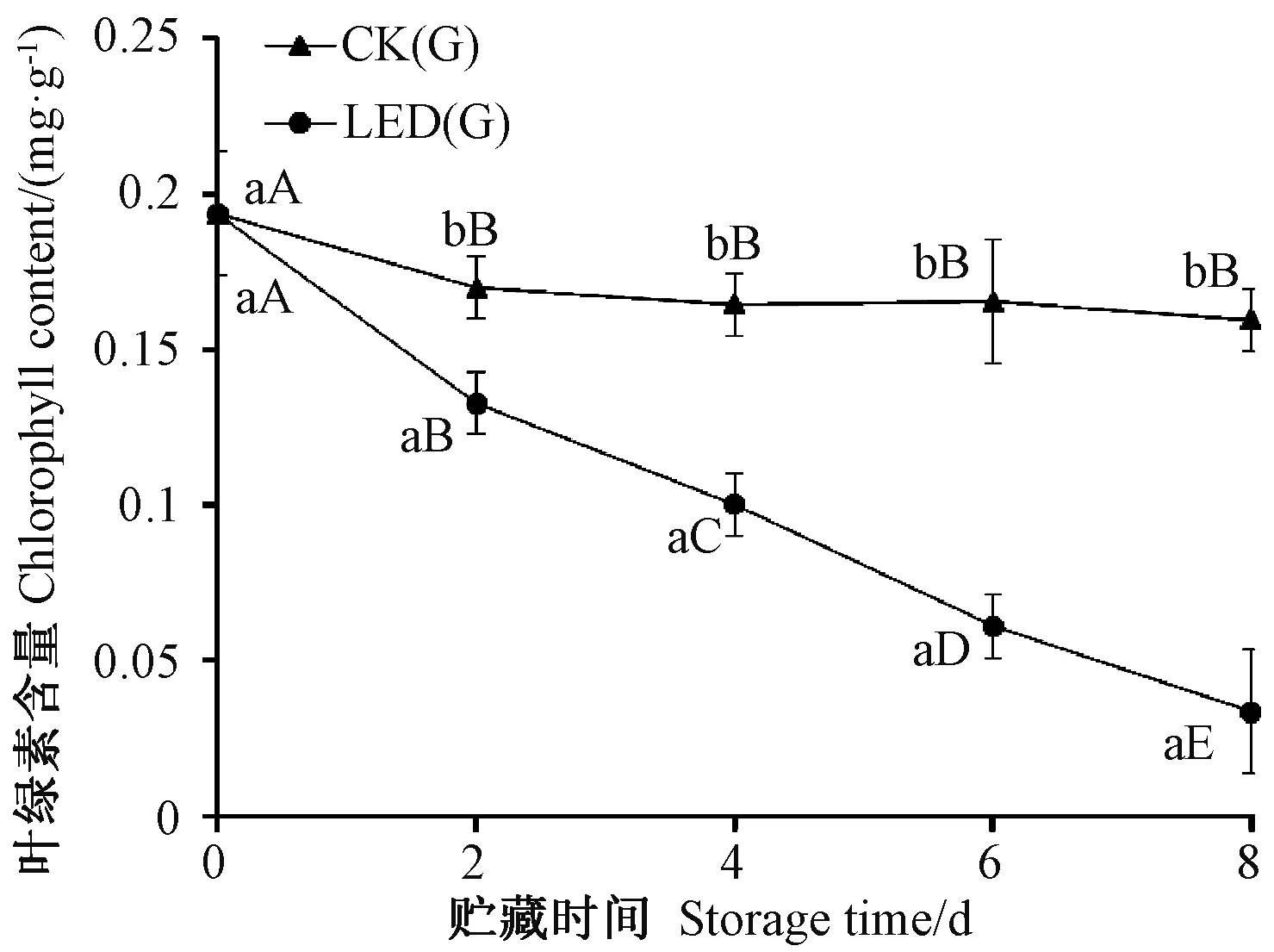
图3 LED蓝光贮藏对绿辣椒叶绿素含量的影响Fig.3 Effect of light-emitting diode blue light treatment on chlorophyll content of green peppers
2.3 LED蓝光对辣椒果实辣椒红素含量的影响
由图4可知,随着贮藏时间的延长,绿辣椒和红辣椒中辣椒红素的含量均呈上升趋势。与对照组相比,LED蓝光可显著提高红辣椒和绿辣椒中辣椒红素的含量。LED蓝光处理绿辣椒,前2 d对其辣椒红素含量影响不大,但从第4天开始辣椒红素含量显著高于CK(G),到第8天时,其辣椒红素含量已达到初始值(0 d)的7.47倍,而CK(G)仅为初始值的1.34倍。CK(R)和LED(R)中辣椒红素含量在贮藏期间均稳步上升,LED(R)辣椒红素含量从第2天开始(2、4、6和8 d)显著高于CK(R)(P<0.01),在第8天时,LED(R)的辣椒红素含量达到CK(R)的1.60倍。上述结果与LED蓝光对绿辣椒、红辣椒色泽及a∗值的影响相符。
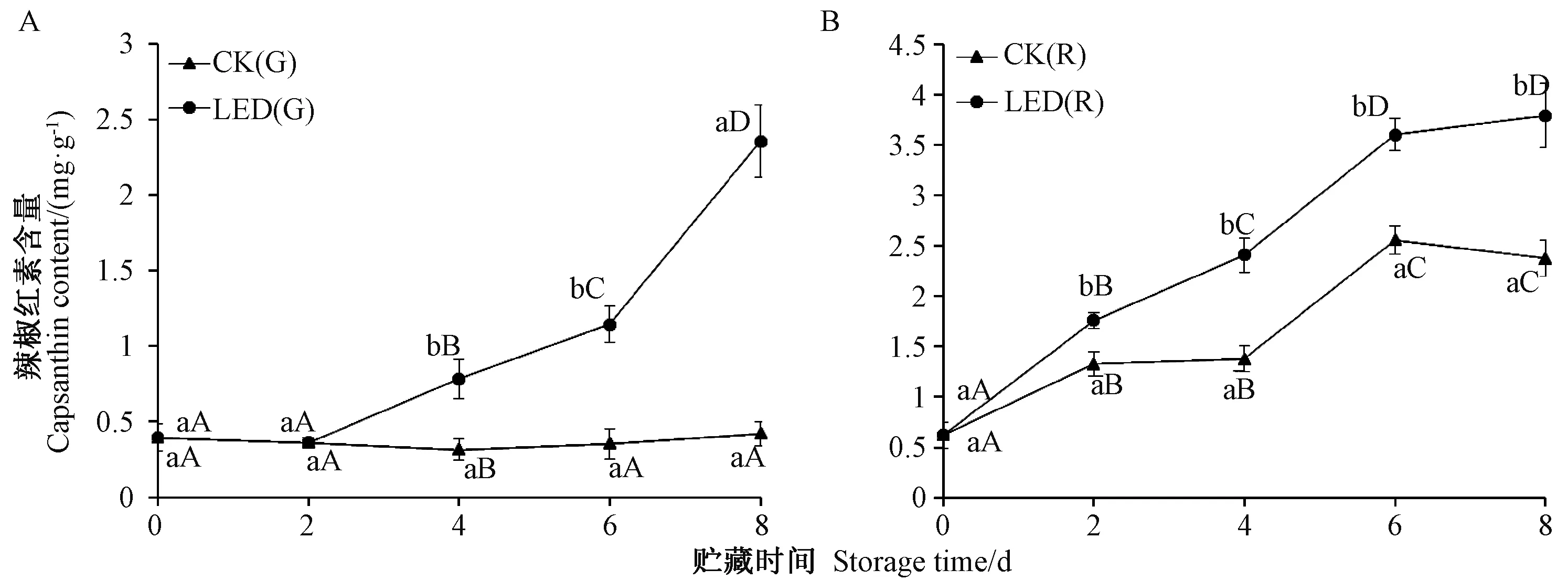
图4 LED蓝光处理对辣椒中辣椒红素含量的影响Fig.4 Effect of light-emitting diode blue light treatment on capsanthin content of peppers
2.4 LED蓝光对辣椒果实辣椒碱含量的影响
由图5可知,绿辣椒和红辣椒中辣椒碱含量在贮藏过程中均呈上升趋势,且LED蓝光处理可加速辣椒碱的生成。LED蓝光处理绿辣椒,前4 d对辣椒碱含量影响不显著,但从第6天开始,LED(G)中辣椒碱含量显著高于CK(G),到第8天时辣椒碱含量达到CK(G)的1.85倍(P<0.01)。LED蓝光处理红辣椒,前2 d对其辣椒碱含量影响不显著,但从第4天开始,LED(R)中辣椒碱含量快速增加,且含量显著高于 CK(R),到第 8天时,LED(R)中辣椒碱含量已达到0.420%,而CK(R)仅为0.274%,LED(R)辣椒碱含量为 CK(R)的1.53倍(P<0.01)。
2.5 LED蓝光对辣椒果实中Ccs基因表达
辣椒果实红色的深浅是由果实中辣椒红素及其含量决定的,而Ccs基因被认为是控制辣椒果实红色形成的关键基因,该基因的表达与否制约着辣椒果实中辣椒红素的合成[19]。由图6可知,从贮藏第2天开始,LED(G)果实中Ccs基因的表达水平就一直显著高于CK(G)的表达水平,而CK(G)的Ccs基因表达水平随着贮藏时间的延长一直保持在极低的水平。对红辣椒的Ccs基因而言,无论CK(R)组还是LED(R),在果实逐渐转红的过程中,Ccs基因的表达水平总体呈增加趋势,且LED(R)中Ccs基因的表达量显著高于CK(R)。
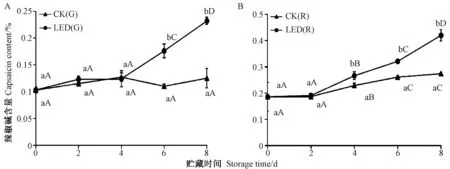
图5 LED蓝光处理对辣椒中辣椒碱含量的影响Fig.5 Effect of light-emitting diode blue light treatment on capsaicin content of peppers

图6 LED蓝光处理对辣椒中Ccs基因相对表达量的影响Fig.6 Effect of light-emitting diode blue light treatment on relative expression level of Ccs gene in peppers
2.6 LED蓝光对辣椒果实Vc含量的影响
Vc又名抗坏血酸,是一种水溶性的维生素,一般红辣椒中的Vc含量高于绿辣椒。由图7可知,在整个贮藏期间,CK和LED组的Vc含量均呈上升趋势,与相比,LED处理促进了绿辣椒和红辣椒中Vc含量的积累。CK(G)和LED(G)分别在第2、第4天表现出对Vc的显著积累,从第2天开始,LED(G)Vc含量显著高于CK(G)(P<0.01),到第8天时,LED(G)的Vc含量已达到20.208 mg·100g-1,相当于CK(G)的1.58倍。CK(R)和LED(R)分别在第2、第8天表现出对Vc的显著积累,且从第2天开始,LED(R)的Vc含量显著高于CK(R)(P<0.01),到第8天时,LED(R)的Vc含量是对照组含量的1.25倍。表明在采后贮藏过程中,LED蓝光处理能显著提高绿辣椒和红辣椒中Vc含量(P<0.01)。

图7 LED蓝光处理对绿辣椒Vc含量的影响Fig.7 Effect of light-emitting diode blue light treatment on Vc content of peppers
3 讨论
LED蓝光作为一种新型处理方式备受关注,但较多应用于辣椒幼苗的增壮和果实的增产中,在采后辣椒品质保持方面的应用尚鲜见报道。本试验采用LED蓝光照射处理采后红、绿辣椒,不仅操作简单,安全无污染,还具有改善辣椒色泽,提高辣椒营养成分含量等作用。
色泽是反映果蔬品质的重要指标。本研究中,LED蓝光能有效地促进红、绿辣椒的退绿和变红速率;贮藏第8天时LED(G)中叶绿素含量仅为0.033 mg·g-1,辣椒完全变红,辣椒红素含量远高于CK(G);LED(R)中辣椒红素也显著高于CK(R)。此外,LED蓝光处理可诱导辣椒Ccs基因的显著增量表达(P<0.01),从而有效调控辣椒红素的合成。王超等[20]、高波等[21]、李宁等[22]、伍新龄等[23]利用LED蓝光照射处理西芹、西兰花等绿色蔬菜时发现,10 μmol·m-2·s-1的蓝光照射可有效地保持西芹和西兰花中叶绿素的含量,延缓黄化速度,这与本试验结果不符,可能是因为西芹、西兰花中呈色物质比较单一,以叶绿素为主,而辣椒最终的呈色物质还包括辣椒红素和类胡萝卜素等。LED蓝光照射处理可诱导绿辣椒成熟,使其叶绿素的降解速度大于合成速度,并促使叶绿素最终含量下降,被叶绿素所掩盖的类胡萝卜素、辣椒红素的颜色随即显现,从而使整个辣椒色泽逐渐呈现红色。
Vc和辣椒碱是辣椒中主要的营养物质和呈味物质,辣椒因富含Vc,被称为蔬菜中的Vc之王[24]。任邦来等[25]、朱圆圆等[26]、李文文等[27]发现涂膜、保鲜剂、低温贮存等技术能有效延缓辣椒中Vc含量的下降速率。 本研究中,14 μmol·m-2·s-1LED 蓝光照射能有效提高采后辣椒中的Vc含量,红、绿辣椒中Vc含量在第8天时分别为CK的1.25倍和1.58倍,依次为初始值(0 d)的1.72倍和2.51倍。辣椒碱的积累与遗传背景有关,同时还受光照、温度、肥料、水分等环境因素的影响[28]。本试验中LED蓝光照射显著增加了红、绿辣椒中辣椒碱的合成,使得辣椒碱的含量在贮藏第8天时远高于CK,这与前人研究结果一致。
4 结论
本研究结果表明,运用 14 μmol·m-2·s-1LED 蓝光照射采后辣椒,可有效促进红辣椒和绿辣椒的变红和成熟,显著提高红、绿辣椒果实中辣椒红素含量,使红、绿辣椒在贮藏第8天时的辣椒红素含量分别达到CK的1.60倍和5.59倍,Ccs基因的表达量分别为CK的1.35倍和4.01倍;LED蓝光处理可促使绿辣椒退绿,显著降低绿辣椒中叶绿素含量。此外,LED蓝光照射处理能显著增加红、绿辣椒中辣椒碱和Vc含量,贮藏第8天,红、绿辣椒中辣椒碱含量分别为CK的1.53、1.85倍,Vc含量分别是CK的1.25倍和1.58倍。14 μmol·m-2·s-1的LED蓝光照射处理在提高采后辣椒的色泽和营养品质方面具有较好的应用前景。

