建国以来黑龙江省春小麦抗白粉病基因检测及其组成分析
刘文林 张宏纪 孙 岩 刘东军 杨淑萍 张 睿 孟庆林
(1黑龙江省农业科学院作物育种研究所,黑龙江哈尔滨 150086;2黑龙江省农业科学院对俄农业技术合作中心,黑龙江哈尔滨 150086;3黑龙江省农业科学院植物保护研究所,黑龙江哈尔滨 150086)
小麦白粉病(Blumeria graminisf.sp.Tritici)是影响我国小麦生产安全的主要病害之一,在各小麦主产区均有发生,发病后,通常能使产量降低 13%~34%[1]。选育和应用抗病品种是防治小麦白粉病害最有效、最经济的措施[2]。但由于小麦白粉病具有病原菌群体数量大、生理小种变异快、侵染时间长等特点,抗病基因很难保持长期的高效抗病性,因此,培育并推广含有多种抗病基因组合型小麦品种是防治白粉病最有效的措施[3]。研究表明,利用与抗病基因紧密连锁的分子标记对小麦抗白粉病基因进行辅助选择和鉴定,有助于加快抗病新品种的培育[4]。
小麦抗白粉病基因是由澳大利亚研究者Waterhouse于1930年首次在小麦品种Thew中发现的,此后各国的科学家在普通小麦、小麦近缘种和小麦近缘属中陆续发现小麦白粉病抗性新基因,并对小麦抗白粉病基因的遗传及染色体定位进行了深入的研究[5-7]。如目前已在普通小麦全基因组的54个基因位点,发现超过78个抗白粉病基因,大多数小麦抗白粉病基因已经被分子标记和染色体组定位[6]。由于有些基因标记检测过程复杂且效率低不能应用于育种实践,还有待开发出具有更高利用效率的功能标记。目前,育种实践上应用较多的是基于PCR技术的Pm2、Pm3、Pm4、Pm8、Pm13、Pm21 等基因的分子标记[8-10],特别是抗性最强、抗谱最广的Pm21的分子标记被广泛运用于国内冬小麦种质资源的抗病基因鉴定[11]。
黑龙江省是我国春小麦主产区之一,近年来随着品种、栽培、气候条件的改变,小麦白粉病有蔓延和加重的趋势,对抗白粉病小麦品种研究也越来越受到人们的重视[5]。目前小麦白粉病是国家东北春小麦晚熟组品种审定推广过程中的主要考察病害之一[4]。为阐明黑龙江春小麦抗白粉病基因携带类型及其分布现状,本研究选用连锁距离相对较近且稳定的Pm2、Pm3、Pm4、Pm8、Pm13、Pm21 等[12-15]抗白粉病基因的序列标签位点(sequence tag site,STS)或序列扩增区域(sequence-characterized amplified region,SCAR)分子标记,对黑龙江省生产上推广种植的123份春小麦品种进行抗白粉病基因标记检测,以期为黑龙江地区小麦抗白粉病育种相关的亲本组配和多基因聚合提供理论依据与技术支撑。
1 材料与方法
1.1 材料
黑龙江省春小麦品种123份(建国以后黑龙江省农作物品种委员会审定推广小麦品种180余份),涵盖省内7家育种单位。其中龙辐麦系列20份、龙麦系列10份、克字系列55份、垦红系列9份、垦大系列8份、东农系列11份、垦九与其他垦字系列10份。供试品种数量占本省所育成品种的65%以上。小麦抗白粉病基因Pm2、Pm3b、Pm4、Pm8、Pm13 和Pm21 的携带单个抗病基因阳性对照品种分别为Ulka、Sonara/8cc、KHapli/8cc、Kavkaz、R4A 和扬麦 5/Sub.6v(由黑龙江省农业科学院植物保护研究所孟庆林研究员提供)。
1.2 方法
1.2.1 供试引物 6对抗白粉病基因的PCR特异引物由生工生物工程(上海)股份有限公司合成(表1)。

表1 小麦抗白粉病基因引物序列表Table1 Wheat powdery mildew resistance gene primer sequence
1.2.2 白粉病调查 温室调查白粉病自然发病情况(黑龙江省农业科学院试验温室,在小麦生长季节,温室内15~25℃的温度和高湿环境为白粉病发生创造了理想的条件,白粉病自然发病情况十分严重,难以控制,即使每月多次使用化学药剂防治,少数感病品种植株叶片上仍有病斑产生,因此,本研究供试品种采取温室自然发病鉴定)。根据叶片的发病情况,确定小麦抗白粉病抗性级别为5个,即1代表高抗(全株无病),3代表抗病(仅植株基部叶片有少量病斑),5代表中抗(植株叶片有一些病斑),7代表感病(植株中上部叶片有较多病斑),9代表高感(植株全部叶片发病及穗部也有病斑),具体抗病级别按照GB/T 19557.2-2004(小麦新品种DUS测试指南)[19]进行。
1.2.3 DNA的提取 采用CTAB法[7]分别提取各个供试材料的基因组DNA。为了增加检测结果的准确性,每份材料至少提取3株叶片,分别用于检测其抗白粉病基因类型。
1.2.4 小麦抗白粉病基因分子标记检测 PCR反应体系均为 25 μL:模板 DNA 50 ng,10×buffer 2 μL,dNTP(25 μmol·L-1)0.2 μL,上游和下游引物(5 μmol·L-1)各1 μL,Taq DNA聚合酶1 U,用无菌蒸馏水补足至25 μL。PCR采用TC-512 PCR热循环仪(Techne,英国),反应程序:94℃预变性 5 min;94℃变性 30~60 s,52℃退火45~60 s,72℃延伸 30~90 s,35 个循环;72℃延伸 5 min;4℃保存。扩增产物用Sub-cel1R Model192高通量电泳槽(Bio-Rad,美国)在1.5%琼脂糖凝胶中进行电泳分离,采用缓冲体系为1×TAE溶液,120V电压电泳30~50 min,Bio-Rad GEL DocTMEQ凝胶成像系统(Bio-Rad,美国)照相后统计结果。
2 结果与分析
2.1 供试品种抗白粉病标记检测
利用Mohler等[16]发表的Pm2基因的显性STS标记对123份小麦进行检测,由图1可知,117份小麦材料扩增出一条大小为498 bp的特异性片段,与含有该基因的对照品种Ulka目标条带相同,说明这些品种含有抗Pm2基因,占所有供试品种的95.1%;而克旱9、克旱19和克丰4等6份材料没有扩增出相应的目标条带,说明不含有抗Pm2基因。
利用Tommasini等[17]发表的Pm3b基因的显性STS标记对123份小麦进行检测,由图2可知,117份小麦材料可扩增出一条大小为721 bp的特异性片段,与含有该基因的对照品种Sonara/8cc相同,说明这些品种含有Pm3基因,占所有供试品种的95.1%。而其他品种克旱11、克旱14、克旱19、克丰4、垦九9、龙辐麦19没有该基因。

图1 部份小麦品种抗Pm2基因检测的电泳图谱Fig.1 Electrophoresis detection of Pm2 gene in wheat cultivar

图2 部份小麦品种Pm3b基因检测的电泳图谱Fig.2 Electrophoresis detection of Pm3 gene in wheat cultivar
利用刘金元等[8]设计的Pm4基因的显性PCR标记对123份小麦进行检测,用该标记检测含有Pm4a和Pm4b基因的对照品种KHapli/8cc均可检测出470 bp特异性片段,而不含有该基因的则无该条带产生。由图3可知,所有的供试小麦品种中都没有扩增出与对照品种相同的特异条带,表明不含有抗Pm4基因。
利用Francis等[9]开发的Pm8显性基因的PCR分子标记对123份小麦进行检测。含有该基因的对照Kavkas可扩增出一条1.5 kb的特异条带,反之无条带产生。由图4可知,供试的所有小麦品种中,只有龙辐麦17扩增出与目的基因相同的特异条带,说明含有Pm8基因,占所有品种0.8%,而其他品种没有该基因。

图3 部份小麦品种Pm4基因检测的电泳图谱Fig.3 Electrophoresis detection of Pm4 gene in wheat cultivar

图4 部份小麦品种Pm8基因检测的电泳图谱Fig.4 Electrophoresis detection of Pm8 gene in wheat cultivar
利用Cenci等[10]发表的SCAR标记检测Pm13基因,含有该基因的对照品种R4A可扩增出一条564 bp的特异条带,不含有Pm13基因的材料则不能扩增出相对应的特异条带。由图5可知,供试的所有小麦品种中,有116份材料能扩增出目的基因的特异条带,说明这些品种含有Pm13基因,占所有品种94.3%。而克旱 19、克丰 4、东农 111、北麦 2、北麦 3、龙辐麦 19、龙辐麦20等品种不含该基因。
利用Qi等[18]开发的SCAR标记检测Pm21基因,含有该基因的对照品种扬麦5/Sub.6v可扩增出1 260 bp特异条带,反之无条带产生。由图6可知,在检测的供试小麦品种中,所有的都没有扩增出与目标基因相同的特异条带,说明供试的黑龙江春小麦品种中均不含有抗Pm21基因。
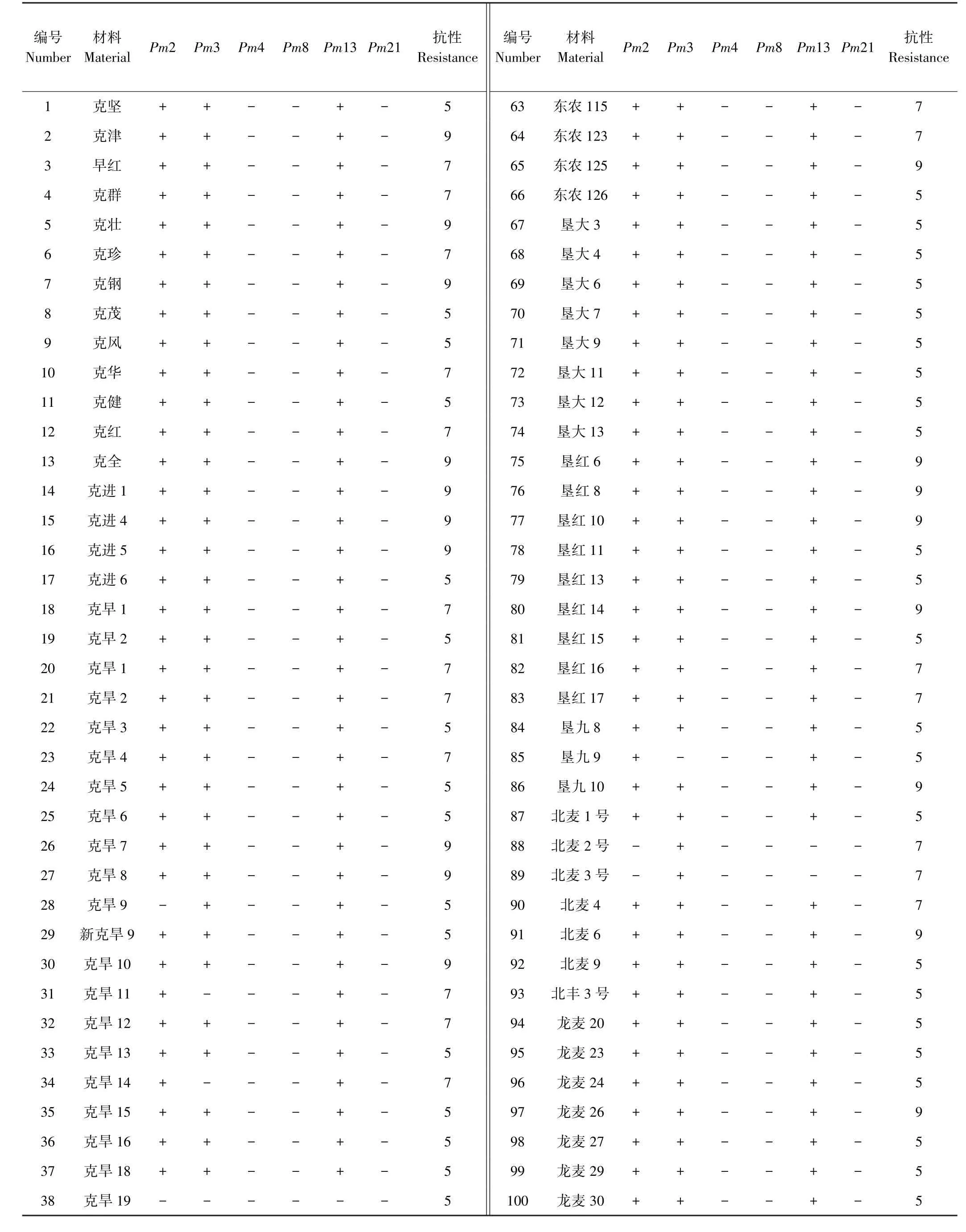
表2 黑龙江省小麦抗白粉病基因检测及抗性表型鉴定结果Table2 Results of wheat powdery mildew resistance gene detection and resistance phenotype identification in Heilongjiang Province
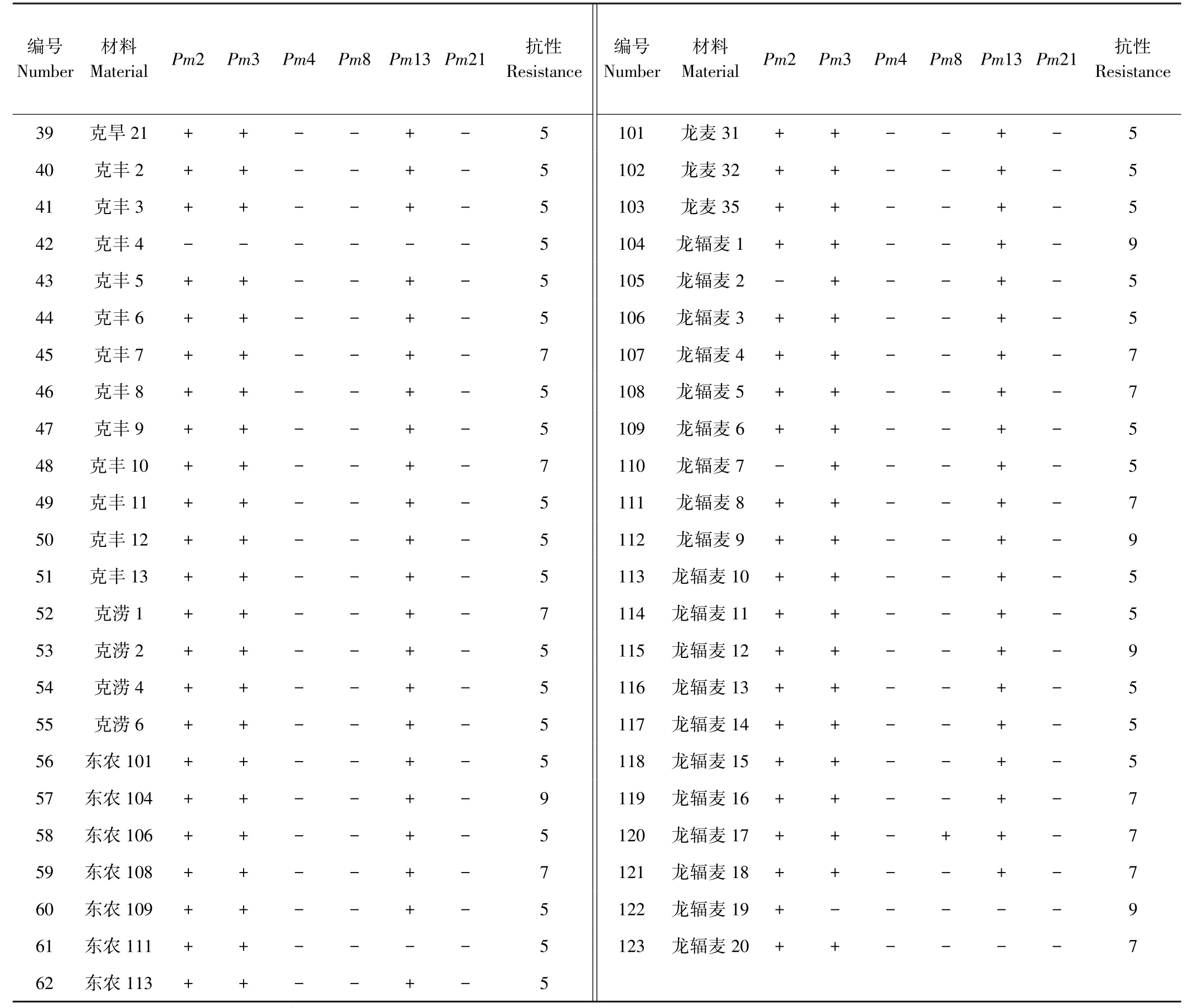
表2(续)

图5 份小麦品种Pm13基因检测的电泳图谱Fig.5 Electrophoresis detection of Pm13 gene in wheat cultivar

图6 份小麦品种Pm21基因检测的电泳图谱Fig.6 Electrophoresis detection of Pm21 gene in wheat cultivar
2.2 抗白粉病基因组合在黑龙江省小麦品种中的分布
由表3可知,在黑龙江省123份春小麦品种中小麦抗白粉病基因组合共有8种类型,其中龙麦30、龙麦35、龙辐麦12和龙辐麦18等109份以Pm2/Pm3/Pm13类型所占比例最高,为88.6%;其他7种类型依次为:克旱11和克旱14等3份是Pm2/Pm13类型,所占比例为2.4%;龙辐麦2和龙辐麦7等3份是Pm3/Pm13类型,所占比例为2.4%;东农111和龙辐麦20是Pm2/Pm3类型,所占比例为1.6%;北麦2和北麦3是Pm3类型,所占比例为1.6%;龙辐麦19是Pm2类型,所占比例为0.8%;龙辐麦17是Pm2/Pm3/Pm8/Pm13类型,所占比例为0.8%;在克丰4和克旱19小麦中没有检测出上述基因,所占比例为1.6%。

表3 黑龙江省春小麦资源抗白粉病基因组合分布Table3 The distribution of powdery mildew resistance gene composition of spring wheat in Heilongjiang Province resources
2.3 小麦抗白粉病基因组合在黑龙江省不同育种单位之间分布
由表3、表4可知,黑龙江省小麦抗白粉病基因组合存在8种类型,在不同育种单位之间抗白粉病基因组合和数量存在差异。其中黑龙江省农业科学院作物育种研究所辐射与生物技术研究室培育的龙辐麦系列品种所含有白粉病基因抗病组合最多,为5种;其次为黑龙江省农业科学院克山分院培育的克字系列品种,为4种;黑龙江省农垦总局九三科研所培育的垦字系列品种,为3种;东北农业大学的培育东农系列品种为2种;北大荒垦丰种业股份有限公司、黑龙江省八一农垦大学的垦大系列,黑龙江省农垦总局红兴隆科研所的垦红系列和黑龙江省农业科学院作物育种所小麦室的龙麦系列的抗病基因组合类型最少,分别为1种。
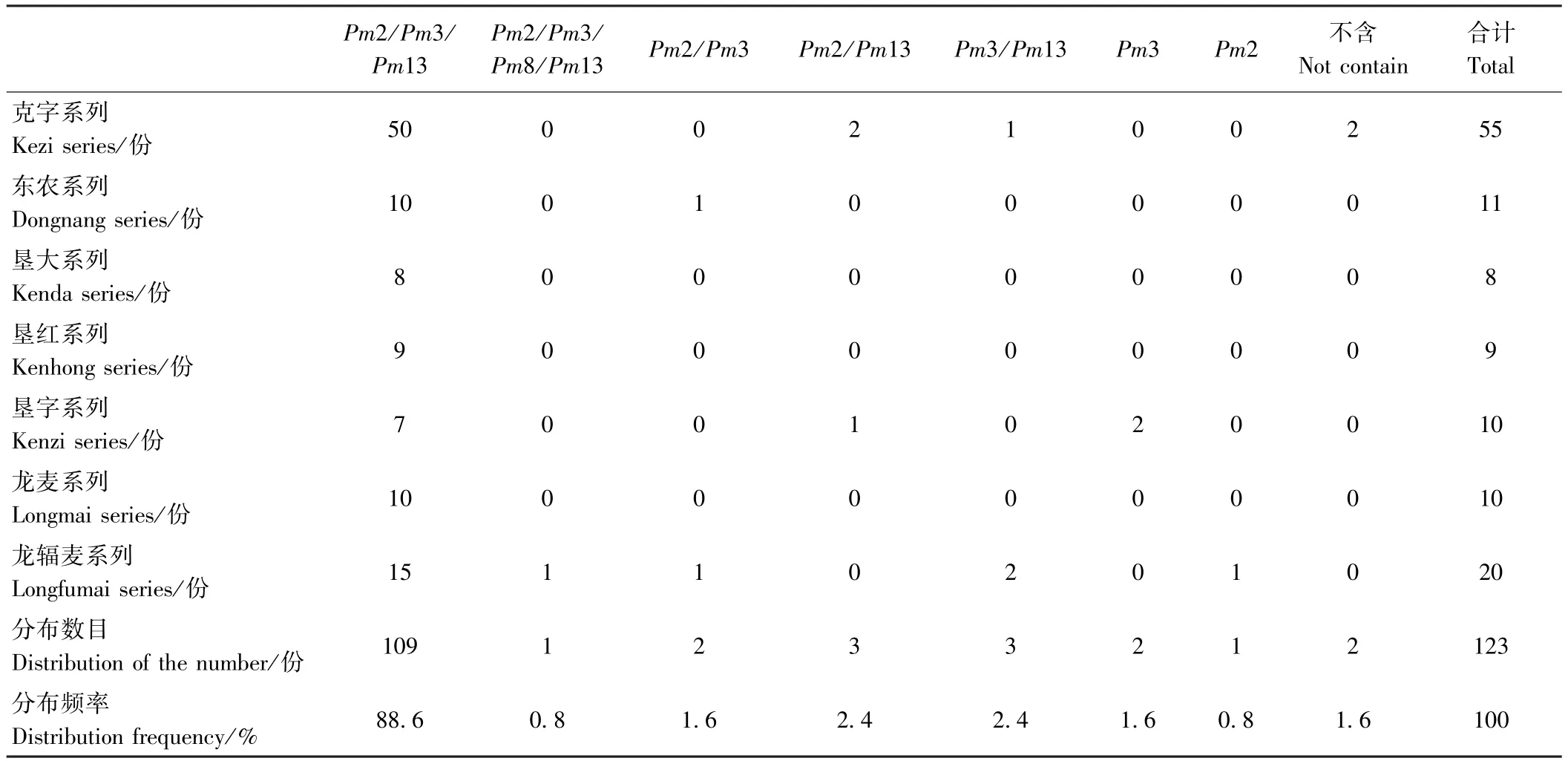
表4 小麦抗白粉病不同基因组合在黑龙江省不同育种单位之间的分布Table4 Distribution of wheat powdery mildew resistance gene combinations in different breeding units in Heilongjiang Province
2.4 供试小麦品种白粉病抗性鉴定及其基因组成
供试的123份小麦品种在温室自然条件下的抗白粉病的表型鉴定发现(表2),这些小麦品种的抗性表型分为3种类型,即中抗(抗病等级为5)、感病(抗病等级为7)和高感(抗病等级为9),不存在抗病(抗病等级为3)和高抗(抗病等级为1)类型。由表5可知,72份中抗白粉病品种的基因组成为Pm2/Pm3基因型1份、Pm2/Pm13基因型3份、Pm3/Pm3基因型1份、Pm2/Pm3/Pm13基因型63份、不含有抗病基因2份。28份感白粉病品种中Pm3基因型2份、Pm2/Pm13基因型1份、Pm2/Pm3/Pm13基因型24份、Pm2/Pm3/Pm8/Pm13基因型1份。23份高感白粉病品种中含Pm2基因型1份、含Pm2/Pm3/Pm13基因型22份。
虽然供试的小麦品种有部分表现出中抗水平,但是基本上所有的品种都没有达到免疫和高抗水平,说明抗白粉病基因Pm2、Pm3、Pm8、Pm13及其组合对黑龙江省当地白粉病生理小种的抗病力表现一般,有待引入新的抗白粉病基因。
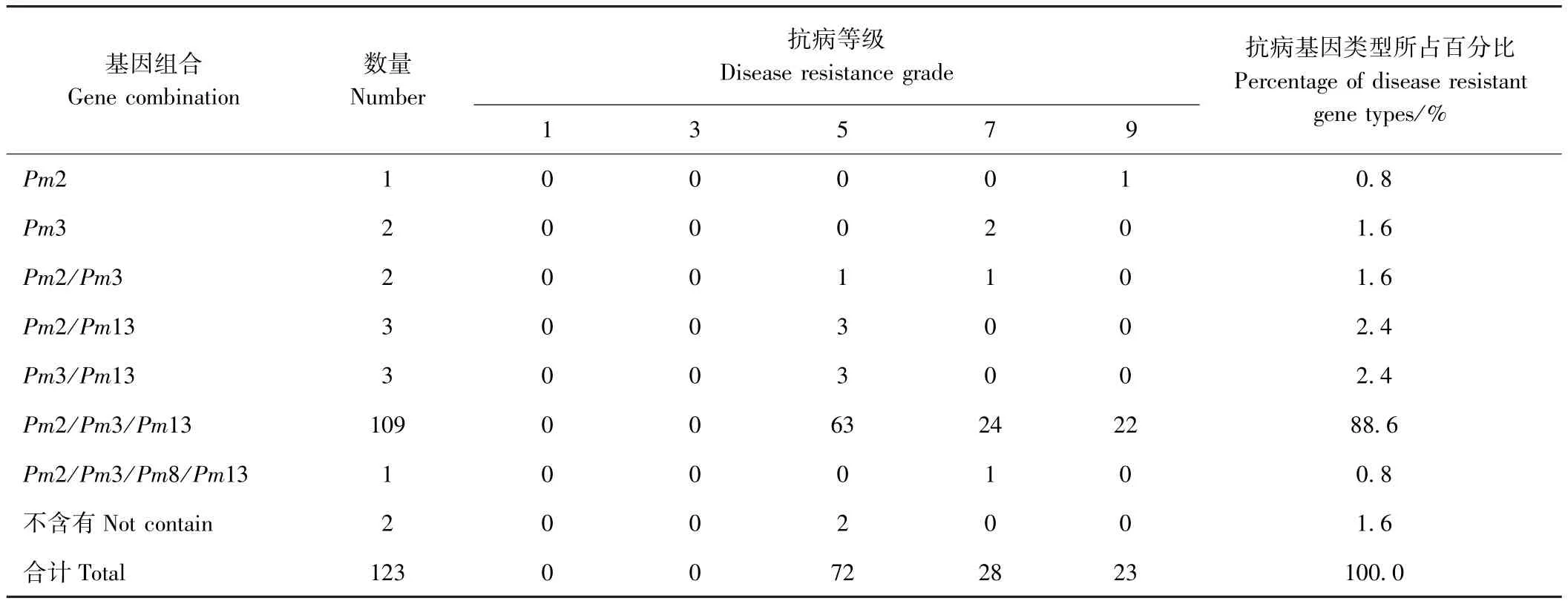
表5 不同抗白粉病组合在田间抗性分析Table5 Resistance analysis of different resistance to Powdery Mildew in field
3 讨论
本研究对黑龙江省123份春小麦品种白粉病基因进行检测,得到了抗白粉病基因组成和分布规律,发现在黑龙江省小麦中,抗白粉病基因Pm2、Pm3和Pm13分布频率较高,分别为95.1%、95.1%和94.3%,抗白粉病Pm8分布频率较低,仅为0.01%,而不存在抗白粉病基因Pm4和Pm21,抗病基因类型比较单一;通过在温室自然条件下的抗白粉病的表型鉴定发现,不存在高抗和抗病类型,基本都是中抗和高感类型,抗病能力较低。以上结果与前人对黑龙江省小麦白粉病菌小种毒性基因频率进行研究时所得结果一致[20-21]。陈秀梅等[21]对黑龙江省春小麦白粉病病菌毒性基因的研究发现,Pm2毒性基因频率为27.3%,Pm3b毒性基因频率为92.4%、Pm4a毒性基因频率为14.2%、Pm4b毒性基因频率为12.3%、Pm8毒性基因频率为100%、Pm13毒性基因频率为14.2%、Pm21毒性基因频率为4.5%,相对应的抗白粉病基因抗性依次为Pm21>Pm4>Pm13>Pm2>Pm3b>Pm8,说明黑龙江省小麦白粉病总体抗性较低,可能与供试品种携带不抗病的Pm3和Pm13基因多,而抗病的Pm21少有关。此外,本研究还发现,在黑龙江省小麦品种中小麦抗白粉病基因组合共有8种类型,Pm2/Pm3b/Pm13组合所占比例高达88.6%,其他类型所占比例均较低,抗病组合类型也比较单一,Pm2/Pm3b/Pm3白粉病基因抗性降低,不利于控制白粉病病情,表明黑龙江省内小麦育种单位应加大力度鉴定新的抗原材料,引进Pm4和Pm21等新的、高效的抗白粉病基因。但是引进抗白粉病基因的同时,应当注意,即使Pm21被公认为白粉病抗性最强、抗谱最广,但Pm21毒性基因在黑龙江省内生态区仍有可能发生,因此,在引进使用Pm21抗病基因的同时,还需引进其他类型的抗白粉病基因[22-26]。
供试的123份春小麦品种涵盖了黑龙江省内6家育种单位,审定推广的小麦品种的主要农艺性状各具特点,分别适应于黑龙江省北部高寒冷凉区(克字系列、垦字系列)、东部湿润区(垦大系列、垦红系列、部分龙麦系列)、中、南部早熟干旱高温区(部分龙麦龙辐系列、部分垦大系列)三个生态区[27]。虽然所分析的小麦抗白粉病基因组合类型Pm2/Pm3b/Pm13在各育种单位所占比例不同(7%~50%),但都是以该组合为主要类型,其原因可能与黑龙江省小麦品种演替过程中,为改良品种的锈病抗性,普遍使用高抗锈病的几个原始亲本有关[28]。
本研究所检测的6个抗白粉病基因,无论单独或组合存在,与小麦白粉病表型抗性的相关性均不高,说明这些抗病基因对目前黑龙江省存在的白粉病生理小种无显著的抗性。但是在分析供试品种的表型抗性时,发现感病和高感类型虽有较高的比例(28份+23份=51份),实际上中抗类型所占比例最高(72份),且都以Pm2/Pm3/Pm13组合为主。说明这部分基因的存在对小麦品种的白粉病抗性提高有一定的影响,但这种影响比较局限,不存在明显的规律(Pm2/Pm3/Pm8/Pm13类型为0.8%,中抗表型无)。这可能与存在其他类型的抗白粉病基因有关,因此黑龙江省小麦抗白粉病的分子基础准确的结论还需进一步更深入研究。
4 结论
本研究结果表明,黑龙江省推广种植的123份小麦品种中含有4种抗白粉病基因,90%以上的品种有Pm2、Pm3和Pm13基因;供试小麦品种的抗性表型主要以中抗、感病和高感类型为主;被检测出的4种抗病基因单独或其组合存在,供试小麦品种的白粉病抗性没有达到抗病以上水平。本研究首次报道了黑龙江春小麦生态区抗百粉病基因及其组成,但是不足之处在于供试小麦材料遗漏了本生态区推广过的约30%的品种,这可能导致某些抗病基因或抗病品种未能被检测出来,因此还需要补充其他遗漏品种进行抗病表型鉴定和抗病基因分子标记检测。本试验结果为筛选黑龙江省小麦抗白粉病抗病品种,引入新的抗病基因及小麦抗白粉病育种提供了理论依据。

