肺泡灌洗液革兰氏染色与内毒素检测对革兰氏阴性菌呼吸机相关性肺炎快速诊断的比较研究
周红卫,黄志俭
(北京中医药大学附属厦门市中医院急诊科ICU,福建 厦门 361009)
呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)是重症监护病房患者最常见的医院获得性感染,病死率高达24%~50%[1],其中革兰氏阴性菌感染占70%[2],故此快速诊断革兰氏阴性菌呼吸机相关性肺炎尤为重要。传统的病原学培养往往需要48~72 h,一旦发生VAP,经验常会采用广谱抗生素治疗,甚至过度治疗,往往导致细菌耐药和患者经济负担加重。鉴于此,及时提供病原学的信息对指导抗生素的合理应用是目前医务工作者亟需解决的难题。
1 资料与方法
1.1 临床资料 为2014年10月至2016年1月入住本院综合ICU需有创机械通气的成人患者,VAP的诊断依据美国胸科学会、美国传染病学会对于VAP临床诊断标准[3]。排除标准:肺部有原发性感染、全身慢性疾病(结核、肿瘤等)、因非VAP原因死亡、放弃治疗、无法获得知情同意书者。最终有65例纳入本研究,其中男44例(64.62%),女21例(35.38%),平均年龄(49.91±17.86)岁。入选患者中,重型颅脑26例,脑出血15例,重症胰腺炎2例,多发伤15例,心肺复苏术后4例,重症哮喘2例,重症肌无力1例。
1.2 方法
1.2.1 肺泡灌洗的方法 患者在24小时内发现符合VAP诊断标准者,患者术前禁食2 h,监测心率、血压、经皮血氧饱和度(SpO2),调整呼吸机模式为控制通气,呼吸末正压(PEEP)为10 cmH2O,吸入氧浓度(FiO2)为100%,肺泡灌洗前给予丙泊酚或咪达唑仑镇静。使用PENTAX FB-15BS支气管镜经气管插管接三通管由活瓣密闭端进入主气管,依据胸片或CT片引导插入感染肺段,从活检孔注入37℃生理盐水行支气管肺段灌洗,注入50 ml,用负压吸引回收至除去热源的器皿中-70℃保存,若病变为弥漫性或影像学无渗出病变时,可灌右中叶或右下叶。灌洗过程中如SpO2降至85%立即停止操作,退镜后待SpO2恢复至90%以上再行灌洗。肺泡灌洗并送细菌培养+药敏,革兰氏染色。
1.2.2 分组 根据病原学结果,将患者分为革兰氏阴性杆菌感染组(A组),非革兰氏阴性杆菌感染组(B组);根据肺泡灌洗液中革兰氏染色结果和内毒素水平将患者分为革兰氏染色阴性菌组(C组)和内毒素水平≥6 EU/ml组(D组)。
1.2.3 肺泡灌洗内毒素的检测方法 检测前将肺泡灌洗液融化,用离心机以1 800转/min的转速离心10 min,采用鲎试剂的显色基质法,根据标准曲线,依据吸光度检测肺泡灌洗液中内毒素的含量,检测试剂及设备均由厦门市鲎试剂厂提供。
1.3 统计学方法 应用SPSS 18.0统计分析软件进行统计学处理。计量资料以“±s”表示,两组间计量资料的比较采用t检验的方法,两组间计数资料的比较采用χ2检验;采用受试者工作特诊曲线(ROC)分析内毒素的灵敏度和特异度,曲线下面积,以P<0.05为差异有统计学意义。
2 结果
最终有65例患者纳入本研究,其中A组51例,B组14例,C组33例,D组50例;A组中,病原学为铜绿假单胞菌23例(45.10%),鲍曼不动杆菌15例(29.41%),大肠埃希氏菌5例(10.00%),肺炎克雷伯菌3例(5.88%),嗜麦芽窄食单胞菌3例(5.88%),洋葱伯克霍尔德菌2例(3.92%);B组中病原学为耐甲氧西林的葡萄球菌(MRSA)6例(其中2例合并真菌感染)(42.86%),耐甲氧西林的表皮葡萄球菌(MRSE)3例(21.43%),凝固酶阴性的葡萄球菌(MRCNS)2例(14.29%),对甲氧西林敏感的葡萄球菌(MSSA)2例(14.29%),MSSA合并真菌混合感染1例(7.14%)。
A组与B组白细胞计数、C反应蛋白、降钙素原、APACHⅡ评分及性别比例差异无统计学意义;A组肺泡灌洗液中内毒素水平显著高于B组(P<0.05);C组中革兰氏阴性菌VAP患者24例,D组中革兰氏阴性菌VAP患者46例,D组中革兰氏阴性菌VAP所占的比例显著高于C组(P<0.05);ROC曲线分析表明,以≥6 EU/ml为界点,肺泡灌洗内毒素检测革兰氏阴性杆菌脓毒血症的灵敏度95.9%,特异度68.7%,阳性预测值92.0%,阴性预测值77.78%,曲线下面积为0.857(P<0.05),95%可信区间为0.721~0.993,见表1和表2,图1。
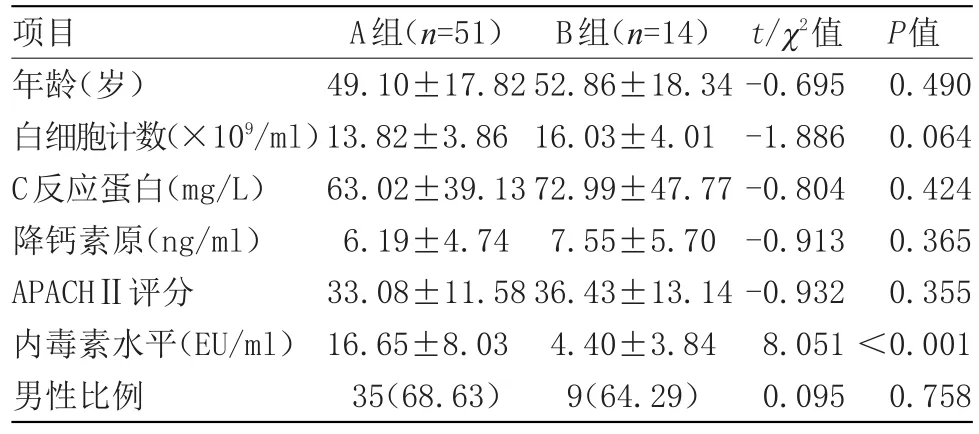
表1 A组与B组BALF中内毒素及相关实验参数的比较情况Table 1 Comparison of endotoxin and related experimental parameters in BALF between groupAand group B

表2 C组与D组革兰氏阴性菌VAP所占比率的比较情况Table 2 Comparison of VAP ratio of gram negative bacteria in group C and group D
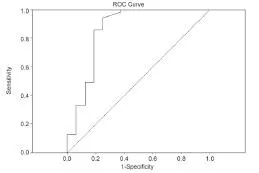
图1 BALF中内毒素的ROC曲线Figure 1 ROC curve of endotoxin in BALF
3 讨论
VAP是ICU患者最常见的院内感染性疾病,一旦发生VAP,患者的预后将显著恶化。早期快速诊断对于改善VAP患者预后是至关重要的。但是VAP的快速诊断一直是危重医学科面临的一个挑战。
革兰染色是细菌学最常用的一种鉴别染色方法,此染色法将细菌分为两大类,可能有助于鉴别细菌及治疗时选择适当的抗菌药物,但存在着较大的争议性。Bouza等[4]研究认为,由于微生物的鉴定和药物敏感性试验通常需要3~4 d,但临床实践中临床医生需要有用而快速的信息,即使部分或者不太完善,显然仍比一个完美但延迟的报告好很多,其中革兰染色就是一个直接的能够指导治疗并且与最终的培养结果有着合理相关性的实验诊断方法,因此,革兰染色是VAP快速诊断的有效方法。Uehara等[5]研究表明革兰染色的结果直接影响着抗生素的选择,从而影响患者的病死率。但也有研究表明革兰氏染色法准确度有很大的变异性,主要是由于菌种的菌龄、细菌得堆积密度、碘液媒染时间和乙醇溶液脱色时间等因素均会影响革兰氏染色结果的正确性。Croce等[6]给232例患者行443次肺泡灌洗,结果发现,革兰氏染色在80%的革兰氏阳性菌VAP及40%的革兰氏阴性菌VAP患者中发现革兰氏阳性菌,在52%的革兰氏阳性菌VAP和77%的革兰氏阴性菌VAP患者中发现革兰氏阴性菌。B Allaouchichede等[7]研究及近期一荟萃分析[8]均发现,革兰氏染色法虽有助于诊断早期VAP,但并不能有效的用于区分病原体,指导抗生素的使用。
在我们的研究中,51例革兰氏阴性菌VAP患者中只有64.71%患者革兰氏染色为阴性菌,37例革兰氏染色为阴性菌患者中只有72.73%患者为革兰氏阴性菌VAP,27.27%革兰氏阳性VAP患者革兰氏染色为阴性菌,14例革兰氏阳性菌VAP中64.29%的患者革兰氏染色为阴性菌。从我们研究结果表明革兰氏染色不能有效的区分VAP患者的病原体,从而指导抗生素的应用。
内毒素是革兰氏阴性细菌胞壁结构中的脂多糖,脂多糖经细菌胞壁合成后被转运到细胞表面构成胞壁外膜的组成成分,故此通过内毒素检测可判断是否有革兰氏阴性菌感染[9]。在我们的研究中通过检测肺泡灌洗中内毒素水平发现,以≥6 EU/ml为界点,肺泡灌洗液内毒素检测革兰氏阴性杆菌脓毒血症的灵敏度95.9%,特异度68.7%,阳性预测值92.0%,阴性预测值77.78%,是一种快速诊断革兰氏阴性菌VAP的有效方法。分组中,革兰氏阴性菌VAP患者肺泡灌洗液内毒素水平显著高于革兰氏阳性球菌组,也充分说明肺泡灌洗液中内毒素对快速鉴别革兰氏阴性菌和革兰氏阳性球菌有较好作用。我们的研究结果与国外一些相关研究[10-12]有非常相似的一致性。
肺泡灌洗液内毒素检测与革兰氏染色法相比,BALF中内毒素水平≥6 EU/ml患者中革兰氏阴性菌VAP所占的比例显著高于革兰氏染色为阴性菌的患者。这表明,BALF中内毒素检测对诊断革兰氏阴性菌VAP作用显著优于革兰氏染色法。我们的研究也存在一定局限性,如一些VAP患者在行肺泡灌洗前已经经验使用抗生素,对肺泡液中内毒素水平检测有一定的影响;其次,一些VAP患者合并真菌感染,有研究发现[13-14]念珠菌细胞壁上的β-葡聚糖,通过活化G因子可产生凝集反应,导致内毒素检测假阳性,对研究结果也有一定的干扰;再者我们的样本量有限,肺泡灌洗不是采用保护性肺泡灌洗的方法,保本采集存在一定的污染,对内毒素检测也有一定的影响,有待改进。
目前,国内各个医院ICU中基本都配备有纤维支气管镜,而且肺泡灌洗方法简单易行,内毒素检测快捷经济,故此,通过BALF中内毒素检测是一种快速、简便、经济、有效的诊断革兰氏阴性菌VAP的方法,而且对指导抗生素的应用有一定的作用,值得广泛推广应用。

