不同剂量异烟肼治疗结核性脑膜炎的临床效果
陈久容 张翼 曹惠敏 余刚


[摘要]目的 探討静脉使用不同剂量异烟肼(INH)治疗结核性脑膜炎的临床效果。方法 选取2012年1月~2017年7月重庆医科大学附属第一医院收治的78例结核性脑膜炎患者作为研究对象,根据静脉给予INH的剂量不同分为900 mg组(40例)、600 mg组(38例),其他抗结核治疗方案均相同。使用高效液相色谱法测定并比较两组患者的脑脊液(CSF)中INH的含量,并分析两组患者的疗效、CSF变化及不良反应。结果 900 mg组患者CSF中的INH浓度高于600 mg组,差异有统计学意义(P<0.05);两组患者的治疗有效率比较,差异无统计学意义(P>0.05);900 mg组患者治疗后的CSF蛋白低于600 mg组,差异有统计学意义(P<0.05);900 mg组患者治疗后的CSF压力及CSF蛋白均低于治疗前,差异有统计学意义(P<0.05);600 mg组患者治疗后的CSF压力低于治疗前,差异有统计学意义(P<0.05),而600 mg组患者治疗后的CSF蛋白水平与治疗前比较,差异无统计学意义(P>0.05);900 mg组的不良反应发生率高于600 mg组,差异有统计学意义(P<0.05)。结论 结核性脑膜炎患者静脉给予不同剂量INH与临床疗效有关,INH剂量的增加更有利于CSF压力及CSF蛋白的恢复,但也增加了不良反应的发生。
[关键词]结核性脑膜炎;异烟肼;不同剂量;脑脊液
[中图分类号] R742.6 [文献标识码] A [文章编号] 1674-4721(2019)11(a)-0045-05
Clinical effect of different doses of Isoniazid in the treatment of tuberculous meningitis
CHEN Jiu-rong ZHANG Yi CAO Hui-min YU Gang
Department of Neurology, the First Affiliated Hospital of Chongqing Medical University, Chongqing Key Laboratory of Neurology, Chongqing 400016, China
[Abstract] Objective To investigate the clinical effect of different doses of Isoniazid (INH) in the treatment of tuberculous meningitis. Methods A total of 78 patients with tuberculous meningitis treated in the First Affiliated Hospital of Chongqing Medical University from January 2012 to July 2017 were selected as the subjects. They were divided into 900 mg group (40 cases) and 600 mg group (38 cases) based on different doses of INH were given, other anti-tuberculosis treatments were same. High performance liquid chromatography (HPLC) was used for the determination of concentration of INH in cerebrospinal fluid (CSF). Therapeutic efficacy, CSF change and untoward reaction were evaluated between the groups. Results The concentration of INH in CSF in the 900 mg group was higher than that in the 600 mg group, and the difference was statistically significant (P<0.05). The difference of treatment effective rates between the two groups was not significant (P>0.05). The CSF protein in the 900 mg group was lower than that in the 600 mg group after treatment, and the difference was statistically significant (P<0.05). In 900 mg group, the CSF pressure and protein after treatment were lower than those before treatment, and the differences were statistically significant (P<0.05). In 600 mg group, the CSF pressure after treatment was lower than that before treatment, and the difference was statistically significant (P<0.05). The difference of CSF protein between before and after treatment was not significant (P>0.05). The incident of untoward reactions in 900 mg group was higher than that in 600 mg group, and the difference was statistically significant (P<0.05). Conclusion Different doses of INH given intravenously to patients with tuberculous meningitis are related to the clinical efficacy. The increase of INH dose is more conducive to the recovery of CSF pressure and CSF protein, but also increases the occurrence of adverse reactions.
[Key words] Tuberculous meningitis; Isoniazid;Different concentration; Cerebrospinal fluid
结核性脑膜炎是一种严重的中枢神经系统感染性疾病,占神经系统结核的70%左右,也是常见的、对机体危害最重的一种肺外结核,在第三世界国家的患病率高达7~12%[1-2],在我国的发病率较高,并呈逐年递增的趋势。近年来,由于艾滋病的流行及耐药结核杆菌的出现,结核性脑膜炎的患病率和死亡率明显增加,随着医疗技术的高速发展,结核性脑膜炎的诊治水平也有明显提高,但死亡率仍高达15~20%[3-5]。由于血脑屏障通透性等原因,不同抗结核药的脑脊液(cerebrospinal fluid,CSF)药物浓度低于其在血液中的浓度,难以达到理想的治疗效果[6]。异烟肼(Isoniazid,INH)具有血脑屏障良好通透性及较强的杀结核杆菌作用,常作为治疗结核性脑膜炎的首选药物[7]。但目前对不同剂量INH在人体CSF中浓度的相关研究报道较少,且当前对急性期给予多大的合适剂量临床尚存在一定争议,由于CNS结核的严重性及复杂性,且透过血脑屏障CSF浓度和外周血的浓度可能存在差异,有专家建议急性期根据病情严重程度及并密切观察药物副作用的前提下,给予短程高剂量的INH治疗,临床疗效及预后可能更好[8]。基于此,本研究拟通过高效液相色谱法,检测静脉给予不同剂量INH治疗的结核性脑膜炎患者CSF的压力及蛋白等指标,探讨INH的药物疗效及不良反应与INH剂量效应的关系,为临床用药选择提供一定的指导作用,现报道如下。
1资料与方法
1.1一般资料
选取2012年1月~2017年7月我院收治的78例结核性脑膜炎患者作为研究对象,根据静脉给予INH的剂量不同分为600 mg组(38例)与900 mg组(40例)。600 mg组中,男20例,女18例;年龄16~58岁,平均(36.4±11.8)岁;900 mg组中,男22例,女18例;年龄15岁~63岁,平均(35.0±17.6)岁。两组患者的性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经过医院医学伦理委员会批准。
参照Wilkinson等及中华医学会结核病学会的结核病诊断标准[4,6,9-10]。纳入标准:①确诊为结核性脑膜炎的患者;②抗结核治疗前进行腰椎穿刺检查者;③使用INH抗结核治疗>2周者。排除标准:①其他颅内感染者;②伴有其他疾病者;③未使用INH抗结核治疗或使用INH治疗<2周,未进行CSF复查者。
1.2方法
两组结核性脑膜炎患者均给予口服利福平(天圣制药集团股份有限公司)450 mg/d,乙胺丁醇(沈阳红旗制药有限公司)750 mg/d,吡嗪酰胺(江苏四环生物股份有限公司)1500 mg/d正规联合抗结核治疗,分别给予900、600 mg剂量的INH(天津金耀药业有限公司)进行治疗,两组患者既往均未使用INH抗结核治疗。
所有患者均在使用本组INH剂量前及使用2~3周后,当日清晨用药后2 h左右分别收集CSF标本2.0 ml,-80 ℃冷冻保存待测。
1.2.1仪器及试剂 高效液相色谱仪为Waters e2695-2489紫外检测器,香草醛对照品(产品编号:100491-200901),INH标准品(中国药品生物制品检定所,产品编号:100578-200401),磷酸二氫钾、三氯醋酸、甲醇、三乙胺均为国产分析纯。INH标准溶液(500 mg/L的标准INH甲醇溶液)、三氯醋酸溶液(10%三氯醋酸水溶液)、香草醛溶液(1.6%香草醛甲醇溶液)均为自行配制。
1.2.2样品预处理及测定 抽取CSF标本0.25 ml置于1 ml的离心管中,加1.6%香草醛溶液40 μl,10%三氯醋酸50 μl,加甲醇至总体积为0.5 ml,放置40℃水浴箱反应20 min,冷却然后高速离心10 min(12 000 r/min),吸取上清液20 μl进样,外标法定量。采用标准高效液相色谱法测定CSF中INH浓度。
1.3观察指标及评价标准
CSF压力及CSF中蛋白质水平能够很好反映患者CSF循环受阻的严重程度及脑膜炎症的严重程度,与患者的临床症状严重程度及预后有密切关系,且CSF中INH浓度对临床疗效有重要意义,其都是重要的观察指标,故本研究观察两组患者治疗前后的CSF压力、蛋白含量变化情况,并比较两组CSF中INH浓度以及两组患者的不良反应情况。
疗效评价标准,有效:临床症状部分有效,局灶神经系统定位体征减轻,头痛、呕吐缓解,体温渐恢复,CSF检查各项指标有所好转;无效:临床症状无好转,病情进行性恶化,局灶神经系统定位体征仍然存在或加重,CSF各项指标无改善或加重[10]。
1.4统计学方法
采用SPSS 19.0统计学软件对数据进行分析,符合正态分布的计量资料以均数±标准差(x±s)表示,采用t检验,不符合正态分布的计量资料转化为正态分布,再行统计学分析;计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1两组患者CSF中INH浓度的比较
900 mg组患者CSF中的INH浓度为(3.24±2.04)μg/ml,600 mg组为(1.74±0.55)μg/ml。900 mg组患者CSF中的INH浓度高于600 mg组,差异有统计学意义(P<0.01)(图1)。
2.2两组患者治疗后临床疗效的比较
900 mg组患者的治疗有效率(75.0%)与600 mg组(68.4%)比较,差异无统计学意义(P>0.05)(表1)。
2.3两组患者治疗前后CSF压力及CSF蛋白的比较
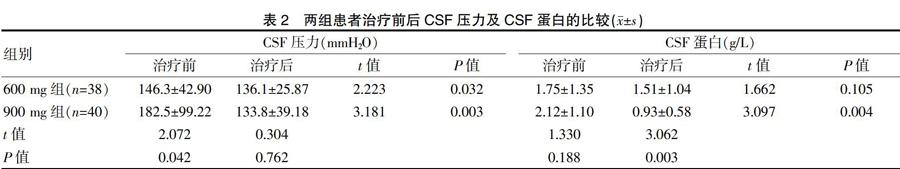
900 mg组患者治疗前的CSF压力高于600 mg组,差异有统计学意义(P<0.05);两组患者治疗前的CSF蛋白水平比较,差异无统计学意义(P>0.05)。900 mg组患者治疗后的CSF压力及CSF蛋白低于治疗前,差异均有统计学意义(P<0.05);600 mg组患者治疗后的CSF压力低于治疗前,差异有统计学意义(P<0.05),但600 mg组患者治疗后的CSF蛋白与治疗前比较,差异无统计学意义(P>0.05)。900 mg组患者治疗后的CSF压力与600 mg组比较,差异无统计学意义(P>0.05);900 mg组患者治疗后的CSF蛋白低于600 mg组,差异有统计学意义(P<0.05)(表2)。
2.4两组患者治疗后不良反应发生率的比较
部分患者使用INH治疗后(不同剂量比较,且基本排除其他抗结核药物副反应),出现如胃肠道副反应、肝功能异常、周围神经炎、皮疹等不良反应,随着INH治疗剂量的增加,不良反应发生率随之增加。900 mg组中28例患者发生不良反应,不良反应发生率为70.0%,600 mg组中14例发生不良反应,不良反应发生率36.8%。900 mg组患者的不良反应发生率高于600 mg组,差异有统计学意义(P<0.05)。
3讨论
结核性脑膜炎是最严重的肺外结核病,多源于血行播散[11]。人体血脑屏障在保证大脑功能的正常运行方面起至关重要的作用,其能阻止约95%的药物透过血脑屏障进入脑组织,避免药物对脑组织的损害,从而导致抗结核药物对结核性脑膜炎的疗效降低,是治疗神经系统结核的瓶颈之一,而对结核性脑膜炎的疗效最终由进入CSF的药物浓度决定[12]。抗结核药物治疗结核性脑膜炎的治疗目标就是早期杀菌、最终灭菌,尽可能减少和避免耐药结核发生,因此临床选药时应尽可能选择具有良好血脑屏障通透性,同时要兼顾有杀菌作用,且在CSF中有效的抗结核药物浓度、副作用相对较小的抗结核药物[13]。
INH作为抗结核药物的首选药物,早期杀菌作用最强,且易透过血脑屏障。但对不同剂量INH在人体CSF中的药代动力学研究报道较少,且大剂量INH与其相应的疗效及副作用尚少见报道。既往的国内外研究提示,血液中INH的藥物浓度在用药后0.25~3 h达峰值,CSF中INH浓度在静脉用药后2~3的h达高峰[14]。本研究中,CSF标本均在达到INH药物血药浓度稳态时收集,检测患者CSF中的INH药物浓度,结果显示采用不同剂量INH治疗的患者CSF中INH浓度存在差别,且这种差别与患者的临床疗效和药物不良反应有一定的关系。基于其他结核病(如肺结核)的成熟治疗方案,逐渐演化到目前结核性脑膜炎的治疗方案,但对于结核脑膜炎INH的有效剂量在学术界有一定争议。有专家认为我国约80%的正常人群为INH快代谢型,CSF及血液异烟肼药物浓度仅为慢代谢型的20%~50%,且由于耐药结核发病率越来越高,因此有学者建议成年结核性脑膜炎患者INH的治疗剂量可适当高于治疗其他部位结核的剂量,尤其是避免耐药结核的发生方面,INH剂量可增加至600~900 mg/d[8,15]。本研究结果显示,给予INH 900 mg治疗的患者CSF中INH的浓度明显高于600 mg组,差异有统计学意义(P<0.05);600 mg组患者治疗后的CSF压力低于治疗前,差异有统计学意义(P<0.05),而900 mg组患者治疗后的CSF压力及CSF蛋白均较600 mg组好转更为明显,差异有统计学意义(P<0.05)。提示增加INH剂量可提高患者CSF中INH的药物浓度,更有利于异常CSF压力及蛋白等生化指标的恢复。
尽管两组患者CSF中的INH浓度有明显差异,但两组患者的治疗有效率比较,差异无统计学意义(P>0.05),其原因可能与入组患者临床病情的严重程度有关,本研究中900 mg组患者的病情更重,神经系统损害及CSF异常更明显,临床上可根据患者病情严重程度的不同给予不同治疗剂量的INH。但本研究结果尚不能排除与纳入本研究的患者样本数量有限及临床疗效随访时间较短有关。
INH所导致的不良反应可能包括消化系统、神经系统等多个系统,其中以肝功能损害和周围神经系统损害在临床上最为常见。本临床研究资料显示,INH的不良反应与INH有剂量依赖关系,随剂量的增加不良反应发生率亦升高,900 mg组患者的不良反应发生率高于600 mg组,差异有统计学意义(P<0.05),提示在临床治疗过程中不仅要观察药物疗效,也需要密切观察由于INH剂量增加所带来的副反应风险;出现如此明显的差异也可能与样本量有限和个体差异有关。根据我科既往长期的临床经验及本研究结果,认为在密切观察药物不良反应的前提下,根据患者病情严重程度给予个体化治疗,部分重症患者急性期可给予高剂量短疗程的INH治疗,继以常规剂量的INH治疗,以期早期及时有效地控制患者的临床症状,减少并发症发生,改善患者远期预后。
在结核性脑膜炎的研究工作中,尚无成熟的动物模型可供研究之用。而本研究的不足在于患者的病情严重程度不同可能导致了不同的疗效,但是针对临床患者必须做到以患者为本。在之后的研究中期望设计更加严谨的临床试验进一步探索治疗结核性脑膜炎的最佳INH浓度。
[参考文献]
[1]Modi M,Goyal MK,Jain A,et al.Tuberculous meningitis:challenges in diagnosis and management:lessons learnt from Prof.Dastur′s article published in 1970[J].Neurol India,2018,66(6):1550-1571.
[2]Mezochow A,Thakur K,Vinnard C.Tuberculous meningitis in children and adults:new insights for an ancient Foe[J].Curr Neurol Neurosci Rep, 2017,17(11):85.
[3]Miftode EG,Dorneanu OS,Leca DA,et al.Tuberculous meningitis in children and adults:a 10-year retrospective comparative analysis[J].PLoS One,2015,10(7):e0133477.
[4]Wilkinson RJ,Rohlwink U,Misra UK,et al.Tuberculous meningitis[J].Nat Rew Neurol,2017,10:581-598.
[5]Thuong N ,Heemskerk D,Tram T,et al.Leukotriene A4 hydrolase genotype and HIV infection influence intracerebral inflammation and survival from tuberculous meningitis[J].J Infect Dis,2017,215(7):1020-1028.
[6]Ismail NA,Mvusi L,Nanoo A,et al.Prevalence of drug-resistant tuberculosis and imputed burden in South Africa:a national and sub-national cross-sectional survey[J].Lancet Infect Dis,2018,18(7):779-787.
[7]何蘭英,王健,董为伟.结核性脑膜炎的诊治进展[J].华西医学,2016,31(2):1-5.
[8]贾建平,陈生弟.神经病学[M].7版.北京:人民卫生出版社,2013.
[9]Mai NT,Thwaites GE.Recent advances in the diagnosis and management of tuberculous meningitis[J].Curr Opin Infect Dis,2017,30(1):123-128.
[10]中华医学会.临床诊疗指南(结核病分册)(2015年修订)[M].北京:人民卫生出版社,2004.
[11]Soria J,Metcalf T,Mori N,et al.Mortality in hospitalized patients with tuberculous meningitis[J].BMC Infect Dis,2019,19(1):9.
[12]Boeree MJ,Heinrich N,Aarnoutse R,et al.High-dose rifampicin,moxifloxacin,and SQ109 for treating tuberculosis:a multi-arm,multi-stage randomised controlled trial[J].Lancet Infect Dis,2017,17(1):39-49.
[13]Zhang J,Hu X,Hu X,et al.Clinical features,outcomes and molecular profiles of drug resistance in tuberculoses meningitis in non-HIV patients[J].Sci Rep,2016,6(1):19072.
[14]Mahale RR,Mehta A,Uchil S.Estimation of cerebrospinal fluid cortisol level in tuberculous meningitis[J].J Neurosci Rural Pract,2016,6(4):541-544.
[15]Thwaites GE,van Toorn R,Schoeman J.Tuberculous menin-gitis:more questions,still too few answers[J].Lancet Neurol,2013,12(10): 999-1010.
(收稿日期:2019-03-11 本文编辑:闫 佩)

