骨桥蛋白在儿童中枢神经系统白血病中的表达及髓外浸润机制的研究
王春静 方希敏 陈森敏 刘仕林
[摘要]目的 探讨骨桥蛋白(OPN)在儿童中枢神经系统白血病(CNSL)中的表达以及髓外浸润的机制。方法 选取2016年1月~2018年1月我院收治的10例CNSL患儿、20例非CNSL急性白血病患兒以及20例非肿瘤疾病患儿,分别标记为观察组、对照组及常规组。通过ELISA检测三组患儿治疗前以及观察组与对照组患儿完全缓解后血清中的OPN含量,并通过RT-PCR检测三组患儿治疗前以及观察组与对照组患儿完全缓解后的骨髓OPN表达情况。将培养的白血病Jurkat细胞分为空转组与转染组,其中空转组不做任何处理,转染组将合成OPN特异性的siRNA转染到Jurkat细胞中。对比分析培养的白血病Jurkat细胞空转组与转染组的OPN表达情况、细胞存活率以及细胞侵袭力。结果 治疗前,观察组患儿的血清OPN含量及骨髓OPN表达均高于对照组与常规组,差异有统计学意义(P<0.05);对照组患儿的血清OPN含量及骨髓OPN表达均高于常规组,差异有统计学意义(P<0.05)。完全缓解后,观察组与对照组患儿的血清OPN含量及骨髓OPN表达均低于治疗前,差异有统计学意义(P<0.05);完全缓解后,观察组患儿的血清OPN含量及骨髓OPN表达高于对照组,差异有统计学意义(P<0.05)。转染组白血病Jurkat细胞的OPN表达、细胞存活率以及下层浸润细胞数与总细胞数比率均低于空转组,差异有统计学意义(P<0.05)。结论 OPN在儿童CNSL患儿的表达中高于非CNSL急性白血病及其他肿瘤疾病患儿,并且其在白血病细胞浸润中枢神经系统中起着一定的作用。
[关键词]中枢神经系统白血病;骨桥蛋白;急性白血病;ELISA检测
[中图分类号] R543.5 [文献标识码] A [文章编号] 1674-4721(2019)11(a)-0008-05
Study of osteopontin expression in childhood central nervous system leukemia and its mechanism of extramedullary infiltration
WANG Chun-jing FANG Xi-min CHEN Sen-min LIU Shi-lin
Department of Hematology and Oncology, Shenzhen Children′s Hospital, Guangdong Province, Shenzhen 510038, China
[Abstract] Objective To investigate the expression of osteopontin (OPN) in children′s central nervous system leukemia (CNSL) and the mechanism of extramedullary infiltration. Methods From January 2016 to January 2018, 10 children with CNSL, 20 children with non-CNSL acute leukemia and 20 children with non-neoplastic diseases treated in our hospital were selected and labeled as observation group, control group and routine group respectively. The levels of OPN in serum of children in three groups before treatment and after complete remission in observation group and control group were detected by ELISA. The expression of OPN in bone marrow of children in three groups before treatment and after complete remission in observation group and control group was detected by RT-PCR. Cultured Jurkat cells were divided into blank group and transfection group, in which the blank group did not do any treatment, and the transfection group transfected the synthetic OPN-specific siRNA into Jurkat cells. The expression of OPN, cell viability and invasiveness of cultured Jurkat cells were compared between the blank group and the transfected group. Results Before treatment, the serum OPN content and bone marrow OPN expression in the observation group were higher than those in the control group and the routine group, and the differences were statistically significant (P<0.05). The level of serum OPN and the expression of bone marrow OPN in the control group were higher than those in the routine group, and the differences were statistically significant (P<0.05). After complete remission, the serum OPN content and bone marrow OPN expression in the observation group and the control group were lower than those before treatment, and the differences were statistically significant (P<0.05). After complete remission, the serum OPN content and bone marrow OPN expression in the observation group were higher than those in the control group, with statistical significance (P<0.05). The expression of OPN, cell viability and ratio of infiltrating cells to total cells in the lower layer in the transfected group were lower than those in the blank group, with statistical significance (P<0.05). Conclusion The expression of OPN in children with CNSL is higher than that in non-CNSL children with acute leukemia and other cancer diseases, and it plays a certain role in leukemia cell infiltration into the central nervous system.
[Key words] Central nervous system leukemia; Osteopontin; Acute leukemia; ELISA detection
在儿童白血病中,急性淋巴细胞白血病合并中枢神经系统白血病(central nervous system leukemia,CNSL)的发生率低,但复发率高达14.5%,严重威胁患儿的身心健康甚至生命安全[1]。临床治疗上,白血病的髓外浸润是治疗白血病的难点,同时也是白血病复发的重要因素[2]。Lazarus等[3]的研究显示,中枢神经系统白血病患者5年生存率低于非中枢神经系统浸润的白血病患者。因此,研究儿童白血病在体内的浸润过程机制以及如何防治CNSL是目前医护人员以及医学界面临的严峻考验。有诸多研究表明[4-6]骨桥蛋白(osteopontin,OPN)在乳腺癌、胃癌、淋巴癌等多类恶性肿瘤细胞中均存在相当程度的异常表达情况,具有“肿瘤转移基因”一说。也有研究[7]指出,OPN在急性髓性白血病中是潜在的预后和治疗的靶点所在,同时CNSL的发生发展与OPN的受体CD44高表达存在着明显的相关性。OPN属于一种分泌性磷酸化糖蛋白,具有多种生物学活性,在介导细胞黏附、参与免疫应答、抑制细胞凋亡等过程中均有重要地位。本研究通过检测OPN在儿童CNSL中的含量以及表达情况、检测下调OPN表达后白血病细胞株Jurkat细胞存活率和浸润力变化,为OPN在白血病髓外浸润机制提供客观参考依据,为后续CNSL的防治提供一个有效的靶点,现报道如下。
1资料与方法
1.1一般资料
选取2016年1月~2018年1月我院收治的10例中枢神经系统白血病(CNSL)患儿作为观察组,20例非CNSL急性白血病患儿作为对照组,20例非肿瘤疾病患儿作为常规组。
观察组中,男6例,女4例;年龄32~84个月,平均(49.4±7.4)个月;CNSL分型:急性淋巴细胞白血病7例,急性髓细胞白血病3例。纳入标准:①患白血病且合并脑脊液中白细胞计数>5×106/L;②MRI检测结果提示大脑块状病变或脑脊膜被浸润;③首次确诊为CNSL且未进行放疗或化疗等治疗。
对照组中,男12例,女8例;年龄28~79个月,平均(50.6±7.1)个月。纳入标准:①确诊为急性白血病,同时排除CNSL以及睾丸白血病等髓外入侵;②细胞形态学符合FAB分型;③符合免疫学分型;④患儿初次确诊为急性白血病且尚未进行治疗。
常规组中,男15例,女5例;年龄34~83个月,平均(48.7±8.2)个月。纳入标准:①非白血病以及非其他肿瘤疾病患儿;②进行脊髓临床检查,如免疫性血小板减少症骨髓涂片一般检查、骨髓培养等。
三组均排除临床资料不完整的患儿。三组患儿的性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。三组患儿家属对本研究均知情且签署自愿参与同意书,本研究已经我院医学伦理委员会审核批准。
1.2方法
观察组与对照组患儿急性淋巴细胞白血病以华南地区儿童急性淋巴细胞白血病治疗协作组2016年的方案为标准,并于化疗的第33天进行复查;髓系白血病以华南协作组方案化疗后28~35 d为复查时间点。
1.2.1 ELISA检测血清中OPN含量 采集观察组、对照组及常规组治疗前的静脉血液各2 ml,并采集观察组及对照组患儿经过治疗完全缓解后的静脉血液各2 ml。经离心处理后存于冰箱中,温度设置-80℃。解冻后采用人OPN ELISA试剂盒,按照试剂盒说明书操作步骤配合丹麦丹尼酶标仪(MK-3)进行处理分析。
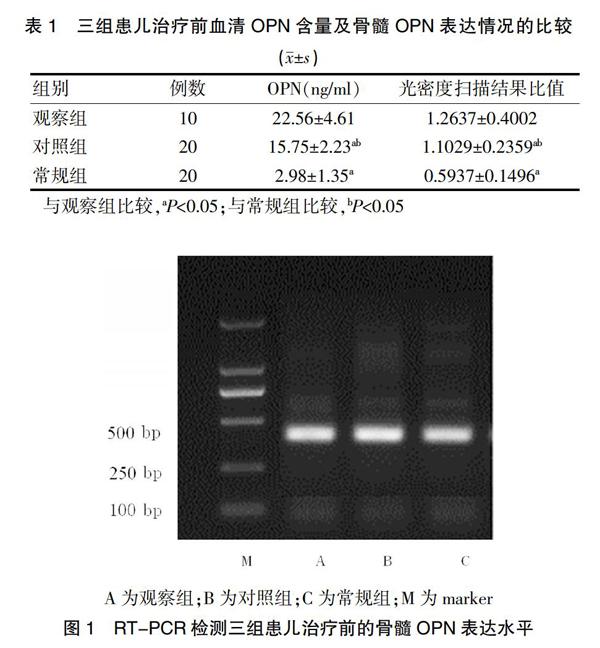
1.2.2 RT-PCR检测骨髓OPN表达 采集观察组、对照组及常规组骨髓各2 ml,并采集观察组及对照组患儿完全缓解后的骨髓各2 ml,均储存于-196℃液氮条件下,解冻后以淋巴細胞分离液分离出单个核细胞,在TRIzol试剂盒的使用下分别提取各自RNA,后以基因库中人OPN完全mRNA系列为基准设计其引物。使用PE9600 PCR仪合成OPN基因,后经变性、退火、延伸步骤并反复循环获得产物进行琼脂糖凝胶电泳测定,并与紫外线下行光密度扫描后拍照。
1.2.3培养白血病Jurkat细胞并转染 采用含10%胎牛血清的RPMI-1640细胞培养液培养白血病Jurkat细胞,培养条件:饱和湿度、37℃、5% CO2培养箱。3 d后换液,以1∶3的比例进行传代。将培养的白血病Jurkat细胞分为空转组与转染组,其中空转组不做转染处理,转染组将合成OPN特异性的siRNA通过pLKO-Tet-On质粒载体转染到Jurkat细胞中(siRNA正义链序列5′-TAAGGACAGTTATGAAACGAGTTTC AAGAGAACTCGTTTCATAACTGTCCTTTTTTTTC-3′)。在白血病Jurkat细胞培养阶段至对数生长期后,将细胞悬浮液调整至2×107/L,后接种至96孔细胞培养板中,每孔加入100 μl细胞悬浮液。在适当条件下进行细胞转染。
1.2.4 Western-Blot检测白血病Jurkat细胞OPN表达 将白血病Jurkat细胞空白组与转染组培养2 d后,以PBS洗涤,在1000 r/min的条件下离心5 min,吸除培养液上清,加入蛋白裂解液进行充分裂解,吸取蛋白上清,以BCA蛋白浓度检测试剂盒按照说明书步骤进行定量检测。
1.2.5 MTT检测Jurkat细胞存活率 将白血病Jurkat细胞空转组与转染组培养2 d后,每孔加入MTT溶液20 μl,在37℃、5% CO2条件下孵育4 h后在1000 r/min的条件下进行离心5 min,再在细胞沉淀中加入200 μl二甲基亚砜溶液,在37℃下震荡10 min后进行比色(490 nm)。
1.2.6 Matrigel检测白血病Jurkat细胞侵袭力 将Matrigel稀释至5 ng/ml,取80 μl至于孔径为8 μm的millicell底面,在37℃条件下24 h成胶后置于24孔培养板中,millicell槽中分别加入2×105/ml的白血病Jurkat细胞,在37℃、5% CO2条件下培养24 h。之后以棉签擦拭掉底面未穿膜的细胞后以甲醇固定,进行Gimsa染色处理,在400倍光镜下技术膜背面细胞数,取6个视野穿过膜到达外表面的细胞平均数,并将下层也混匀后计细胞数。
1.3观察指标
①观察三组患儿治疗前血清中的OPN含量及骨髓OPN表达情况,其中骨髓OPN表达情况通过光密度扫描结果比值进行判定。②比较观察组及对照组患儿完全缓解前后OPN含量及骨髓OPN的表达情况。③分析培养的白血病Jurkat细胞空转组与转染组的OPN表达情况、细胞存活率以及细胞侵袭力,细胞侵袭力通过下层浸润细胞数与总细胞数比率进行判定。
1.4统计学方法
采用SPSS 19.0统计学软件对数据进行分析,计量资料以均数±标准差(x±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1三组患儿治疗前血清OPN含量及骨髓OPN表达情况的比较
治疗前,观察组患儿的血清OPN含量高于对照组与常规组,差异有统计学意义(P<0.05);对照组患儿治疗前的血清OPN含量高于常规组,差异有统计学意义(P<0.05)。光密度扫描结果比值显示,观察组患儿的骨髓OPN表达高于对照组及常规组,差异有统计学意义(P<0.05);对照组患儿的骨髓OPN表达高于常规组,差异有统计学意义(P<0.05)(表1、图1)
2.2观察组与对照组患儿治疗前及完全缓解后血清OPN含量及骨髓OPN表达情况的比较
观察组治疗完全缓解的有7例,对照组治疗完全缓解的有19例。治疗前,观察组患儿的血清OPN含量高于对照组,差异有统计学意义(P<0.05);两组患儿治疗完全缓解后的血清OPN含量均低于治疗前,差异有统计学意义(P<0.05);观察组完全缓解后的血清OPN含量高于对照组,差异有统计学意义(P<0.05)。光密度扫描结果比值显示,观察组患儿治疗前的骨髓OPN表达高于对照组,差异有统计学意义(P<0.05);两组患儿完全缓解后的骨髓OPN表达低于治疗前,差异有统计学意义(P<0.05);观察组患儿完全缓解后的骨髓OPN表达高于对照组,差异有统计学意义(P<0.05)(表2、图2)。
2.3 Jurkat细胞空转组与转染组OPN表达、细胞存活率以及下层浸润细胞数与总细胞数比率的比较
转染组白血病Jurkat细胞的OPN表达、细胞存活率以及下层浸润细胞数与总细胞数比率均低于空转组,差异有统计学意义(P<0.05)(表3、图3)。
3讨论
中枢神经系统白血病是指脑膜、脑神经以及脑组织被白血病细胞浸润,若得不到及时诊断发现与有效治疗可严重危害患者的生命安全。白血病中枢神经系统浸润是一个复杂的过程,包含白血病细胞的黏附、细胞突破基底膜等[8],而OPN在该一系列过程中扮演者重要的角色[9]。OPN通过识别RGD序列和非RGD序列与细胞膜上的整合素受体相结合,从而促进细胞与细胞、细胞与基质之间的黏附[10]。此外,OPN可与αvβ3作用,通过激活核因子κB途径,抑制细胞凋亡。Lee等[11]的研究显示,将OPN导入胃癌AZ521细胞,而后通过激活Src途径作用于CD44V,从而抑制UV有道细胞凋亡。Powell等[12]的研究显示,敲除掉OPN后能促进白血病细胞死亡,提示在急性髓性白血病中OPN是一个潜在的预后和治疗的靶点。
本研究结果显示,儿童CNSL患儿血清OPN的含量以及骨髓OPN的表达远远高于非CNSL白血病以及非白血病及其他肿瘤疾病患儿,差异有统计学意义(P<0.05),提示OPN在白血病细胞浸润至中枢神经系统起着一定的作用。而通过对白血病Jurkat细胞转染合成OPN特异性的siRNA,可以显著降低其OPN的表达、细胞存活率以及细胞浸润力(P<0.05),该研究结果肯定并支撑着以上结论。同样,Liersch等[13]检测到OPN在AML患者中的表达明显高于正常对照组,且OPN高表达是AML预后不良的一个独立危险因素,并发现复发的AML患者其OPN表达明显升高。这与本文研究结果相一致。此外国内有研究显示,OPN受体CD44高表达与CNSL发生有着明显的关系,同时也指出 OPN和血管内皮生长因子(VEGF)与急性白血病的发生、发展密切相关[14-15]。
综上所述,OPN在儿童CNSL的表达较急性白血病(非CNSL)和非肿瘤疾病患者中要高,通过下调OPN在白血病Jurkat细胞中的表达能够有效降低白血病细胞的存活率与侵袭力,提示OPN在白血病细胞浸润中枢神经系統起着一定程度的作用,本研究结果可作为OPN成为中枢神经系统白血病防治的有效靶点提供参考。
[参考文献]
[1]陈玉梅,杨小羊,孙洪波,等.497例儿童少年急性白血病髓外浸润特点[J].中国小儿血液,2004,9(6):244-249.
[2]赵靖,王荣福.18F-FDG PET/CT在急性白血病诊治中的临床应用进展[J].肿瘤学杂志,2017,23(6):464-469.
[3]Lazarus HM,Richards SM,Chopra R,et al.Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis:results from the international ALL trial MRC UKALL XII/ECOG E2993[J].Blood,2006,108(2):465-472.
[4]王傲立,宋关斌,罗庆.骨桥蛋白对肿瘤细胞恶性行为影响的研究进展[J].华西医学,2017,(12):1963-1966.
[5]胡雪,马静静,董卫国.骨桥蛋白在幽门螺杆菌感染相关性胃癌中的研究进展[J].实用医学杂志,2017,33(6):851-853.
[6]吴寒,李镇利,邢昊,等.骨桥蛋白在肝细胞癌诊治中的作用[J].临床肝胆病杂志,2018,34(9):191-195.
[7]佘笑梅,孙莹,邱立丹,等.急性B淋巴细胞白血病MMP-2和MMP-9mRNA表达状况分析[J].国际医药卫生导报,2018,24(16):2481-2483.
[8]张林,张乐萍,陆爱东.急性T淋巴细胞白血病患儿中枢神经系统白血病的防治[J].中华临床医师杂志(电子版),2017,11(10):1838-1841.
[9]杨小娜,林鹏,郭建美,等.生脉饮联合化疗治疗急性白血病疗效观察[J].现代中西医结合杂志,2017,26(6):621-623.
[10]Lee H,Jin Y C,Kim S W,et al.Proangiogenic functions of an RGD-SLAY-containing osteopontin icosamer peptide in HUVECs and in the postischemic brain[J].Exp Mol Med,2018,50(1):e430.
[11]Lee JL,Wang MJ,Sudhir PR,et al.Osteopontin promotes integrin activation through outside-in and inside-out mechanisms:OPN-CD44V interaction enhances survival in gastrointestinal cancer cells[J].Cancer Res,2007,67(5):2089-2097.
[12]Powell JA,Thomas D,Barry EF,et al.Expression profiling of a hemopoietic cell survival transcriptome implicates osteopontin as a functional prognostic factor in AML[J].Blood,2009,114(23):4859-4870.
[13]Liersch R,Gerss J,Schliemann C,et al.Osteopontin is a prognostic factor for survival of acute myeloid leukemia patients[J].Blood,2012,119(22):5215-5220.
[14]趙嘉睿,邓卓越,穆莉莉.骨桥蛋白的生物学功能及研究现状[J].国际免疫学杂志,2018,41(4):448-451.
[15]陈丽惠.VEGF在白血病患者血清中的表达及意义[J].临床医药文献电子杂志,2018,5(70):75.
(收稿日期:2019-05-16 本文编辑:闫 佩)

