TGF-β1在卵巢浆液性腺癌中的表达及其临床意义
屈晓辉,邓颖辉
(江西省妇幼保健院病理科,南昌 330006)
卵巢癌为妇科常见恶性肿瘤之一,其死亡率位于妇科恶性肿瘤之首[1],随着年龄的增长,发病率明显增高,严重威胁妇女健康,卵巢癌的预后同临床分期紧密联系,由于各种因素影响,至今缺乏有效的诊断方法,发现的卵巢癌多数已经处于晚期[2],存活率仍较低,卵巢癌及早诊治能明显提高患者的生存率,因此早期诊断卵巢癌对于患者预后的改善得尤为重要。
转化生长因子 β(transforming growth factor β,TGF-β)是细胞生长抑制因子,可促进细胞外基质形成,促进新生血管形成[2],调节细胞增殖与分化,在肿瘤的发生发展中起重要作用。TGF-β1是一种分子质量为25KD的多肽,是TGF-β在人体内的主要存在形式。我们从病理学的角度,对TGF-β1进行检测分析,探讨TGF-β1在卵巢浆液性腺癌中的表达及其临床意义,为卵巢癌临床诊断及治疗提供重要参考价值。
1 材料与方法
1.1 临床资料 选择江西省妇幼保健院2010年至2018年间130例各级卵巢浆液性肿瘤手术标本蜡块(包含卵巢浆液性囊腺瘤40例、卵巢交界性浆液性囊腺瘤40例及卵巢浆液性腺癌50例),以同期卵巢浆液性囊腺瘤标本作为对照,所选病例手术前期未进行任何放化疗,相关临床病理资料完善,病理诊断均明确,排除其他组织学类型。
1.2 试剂 一抗TGF-β1、二抗试剂盒及DAB显色液均购自福建迈新生物有限公司。
1.3 方法
1.3.1 制作组织芯片 设计7×11点阵的芯片,共77个位点,其中7个点做空白定位(如图1、图2);根据设计将受体蜡块进行打孔,孔径大小与供体组织钻取孔径大小一致;对供体组织HE切片作形态学观察并在供体蜡块上准确标记所需要的靶点;利用打孔仪钻取靶点组织,每个病例同时钻取两块肿瘤组织,并分别转移至两个受体蜡块相应的孔位上,制成所需的阵列蜡块;将制成的阵列蜡块面朝下放入金属包埋盒中,灌蜡并轻压蜡块使组织芯排平,待冷却后放入65℃烤箱内维持45min;最后将蜡块从烤箱内拿出,待其冷却。
1.3.2 免疫组织化学 组织芯片4μm厚切片,采用免疫组化SP法,按产品说明书操作(图3)。
1.3.3 组织学分级 依据2014版WHO分类系统,将卵巢浆液性腺癌分为高级别浆液性腺癌和低级别浆液性腺癌两种。
1.3.4 评估标准 镜下观察TGF-β1的表达情况,计数细胞浆内有黄色或棕黄色颗粒状物的阳性染色细胞数,对TGF-β1蛋白表达进行分析,染色强度根据阳性细胞百分比进行半定量分级:阳性细胞率=0为 0级,<10%为 1级,10%~50%为 2级,50%~80%为3级,>80%为4级;结果判断:阳性细胞百分比<10%为阴性,10%~100%为阳性。

图1

图2

图3
1.4 统计学分析 采用SPSS 19.0统计软件进行分析处理,组间差异性比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1在各级卵巢浆液性肿瘤中的表达TGF-β1在卵巢各级浆液性肿瘤中均有表达,在卵巢浆液性腺癌组表达阳性率为86.0%,显著高于卵巢交界性浆液性囊腺瘤组(45.0%)和卵巢浆液性囊腺瘤组(17.5%),差异具有统计学意义(均 P<0.05);且卵巢交界性浆液性囊腺瘤组TGF-β1阳性率明显高于卵巢浆液性囊腺瘤组,差异具有统计学意义(P<0.05)(图 4 及表 1)。
2.2 TGF-β1的表达水平与卵巢浆液性腺癌临床病理参数之间的关系 卵巢浆液性腺癌中,Ⅱ+Ⅲ+Ⅳ期患者肿瘤TGF-β1的表达阳性率为93.2%,显著高于Ⅰ期患者TGF-β1的表达阳性率33.3%,差异具有统计学意义(P<0.05);伴有肿瘤种植/转移患者TGF-β1的表达阳性率为93.0%,显著高于不伴有肿瘤种植/转移患者TGF-β1的表达阳性率42.9%,差异具有统计学意义(P<0.05);不同年龄分布和不同组织学分级的患者TGF-β1的表达水平差异无统计学意义。(表2)
3 讨论
肿瘤是在多种因素共同作用下形成的,其发生发展是多种因素影响的复杂过程。卵巢癌以上皮性癌居多,其中卵巢浆液性腺癌是上皮性癌中最常见的病理类型。晚期卵巢癌的治疗原则是以手术为主的综合治疗,即术中尽可能切净肿瘤,为术后化疗打下基础,但对于位于一些重要脏器的转移灶和一些小转移灶,术中处理往往比较棘手。因此,为寻求有效的诊断和治疗方案,卵巢癌发生、发展及转移的机制一直是妇科肿瘤基础与临床研究探索的重点。

表1 TGF-β1在各级卵巢浆液性肿瘤中的表达
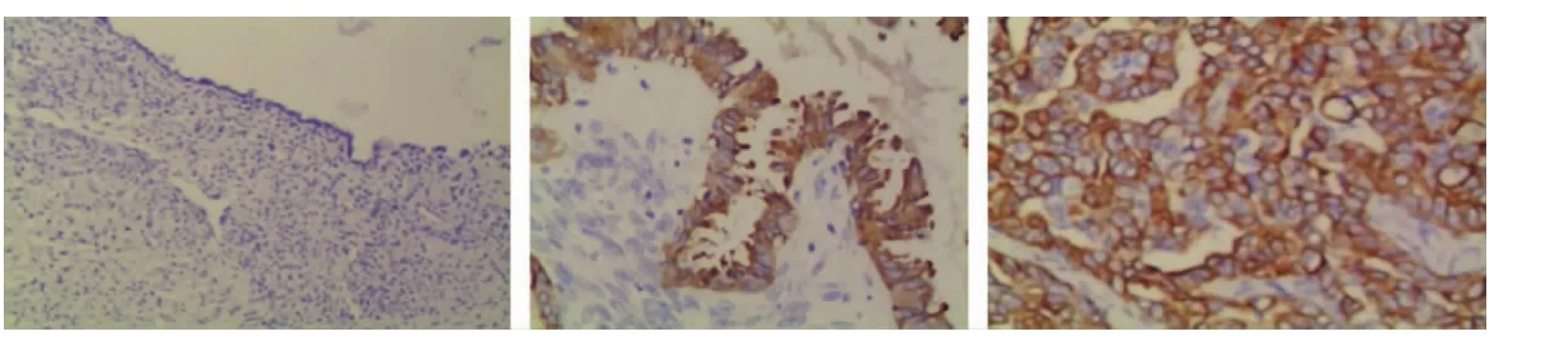
图4 TGF-β1在各级卵巢浆液性肿瘤中的表达,SP法:A.卵巢浆液性囊腺瘤;B.卵巢交界性浆液性囊腺瘤;C.卵巢浆液性腺癌
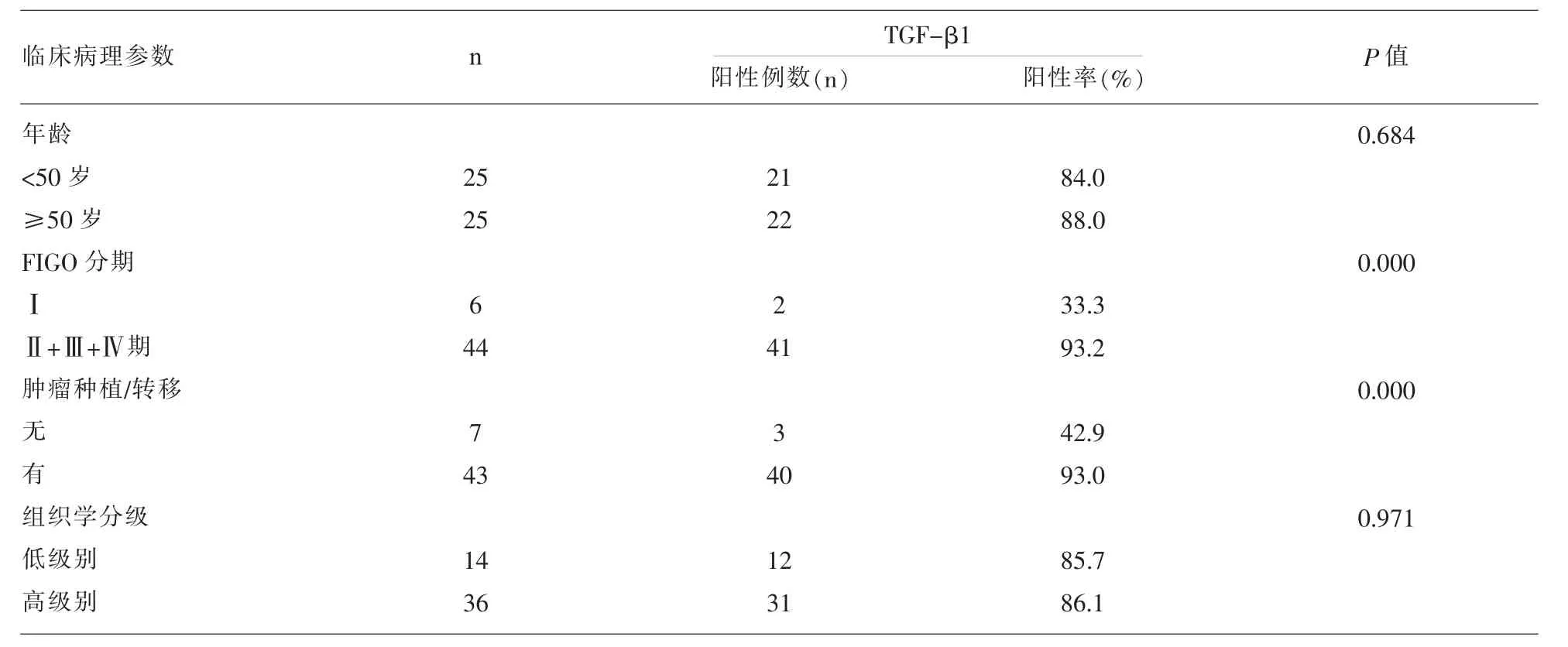
表2 卵巢浆液性腺癌中TGF-β1的表达与临床病理参数的关系
TGF-β(transforming growth factor beta,转化生长因子β)是一种多功能的多肽类细胞因子,哺乳动物组织中存在3种TGF-β亚型:TGF-β1、TGF-β2和TGF-β3,其中TGF-β1最为重要。几乎体内的所有细胞都能产生TGF-β并存在其受体,参与细胞的分化、增殖、转移、形态的改变以及凋亡等,在机体的免疫调节、细胞生长和分化、肿瘤免疫等发面均起到了重要的作用。人类TGF-β1基因定位于染色体19q3,含有7个外显子,其5ˊ端序列含有5个调控区:1个类增强子活性区,2个负调控区和2个启动子区。
通常TGF-β1对正常上皮细胞发挥生长抑制作用,在恶性肿瘤发展过程中,TGF-β1起着双向调节作用。在肿瘤发生早期,TGF-β1发挥负向调节因子作用抑制肿瘤形成。随着肿瘤的进展,TGF-β1可通过诱导肿瘤周围基质环境改变,促进新生血管生成,促进肿瘤细胞浸润与转移,抑制宿主免疫系统杀伤肿瘤细胞等方式发挥免疫耐受和免疫逃逸,加剧肿瘤生长与形成[8-12]。
本研究结果显示TGF-β1在卵巢浆液性囊腺瘤、卵巢交界性浆液性囊腺瘤及卵巢浆液性腺癌中均有表达,且在卵巢浆液性腺癌中呈高表达;与卵巢交界性浆液性囊腺瘤及卵巢浆液性囊腺瘤相比,TGF-β1在卵巢浆液性腺癌组织中的表达水平显著升高;与卵巢浆液性囊腺瘤相比,TGF-β1在卵巢交界性浆液性囊腺瘤组织中的表达水平亦显著升高,提示TGF-β1的过表达在卵巢癌的发生发展中起重要作用。
近年较多文献[3-5]报道TGF-β表达水平的测定对了解乳腺癌、胃癌、肝癌、肺癌等恶性肿瘤进展、判断淋巴结转移状况、术后监测转移或复发及评估预后等诸方面均有较重要意义[15,16]。
上皮间质转化(EMT)是恶性肿瘤转移的先决条件,目前TGF-β1被认为是诱导上皮间质转化的最重要的生长因子。
在本研究中,我们进一步对卵巢浆液性腺癌患者TGF-β1表达水平与卵巢癌的FIGO分期和癌组织的种植/转移的关系进行了分析。结果显示Ⅱ-Ⅳ期卵巢癌患者肿瘤组织中TGF-β1表达水平均高于I期,且卵巢癌组织中TGF-β1的表达水平与肿瘤的种植/转移密切相关,差异有统计学意义;而卵巢癌组织中TGF-β1的表达水平与病人的年龄分布及肿瘤组织学分级无关,提示TGF-β1的显著增加发生在卵巢癌晚期,可能是晚期卵巢癌增加的TGF-β1可诱导肿瘤血管生成,从而促进卵巢癌的发展。
TGF-β1表达水平与肿瘤不同临床分期、肿瘤是否种植/转移相关,表明TGF-β1表达指数对临床分期有一定价值,临床上结合TGF-β1水平的检测,一定程度上可以对卵巢肿瘤的生物学行为进行评估,并判定其危害性,评估肿瘤的预后情况,反映肿瘤细胞目前的活性状态。
此外,在一些实体恶性肿瘤研究[6,7]中发现TGF-β的表达有助于诱导肿瘤细胞发展和耐药性的产生。
综上所述,卵巢癌患者呈现免疫耐受状态,TGF-β1表达水平与卵巢癌的发生、发展及种植/转移密切相关,TGF-β1水平可为卵巢癌的临床诊断、病情监提供重要的参考价值,检测TGF-β表达水平对指导临床治疗可能有重要临床应用价值,并有可能成为卵巢癌控制转移的靶点。

