金针菇中麦角硫因的分离纯化工艺优化
莫宇丽 张怡馨 王 艳 胡晶晶 李亚欢 王 杰
(华南农业大学食品学院,广东广州510642)
麦角硫因学名为2-巯基-L-组氨酸三甲基内盐,是一种新型的天然强抗氧化剂,在食品添加剂、保健品、化妆品等领域具有巨大的应用潜力[1-4]。金针菇等常见食用菌中麦角硫因的含量高且具有天然安全性,是制备麦角硫因的良好资源[5-6]。保健品、化妆品等产品对麦角硫因的纯度有较高的要求,而采用浸提法等提取的麦角硫因中含有较多的杂质,影响其在产品中的应用效果[7]。因此,研究金针菇中麦角硫因的纯化工艺条件,可为食用菌麦角硫因的开发和利用提供理论依据。目前,国内外对麦角硫因的研究多集中于功能特性[8-11],而提取方面的报道也多为水或其他溶剂的简单浸提,纯化方面的研究有待于进一步开展[7,12-14]。
前期研究表明,溶剂浸提法所得到的食用菌麦角硫因提取液中含有较多蛋白和多糖类物质,而柱层析法可以有效去除蛋白、多糖类物质[15]。葡聚糖凝胶分离条件温和,样品回收率高,且设备简便、易于操作,易推广[16]。试验在比较三种葡聚糖凝胶和五种大孔吸附树脂对金针菇麦角硫因提取液的纯化效果基础上,采用正交试验优化Sephadex G-10的纯化条件,确定金针菇麦角硫因的纯化工艺条件。研究结果可为金针菇中麦角硫因的开发和利用提供理论依据。
1 材料与方法
1.1 材料与设备
金针菇,由广东蓝田农业有限公司提供;高效液相色谱仪(LC2130),真空冷冻干燥机(FD-1-50),高效液相色谱柱(AQ-C18),数显恒流泵(HL-2B),1.6 cm×40 cm层析柱,紫外可见分光光度计(UV-4802S)。
1.2 试验方法
1.2.1 样品预处理
取新鲜金针菇洗净、分装于冰箱中冷冻12 h,然后放于真空冷冻干燥机中干燥至恒重,最后粉碎成粉末,过筛,置于-20℃冰箱中备用。
用62%乙醇以料(g)液(mL)比1∶58与金针菇粉充分混合,在53℃条件下水浴浸提15 min,取出后于12 000×g离心10 min,收集上清液;使用旋转蒸发仪减压蒸馏,浓缩至原体积的1/5,收集浓缩液。向麦角硫因浓缩液中加入四倍体积的95%乙醇(缓慢加入,边加边搅拌),混合均匀后于4℃静置12 h;离心,取上清液再次减压蒸馏浓缩至最小体积,收集浓缩物并添加去离子水至上清液体积的1/5,即为醇沉后的浓缩液,用于后续纯化。
1.2.2 不同葡聚糖凝胶对金针菇麦角硫因提取液的纯化
取预处理过的葡聚糖凝胶Sephadex G-10、Sephadex G-25、Sephadex G-75,装柱,柱规格均为20 cm×1.6 cm;将醇沉后的浓缩液以2 mL的上样液和1 mL/min的洗脱速度进行上样和洗脱,用10 mL离心管收集洗脱液,3 mL/管,收集30管。测定每管的蛋白、多糖及麦角硫因含量,每管做三个平行。比较不同的葡聚糖凝胶对麦角硫因提取液的分离纯化效果。

图1 不同葡聚糖凝胶洗脱液中蛋白、多糖、麦角硫因的含量
1.2.3 不同大孔树脂对金针菇麦角硫因提取液的纯化
将预处理好的S-8、AB-8、D101、HP-20、NKA-9五种大孔树脂各2 g,置于蓝盖瓶中,分别加入10 mL样品液,置于25℃摇床中,转速150 r/min,振荡24 h。取上清液检测麦角硫因含量后将树脂、样品液混合物抽滤,并用一级水清洗抽滤后的树脂。分别加入20 mL 60%乙醇,于25℃摇床中,转速150 r/min解吸12 h,每隔1 h吸取1 mL解吸液,检测解吸液的蛋白、多糖、麦角硫因含量,比较不同的大孔树脂对麦角硫因提取液的纯化效果。
1.2.4 蛋白质、多糖、麦角硫因的测定方法
(1)蛋白质的测定:采用考马斯亮蓝法测定分离液中的蛋白质含量。
(2)多糖的测定:采用苯酚-硫酸法测定分离液中的多糖含量。
(3)麦角硫因的测定:采用高效液相色谱法检测麦角硫因的含量。检测条件:色谱柱(Luna 5µm C18(2)100A,Phenomenex)大小为250 mm×4.6 mm,流动相为水∶甲醇=98∶2,流速为1 mL/min,检测波长为254 nm,进样量为20µL。将麦角硫因分离液和标准品按上述条件测定。以麦角硫因浓度(mg/mL)为横坐标,峰面积(µAU*s)(星号代表乘号)为纵坐标,绘制麦角硫因标准曲线。
1.2.5 正交试验优化SephadexG10纯化麦角硫因的条件
在前期研究基础[15]上,选取凝胶层析柱高度、洗脱液流速和上样量三个影响葡聚糖凝胶分离效果的因素,以这三因素用SPSS软件设计三因素三水平正交试验(以麦角硫因回收率为检测指标),因素水平见表1。

表1 正交试验因素水平
对正交试验的结果进行极差和方差分析以确定纯化方法的最优条件。
2 结果与分析
2.1 不同葡聚糖凝胶对金针菇麦角硫因提取液的分离纯化
试验中欲分离的麦角硫因的分子量为229.3 Da,由于提取液中的其他杂质分子量不明确,同时为了能达到更好的分离效果,所以选取了分离范围较有代表性的Sephadex G-10、Sephadex G-25和Sephadex G-75分别对麦角硫因提取液进行分离纯化。由图1可见,在柱体积为20 cm×1.6 cm、上样量为2 mL和洗脱速度为1 mL/min的相同条件下,Sephadex G-75的分离效果是最差的,蛋白质、多糖和麦角硫因的出峰管几乎重叠,三种物质都集中在10-20管中被洗脱出来,对于麦角硫因起不到任何分离纯化作用;G-25和G-10对提取液中麦角硫因的分离效果相似,但经G-25洗脱的麦角硫因集中度不高,主要集中在10-16管,根据峰型可以看出G-25对多糖的纯化效果更好,并且多糖和麦角硫因的峰值出现点重合度更高;相比之下G-10对麦角硫因的分离效果更好一些,集中度高,在6-10管并且与多糖、蛋白的峰值重合度也没有G-25高。
2.2 不同大孔树脂对金针菇麦角硫因提取液的纯化
图2为五种大孔树脂S-8、AB-8、D-101、HP20和NKA-9处理提取液之后,用60%乙醇解吸12 h内解吸液中的蛋白、多糖、麦角硫因含量变化(还包括解吸24 h时麦角硫因的含量)。结果显示五种大孔树脂对麦角硫因的吸附率均不足60%,其中吸附率最高的是AB-8,达到58.86%。然而就解吸率而言,五种大孔树脂由于各自极性不同,解吸率最高的时间点也不同,大孔树脂D-101解吸液中蛋白质含量在第3 h突然增高,这有可能是由于提取液中的蛋白质含量较高,大孔树脂D-101吸附了较多的蛋白质,在解吸过程的第3个小时,大量的蛋白质从大孔树脂D-101中被解吸出来,从而导致其蛋白含量的突然增高。对于麦角硫因的含量,分别按照五种树脂解吸率最高的时间点来计算,其解吸率也都较低,最高的是S-8,也仅有5.42%,并且吸附率最高的AB-8的解吸率最低,仅有1.84%。影响大孔树脂吸附性能的因素有很多,不仅与大孔树脂自身的三维结构有关,还与被吸附物质的分子大小和极性有关[17-20]。虽然可以增加大孔树脂的用量来提高麦角硫因吸附,但解吸率过低,意味着需要消耗大量的解吸液,这又将涉及解吸液的浓缩,而对大量解吸液进行再浓缩是非常耗时的。因此,与葡聚糖凝胶分离从操作简易程度、耗时、耗能等方面相比均不具有优势,故采用葡聚糖凝胶G10对金针菇麦角硫因提取液进行分离纯化。
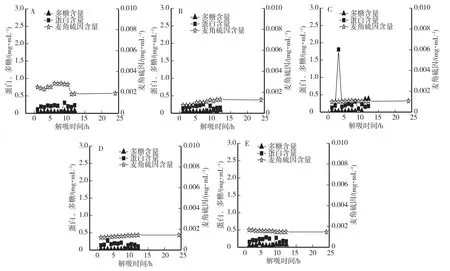
图2 不同大孔树脂解吸液中蛋白、多糖、麦角硫因的含量
2.3 正交试验优化SephadexG-10纯化麦角硫因的条件
根据表1通过SPSS.19设计正交试验进行纯化方法的优化,得到用Sephadex G-10层析柱纯化提取液中麦角硫因的正交试验及其结果见表2。
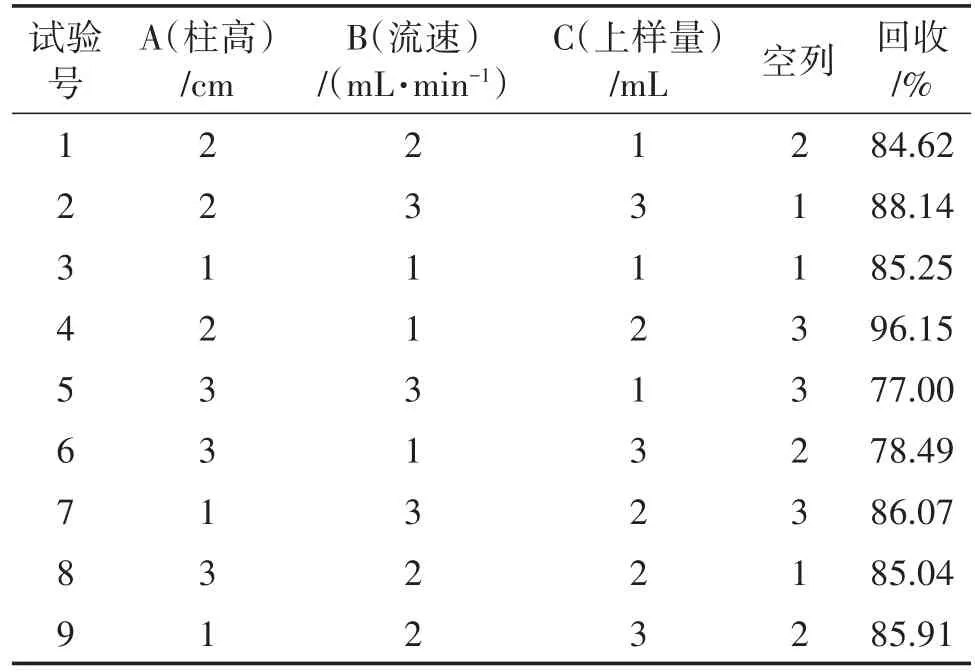
表2 葡聚糖凝胶G-10纯化金针菇提取物中麦角硫因的正交试验
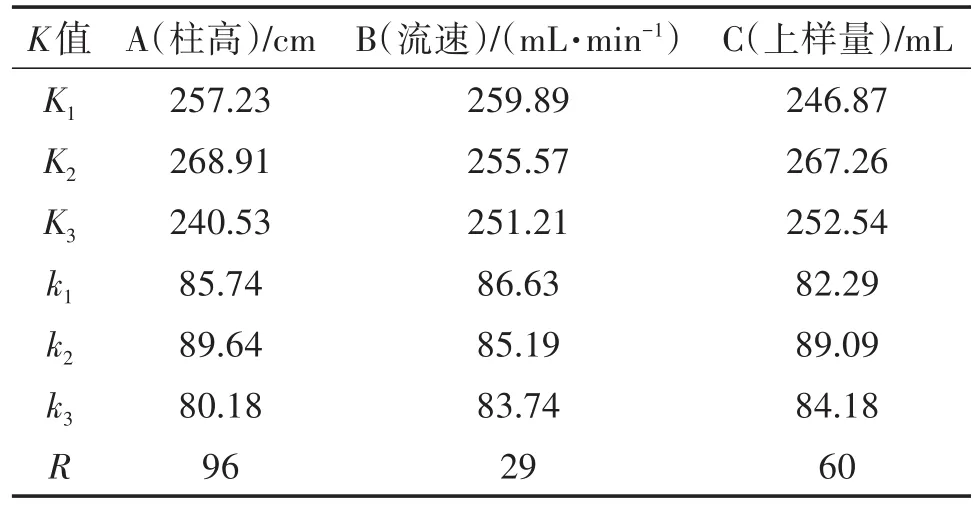
表3 以麦角硫因回收率为指标的极差分析
表2、3分别为Sephadex G-10层析柱纯化金针菇提取物中麦角硫因的正交试验设计表和以麦角硫因回收率为指标的极差分析表。根据表2、表3,由R值大小可以判断,柱高(A,cm)、流速(B,mL/min)和上样量(C,mL)这三个因素对Sephadex G-10分离纯化金针菇中麦角硫因回收率的影响力的主次顺序是A>C>B,即凝胶层析柱高>上样量>洗脱流速。利用K值得出最优分离条件为A2B1C2。因此通过试验可以确定所得样品液中麦角硫因回收率最高的分离条件为:凝胶层析柱高为20 cm,样品液上样量为2 mL,洗脱速度为0.5 mL/min。凝胶柱的柱高对分离后的回收率影响相对较大,理论上而言凝胶层析柱越长,分离效果越好;但当柱过高时,也容易导致实验时间长,样品稀释度增大,分离效果反而不好。
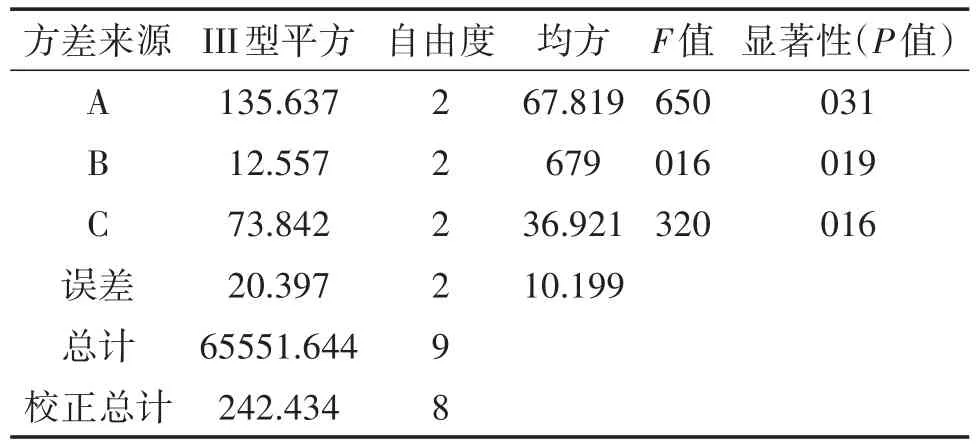
表4 以麦角硫因回收率为指标的方差分析表
表4是以麦角硫因回收率为指标的方差分析。由表4,F检验结果表明,三个因素对提取液麦角硫因回收率的影响均呈不显著。这可能是由于实验的误差较大,或者是三种因素间的交互作用对检验值的影响更大。故根据极差分析的结果直接使用回收率最高的条件作为纯化条件:凝胶层析柱高为20 cm,样品液上样量为2 mL,洗脱速度为0.5 mL/min;以此条件做三次重复试验,得到的回收率平均值为93.98%。收集纯化后的洗脱液,进行浓缩、冻干得到干物质,称重,再将干物质溶解、稀释,上样测定麦角硫因的浓度,最后得到其纯度(麦角硫因/干物质质量)平均值为54.83%,纯化后的麦角硫因最终产量为3.05 mg/g(干重)。
3 结论
所选的三种葡聚糖凝胶和五种大孔吸附树脂中,葡聚糖凝胶Sephadex G-10对提取液中麦角硫因的分离纯化效果最好,对其进行纯化条件优化,得出最优纯化条件为:凝胶层析柱柱高为20 cm,样品液上样量为2 mL,洗脱速度为0.5 mL/min。该方法对麦角硫因的回收率高,其回收率可达93.98%,且能够很大程度地减少纯化过程中麦角硫因的损失,纯化后的麦角硫因的纯度为54.83%,产量为3.05 mg/g干重。此方法具有回收率高、操作简便等优点,可为麦角硫因提取液的进一步纯化提供科学依据与参考,促进金针菇中麦角硫因的利用,提高其应用价值。金针菇麦角硫因是一种天然抗氧化剂,安全无毒无副作用,在今后的研究中有待进一步分离纯化,并对其抗氧化性质进行更深的研究。

