内皮钙黏蛋白在子宫内膜异位症病变组织中的表达及其临床意义
孙静,张蕊,王荣毓
(北京市第一中西医结合医院 妇产科,北京 100021)
子宫内膜异位症的发生主要是长期的子宫内膜 腺体细胞侵袭能力改变有关。流行病学研究显示,现阶段临床子宫内膜异位症的发病率约为223~455/万[1]。子宫内膜异位症的病情进展,能导致患者不孕及卵巢功能的破坏,增加不良临床预后的发生风险。探讨子宫内膜异位症的发病机制过程中发现,不同分子的表达浓度改变,影响子宫内膜的变形能力,促进子宫内膜腺体细胞的增殖、抑制及凋亡,进而促进腺体细胞侵袭能力的改变。血管内皮钙黏蛋白(vascular endothelial cadherin, VE-cad)是重要的细胞间连接蛋白,其主要表达于平滑肌、血管内皮组织及肝肾上皮组织。VE-cad能通过干预细胞间的缝隙连接及紧密连接等,促进细胞间纤维蛋白成分的降解,干预子宫内膜腺体细胞的侵袭及转移风险的改变[2-3]。近年来相关研究发现,子宫内膜异位症或卵巢巧克力囊肿患者,VE-cad表达浓度可发生变化。为进一步探讨VE-cad与子宫内膜异位症的关系,本研究选取正常子宫,探讨相关指标的表达及其与患者病程和其他临床特征的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月—2017年9月北京市第一中西医结合医院病理科收集的40例正常子宫内膜、平滑肌组织(正常组)和80例子宫内膜异位症组织的子宫内膜、平滑肌组织(病例组)。正常组:年龄40~53岁,平均(47.0±5.2)岁;增殖期18例、分泌期22例。病例组:年龄40~54岁,平均(47.5±5.8)岁;增殖期38例、分泌期42例;根据不同内膜的位置,将患者分为在位和异位内膜组,各为40例,纳入标准:①子宫内膜异位症诊断标准参考中华医学会制定的标准;②正常子宫组织来源于因外伤等原因需要进行子宫切除;③研究对象各项基础资料完整。排除标准:①子宫内膜癌、卵巢癌等;②近3个月接受内分泌治疗;③伴有自身免疫性疾病;④长期应用激素类药物治疗。本研究通过医院伦理委员会批准,患者及其家属知情同意。两组年龄、子宫内膜所处分期比较,差异无统计学意义(P>0.05)。
1.2 实验方法
收集子宫内膜异位症患者的子宫内膜病变组织(包括子宫内膜和平滑肌组织),同时收集子宫内膜良性病变组织作为对照组,采用免疫组织化学分析VE-cad在子宫内膜异位症患者中的异常表达情况,并比较异位或在位子宫内膜组织中VE-cad表达差异情况。
1.3 免疫组织化学检测方法
所有组织标本经石蜡包埋后作连续切片,厚度约为4 mm,采用免疫组织化学链霉卵白素-生物素复合体法染色,二氨基联苯胺(diamionben zidene, DAB)显色。VE-cad抗体、PV6000通用型二抗及SP试剂盒和DAB显色盒均购自北京中杉金桥生物技术开发公司。以阳性片及磷酸盐缓冲液PBS代替一抗分别作为阳性及阴性对照,高倍显微镜下观察VE-cad的表达情况,具体染色步骤严格按照SP试剂盒说明书进行操作。
1.4 判断标准
免疫组织化学结果判定,VE-cad阳性着色表达于细胞膜孔细胞质,其呈黄色、棕黄色及褐色表达。根据着色强度,0分为无色;1分为淡黄色;2分为棕黄色;3分为褐色、黑色。根据阳性细胞比例,阳性细胞数目所占比例≤10%为1分;阳性细胞所占比例>10%~50%为2分;阳性细胞数>50%~75%为3分;阳性细胞数所占比例>75%为4分。两种积分相乘,总分<3分为阴性;≥3分为阳性。总分<3分为(-)表达;总分3~5分为弱阳性(+)表达;总分6~9分为阳性(++)表达;总分>9分为强阳性(+++)表达。
1.5 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组子宫内膜中VE-cad表达阳性率比较
3组子宫内膜中VE-cad表达阳性率比较,差异有统计学意义(P<0.05);病例组异位内膜组织中VE-cad表达阳性率高于病例组在位内膜组织、正常组子宫内膜组织,见表1和附图。
2.2 两组子宫平滑肌组织中VE-cad表达阳性率比较
两组子宫平滑肌组织中VE-cad表达阳性率比较,差异无统计学意义(P>0.05)。见表2。
2.3 不同影响因素子宫内膜异位症患者异位内膜组织中VE-cad阳性率比较
子宫内膜异位症患者异位内膜组织中VE-cad表达与患者年龄、病程有相关性(P<0.05)。年龄越大、病程越长的患者异位内膜组织中VE-cad表达率越高;子宫内膜异位症患者异位内膜组织中VE-cad表达与患者是否应用止痛药无关(P>0.05)。见表3。
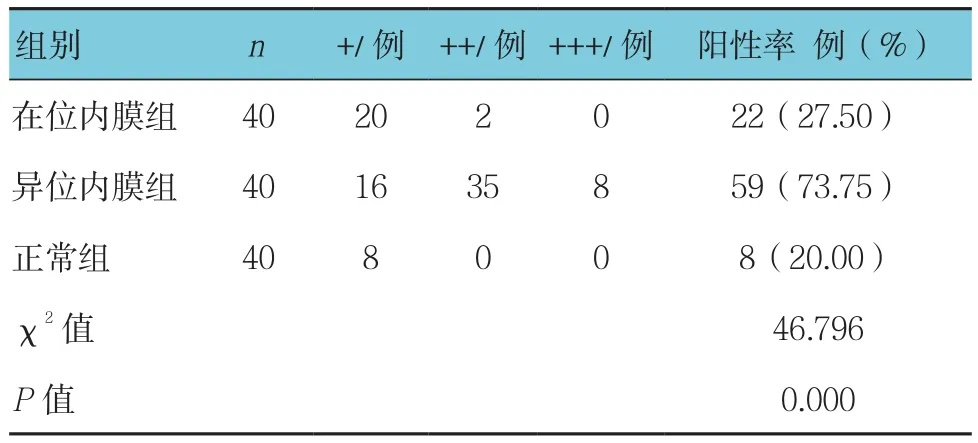
表1 3组子宫内膜中VE-cad表达阳性率比较
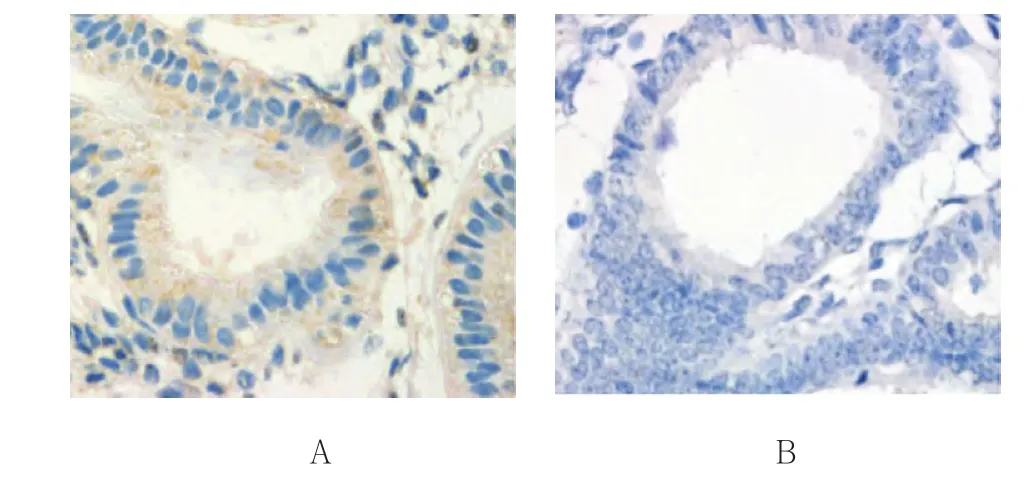
附图 两组异位内膜组织中VE-cad阳性表达 (×400)

表2 两组子宫平滑肌组织中VE-cad表达阳性率比较
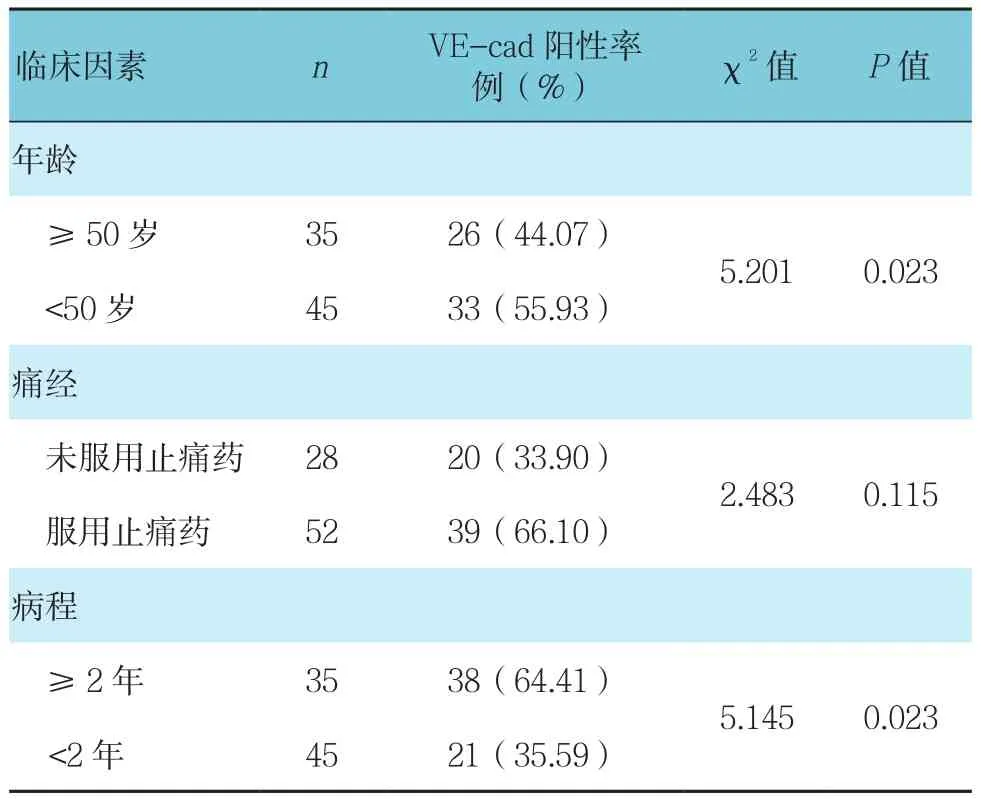
表3 不同影响因素子宫内膜异位症患者异位内膜组织中VE-cad阳性率比较
3 讨论
现阶段临床对子宫内膜异位症的治疗主要通过手术及围手术期的药物治疗为主。但长期的临床随访研究发现,子宫内膜异位症临床治疗总体有效率或治疗后妊娠结局等均无改善[1]。生物学治疗能在无创、精准治疗等方面发挥积极的临床价值,而本研究通过对子宫内膜异位症发病过程中相关因子分析,能为临床疾病的诊疗提供理论参考。同时本研究对VE-cad表达与子宫内膜异位症患者病程的关系研究,可为揭示临床疾病持续性进展、病情恶化的内在原因提供参考。
VE-cad结构包括多个含巯氨基酸,能在促进局部纤维蛋白酶的末端磷酸化过程中发挥作用,促进局部组织中金属蛋白酶的上调,增加细胞间质的分解。同时VE-cad能提高细胞的异型性,促进腺体细胞膜稳定性的下降,增加其对临近正常组织细胞的黏附能力,并提高其通过淋巴或者组织液渗透转移的风险[4-5]。相关基础方面研究显示,VE-cad能在提高癌细胞的扩散、促进癌细胞的淋巴结转移及远期器官转移等方面发挥作用,并增加局部血管内皮的通透性[6-7]。恶性肿瘤的发生或者临床分期的进展过程中,VE-cad高表达对患者的病情进展具有重要的促进作用[8-9]。而在子宫内膜异位症中的分析研究不足,本研究的创新性在于:探讨子宫内膜及平滑肌组织中VE-cad差异性表达;揭示VE-cad在子宫内膜异位病灶组织中的表达。
子宫内膜异位症病灶组织中可发现相关指标的异常表达,其中VE-cad表达浓度上升,高于子宫内膜原位病灶组织,提示VE-cad能影响到异位症病灶部位子宫内膜组织的细胞病变,从机制上可能与VE-cad对细胞的生物学特征的改变有关[10-11]:①VE-cad表达能影响到子宫内膜腺体细胞的持续性DNA扩增风险,导致细胞对卵巢上皮或者输卵管上皮细胞的黏附及浸润风险上升;②VE-cad表达能促进异位症病灶组织中的血管内皮细胞的新生,促进新生血管的形成,并提高异位症病灶组织的局部血流灌注。部分研究者在分析不同累及部位子宫腺肌症患者的蛋白谱的表达后发现,VE-cad表达阳性率可平均上升≥25%,且患者异位症病灶破坏越为明显,手术治疗后的复发率越高,VE-cad表达阳性率上升越为明显[12-13]。VE-cad表达主要定位于子宫内膜腺体细胞的周边及部分细胞质中,染色强度越深,VE-cad表达浓度越高,这可能提示VE-cad蛋白能够影响到细胞间质的代谢或者细胞内信号通路的传导等,进而影响到子宫内膜腺体的浸润及侵袭过程。但本次研究并未发现VE-cad在异位症病灶或者原位平滑肌组织中的表达差异:一方面考虑到VE-cad蛋白主要表达于内膜组织中;另一方面考虑与VE-cad蛋白主要作用腺体细胞,而对平滑肌细胞的影响较小。长期的VE-cad浓度蓄积能增加其对于腺体细胞病理改变的调控作用,而应用镇痛药物如GNRH类药物或者米非司酮等,并不能影响到VE-cad表达水平,其浓度较为稳定,提示临床可通过随访VE-cad蛋白的表达,进而评估子宫腺肌症患者的病情变化。
综上所述,子宫腺肌病异位内膜组织中VE-cad呈高表达,而年龄越大、病程越长,VE-cad蛋白的表达阳性率越高。但关于VE-cad表达与子宫腺肌症患者的临床分期、治疗预后关系仍然需要进一步探讨。

