雉鸡与AA+肉鸡生长、屠宰、免疫、肠道菌群及肉品质的比较研究
■周长海 李 亮 王 楠 张铭琪 张 晶 黄庭好 廖先东 张丽明
(吉林大学动物科学学院,吉林长春130062)
雉鸡(Phasianus colchicus),属鸟纲、鸡形目、雉科、雉属,又称野鸡、山鸡、环颈雉等。雉鸡是世界上重要的狩猎禽之一,共有31个亚种,分布于我国有19个亚种。为了保护野生资源,维持生态平衡,我国对环颈雉进行人工驯养,是目前人工驯养繁殖最成功且饲养量较大的经济型珍禽,是我国饲养的主要珍禽之一。雉鸡不但鲜美可口、营养价值高,还具有食疗、保健和观赏价值。
近年来,随着人民生活水平的提高,人们的膳食结构出现明显的变化,禽肉食品市场对高档质优的产品需求有较大的增长。而雉鸡肉味鲜美,营养丰富,味美可口,是高蛋白、低脂肪的野味佳肴。高秀华等(1990)报道,环颈雉肉(胸肌+腿肌)的粗蛋白质和热量分别比肉鸡高11.84%和17.75%,而胆固醇含量环颈雉比肉鸡低291.21%;戴四发等(2013)报道,公、母野山鸡粗蛋白质量分数分别比AA+肉鸡高43.3%、47.9%;粗脂肪质量分数方面,公、母AA+肉鸡分别为野山鸡的10.6、8.8倍。本试验旨在较全面和系统地研究我国人工养殖条件下,雉鸡与AA+肉鸡生长性能、屠宰性能、免疫性能、肠道菌群及肉品质之间的差异,为雉鸡的生产及品质评价提供一定的参考依据。
1 材料与方法
1.1 试验设计
试验选取健康、体重无差异的雄性6周龄AA+肉鸡(购于长春市某肉鸡养殖场)与16周龄雄性环颈雉鸡(购于吉林左家佳兴珍禽养殖基地,品种为左家雉鸡)各50只,分为2个处理组,每个处理组设置5个重复,每个重复10只鸡。饲喂相同的日粮,日粮组成及营养水平见表1。试验分为预饲期(7 d)与正式饲养期(14 d)2个阶段共21 d,整个饲养期采用单笼饲养的方式,饲养期间自由采食,自由饮水,自然通风,舍内湿度、饲养密度、光照和免疫等均按常规饲养管理要求进行。
1.2 仪器与试剂
仪器设备:超净工作台(苏净)、离心机、电子天平(赛多利斯科学仪器公司)、4 ℃冰箱(海尔)、-20 ℃冰箱(海尔)、-80 ℃冰箱(日本SANYO)、高压灭菌锅、生化培养箱、厌氧培养箱、水浴锅、马弗炉、定氮仪、OPTO-STAR型肉色仪(美国麦斯特公司)、CL-ML3嫩度测试仪等。

表1 基础日粮组成及营养水平(风干基础)
试剂:无水乙醇、蒸馏水、氯化钠水溶液、PBS缓冲液、牛肉膏、蛋白胨、胰蛋白胨、大豆蛋白胨、半胱氨酸盐酸、酵母浸粉、酵母提取物、乙酸钠、磷酸氢二钾、柠檬酸二胺、葡萄糖、吐温80、琼脂、EMB培养基、氯仿、硫酸、盐酸。
1.3 测定指标及方法
1.3.1 生长性能
在每周饲养试验开始前,称量各个重复投入饲料量,在结束时,称量剩余料量,计算各周AA+肉鸡、雉鸡的平均日采食量(ADFI);每周饲养试验结束时,早晨6:00断食、断水,8:00开始逐只称量体重,计算各周体增重(BWG);计算各周料肉比(FCR=FI/BWG);统计分析AA+肉鸡、雉鸡平均日增重(ADBWG)、平均日采食量(ADF)和料肉比(FCR)。
1.3.2 屠宰性能检测
在饲养试验结束时,禁食12 h后进行屠宰试验,采取胸肌、腿肌样品,保存于-20℃冰箱中,用作后续试验。测定屠体重、全净膛重、胸肌重、腿肌重、腹脂重,计算屠宰率、全净膛率、胸肌率、腿肌率、腹脂率。
屠宰率(%)=屠体重/活体重×100
全净膛率(%)=全净膛重/活体重×100
胸肌率(%)=胸肌重/全净膛重×100
腿肌率(%)=腿肌重/全净膛重×100
腹脂率(%)=腹脂重/全净膛重×100
1.3.3 免疫性能检测
1.3.3.1 血液生化指标的测定
屠宰试验时,翅下采血10 ml左右,立刻放入无菌离心管中,密闭,放入冰盒中,待所有鸡采血完毕,进行离心4 000 r/min,15 min之后,取上清液。分装于无菌的1.5 ml离心管中;-80℃保存。
利用血液生化分析仪检测血清中的总蛋白(TP)、白蛋白(Alb)、球蛋白(Glb)水平。检测地点为长春市金域检测中心。
1.3.3.2 免疫器官指数的测定
屠宰试验时,取完整脾脏、法氏囊、胸腺并称重。
脾脏指数(g/100 g)=脾脏重/活体重
法氏囊指数(g/100 g)=法氏囊重/活体重
胸腺指数(g/100 g)=胸腺重/活体重
1.3.4 肠道菌群的测定
1.3.4.1 肠道内容物的采集
在屠宰试验时,取盲肠和回肠交界处的一段肠管进行两端结扎,在无菌条件下取0.5 g左右的肠道内容物放入先前准备好的灭菌瓶中,再加入已经灭菌的生理盐水进行10倍稀释,振荡30 s左右。静置后,取上清液0.5 ml,转入盛有4.5 ml稀释液的灭菌瓶中进行102稀释,再振荡30 s,静置后,取上清液依次进行103~107倍稀释。
1.3.4.2 菌群的培养
依次挑选上述肠道内容物104、105、106倍的稀释液10 μl,分别接种于MRS培养基、PTYG培养基、EMB培养基中,对乳酸杆菌、双歧杆菌、大肠杆菌进行相应的培养。乳酸杆菌和大肠杆菌的分离与培养在常规培养箱中进行;双歧杆菌的分离和培养在厌氧培养箱中进行。
1.3.4.3 菌群计数
首先,在相应的培养基中对各种细菌进行培养后,然后,根据菌落的可数性原则,选择合适的稀释度,统计出各种菌落的个数,最后,再换算出每克肠道内容物中所含有的细菌数量,其结果以对数值的形式来表示(lgN/g)。
1.3.5 肌肉品质的测定
① 滴水损失率(%):称取约20 g左右的肌肉,记作m1。用铁丝挂住,然后用自封袋密封,挂在4℃冰箱中,尽量让肌肉不碰到袋壁。48 h后称重,记作m2。
滴水损失率(%)=(m1-m2)×100/m1
② 水浴损失率(%):称取约20 g左右的肌肉,记作m1,将温度计插入肌肉中心,然后自封袋封住,浸于75℃水浴中,等到肌肉中心的温度达到75℃时取出,常温冷却,用滤纸擦干表面水分后称重,记作m2。
水浴损失率(%)=(m1-m2)×100/m1
③剪切力:取经过水浴损失率测定后的肉样,用嫩度测试仪所带工具沿肌纤维方向钻取肉样,用CLML3嫩度仪进行测定,得出肌肉剪切力值(kg·f)。
④肉色:屠宰试验采取的胸肌与腿肌,测定胸肌与腿肌肉色。采用OPTO-STAR肉色测定仪,对屠宰后的胸肌与腿肌进行肉色测定。
⑤水分(%):取肉样于105℃烘干至恒重后称重,计算含水率。
⑥ 粗灰分(%):取肉样放干燥箱内,105℃烘干1 h后,置于马弗炉内550℃灼烧,测定灰分含量。
⑦ 粗脂肪(%):粗脂肪测定采用《GB/T 9695.7—2008肉与肉制品总脂肪含量测定》中索氏抽提法。
⑧粗蛋白(%):测定胸肌与腿肌中粗蛋白含量采用《GB5009.5—2010食品中蛋白质的测定》中凯氏定氮法。
1.4 数据处理与分析
Excel 2010对试验数据进行初步的统计分析,利用SPSS19.0统计软件进行统计分析,表中试验数据用“平均数±标准误”表示,采用单因子方差分析(oneway ANOVA,LSD),Duncan's多重比较检验,P<0.05或P<0.01为差异显著或极显著。
2 结果
2.1 雉鸡与AA+肉鸡的生长性能的比较
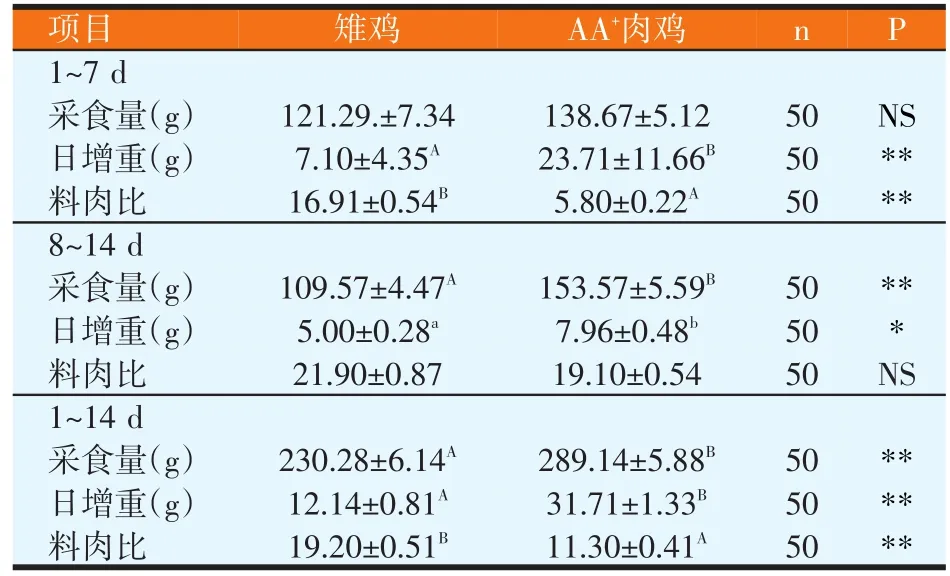
表2 雉鸡与AA+肉鸡生长性能的比较
由表2可知,在饲养的1~7 d雉鸡的日增重极显著的低于AA+肉鸡(P<0.01),在8~14 d雉鸡的日增重显著性的低于AA+肉鸡(P<0.05),在整个饲养期雉鸡的日增重极显著地低于AA+肉鸡(P<0.01)。在饲养的1~7 d雉鸡的采食量与AA+肉鸡没有显著性差异,但AA+肉鸡采食量高于雉鸡,在8~14 d AA+肉鸡的采食量极显著性地高于雉鸡(P<0.01),在整个饲养期AA+肉鸡的采食量极显著地高于雉鸡(P<0.01)。在饲养的1~7 d雉鸡的料肉比极显著高于AA+肉鸡(P<0.01),在8~14 d雉鸡与AA+肉鸡的料肉比没有显著差异,但雉鸡高于肉鸡,在整个饲养期AA+肉鸡的料肉比极显著地低于雉鸡(P<0.01)。
2.2 雉鸡与AA+肉鸡的屠宰性能的比较

表3 雉鸡与AA+肉鸡屠宰性能的比较(%)
由表3可知,雉鸡的屠宰率与AA+肉鸡相比没有显著性的差异,但雉鸡的屠宰率高于AA+肉鸡;雉鸡的全净膛率显著高于AA+肉鸡(P<0.05);雉鸡的胸肌率与AA+肉鸡相比没有显著性的差异,雉鸡的腿肌率与AA+肉鸡相比也没有显著性的差异,但雉鸡的胸肌率与腿肌率均高于AA+肉鸡;在腹脂率方面,雉鸡极显著地低于AA+肉鸡(P<0.01)。
2.3 雉鸡与AA+肉鸡的免疫性能的比较
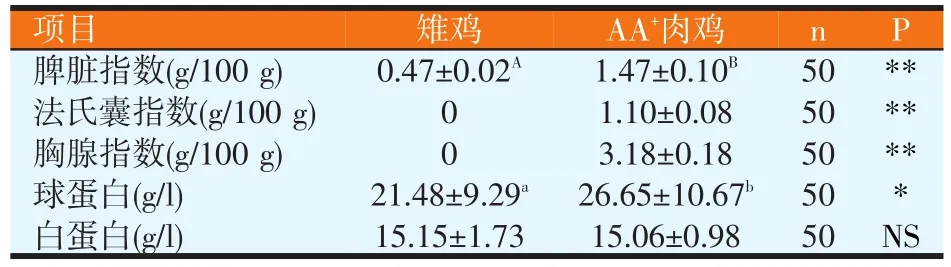
表4 雉鸡与AA+肉鸡免疫性能的比较
由表4可知,雉鸡的脾脏指数极显著地低于AA+肉鸡(P<0.01);雉鸡血清中的球蛋白数量显著地低于AA+肉鸡(P<0.05);但白蛋白方面,雉鸡与AA+肉鸡之间没有显著性差异。
2.4 雉鸡与AA+肉鸡的肠道菌群的比较

表5 雉鸡与AA+肉鸡肠道菌群的比较(lgN/g)
由表5可知,雉鸡肠道内的大肠杆菌数量显著地高于AA+肉鸡(P<0.05),雉鸡肠道内的乳酸菌数量显著地高于AA+肉鸡(P<0.05),但雉鸡肠道内双歧杆菌的数量显著地低于AA+肉鸡(P<0.05)。
2.5 雉鸡与AA+肉鸡的肌肉品质的比较
由表6可知,雉鸡胸肌的剪切力极显著地高于AA+肉鸡(P<0.01),是肉鸡的6倍左右,雉鸡胸肌中粗蛋白的含量极显著地高于AA+肉鸡(P<0.01),雉鸡胸肌中粗脂肪的含量极显著地低于AA+肉鸡(P<0.01),在肉色、滴水损失率、蒸煮损失率、水分、粗灰分方面雉鸡与AA+肉鸡没有显著性差异。
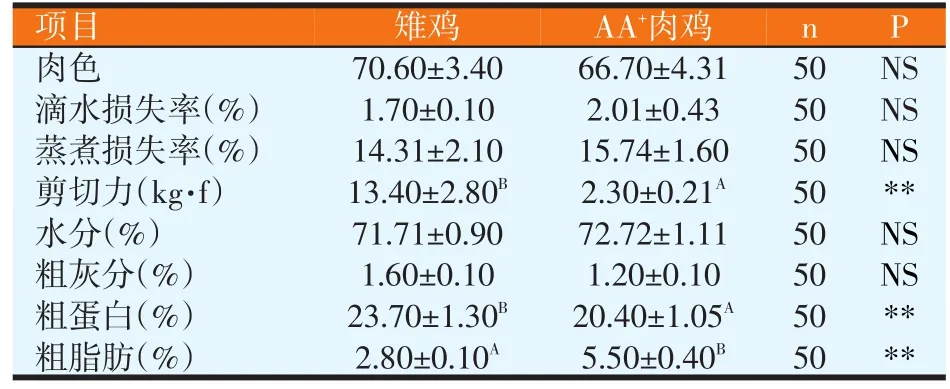
表6 雉鸡与AA+肉鸡胸肌肉品质的比较

表7 雉鸡与AA+肉鸡腿肌肉品质的比较(%)
由表7可知,雉鸡腿肌的剪切力极显著地高于AA+肉鸡,是肉鸡的6倍左右,雉鸡腿肌中粗蛋白的含量极显著地高于AA+肉鸡(P<0.01),雉鸡腿肌中粗脂肪的含量极显著地低于AA+肉鸡(P<0.01),在肉色、滴水损失率、蒸煮损失率、水分、粗灰分方面雉鸡与AA+肉鸡没有显著性差异,与胸肌结果相一致。
3 讨论
3.1 雉鸡与AA+肉鸡生长性能与屠宰性能的比较
动物体重是影响动物采食量的重要因素。一方面,动物体重增加,动物能量需要量增加;另一方面,动物肠道的发育与动物体重的增加通常呈一定的比例关系,体重越大,胃肠道容积也越大。胃肠道存在伸展受体,能将饲料产生的负反馈信息通过神经传递到下丘脑的摄食中枢,控制动物的采食量。胃肠道容积越大,刺激肠道伸展所需的饲料量就越多,因此动物的采食量就越大。本试验结果表明:在整个饲养期雉鸡的采食量极显著地低于AA+肉鸡(P<0.01)。AA+肉鸡的体重约为雉鸡的2倍多,与试验结果相符。本试验结果表明:在整个饲养期雉鸡的体增重极显著地低于AA+肉鸡(P<0.01)。在整个饲养期雉鸡的料肉比极显著地高于AA+肉鸡(P<0.01)。何玉华等[5]研究发现,雉鸡料肉比为4.72,本试验雉鸡料肉比为19.2,这可能是由于雉鸡之间日龄的差异造成的。综上,AA+肉鸡的生长性能要优于雉鸡。这可能是由于品种之间的差异造成的,具体机制有待于进一步的研究。韩占兵等研究发现,雉鸡屠宰率与全净膛率分别为92.66%、72.91%,本试验结果与上述试验一致。本试验结果表明:雉鸡全净膛率显著地高于AA+肉鸡(P<0.05),雉鸡屠宰率、胸肌率和腿肌率与AA+肉鸡没有显著性差异,但雉鸡屠宰率、胸肌率及腿肌率均高于AA+肉鸡,说明雉鸡产肉率高于AA+肉鸡。在腹脂率方面,雉鸡极显著地低于AA+肉鸡(P<0.01),肉鸡是雉鸡的3倍左右,说明雉鸡屠宰性能优于AA+肉鸡。
3.2 雉鸡与AA+肉鸡免疫性能与肠道菌群的比较
脾脏是禽类最大的外周免疫器官,是体内产生抗体的主要器官,参与全身的细胞免疫和体液免疫,胸腺为禽类的重要淋巴器官。其功能与免疫紧密相关,是T细胞分化、发育、成熟的场所,法氏囊是禽类特有的产生B细胞的体液免疫器官。免疫器官的发育状态及机能强弱直接决定着禽类的免疫水平,免疫器官相对重量增加,说明机体细胞的免疫机能增加。研究表明,胸腺、法氏囊和脾脏指数可以用来评价其免疫状况。刘小龙等研究发现,AA+肉鸡胸腺指数、脾脏指数和法氏囊指数分别为3.31、1.10和1.90。本试验结果表明:雉鸡的脾脏指数极显著地低于AA+肉鸡(P<0.01),AA+肉鸡的胸腺指数和法氏囊指数分别为3.18和1.10,与上述试验结果相一致。而雉鸡找不到胸腺与法氏囊。这可能是由于雉鸡为19周龄,免疫器官发生了退化。球蛋白是存在于血浆中的一类具有抗体活性的或化学结构与抗体相似的球蛋白,具有免疫作用,在机体防御系统中具有重要作用。本试验研究发现,雉鸡血清中的球蛋白数量显著地低于AA+肉鸡(P<0.05)。综上说明雉鸡免疫性能要弱于AA+肉鸡。动物肠道是一个复杂的微生态系统,大肠杆菌是动物肠道中的一种条件性致病菌,对维持肠道微生物区系平衡及动物体的健康起到不可或缺的作用,只有当肠道微生物区系失去平衡时才会引发疾病。乳酸菌是维持肠道微生物平衡的另外一种重要细菌。乳酸菌在其增殖过程中不仅能够产生大量乳酸,降低肠道的pH值,而且可以分泌抑制致病菌的天然抗生素,此外,乳酸菌还可以黏附在肠道细胞上,起到占位保护作用,同时,乳酸菌在繁殖过程中还会产生免疫调节因子,刺激肠道局部免疫系统的发育。双歧杆菌是重要的优势有益菌,具有维持肠道微生态平衡拮抗肠道条件致病菌(如大肠杆菌),提供营养增强机体免疫功能,对机体有明显的防御和保护作用。试验结果表明,雉鸡肠道内的大肠杆菌数量与乳酸菌数量均显著地高于AA+肉鸡(P<0.05),这可能是由于试验雉鸡为19周龄,AA+肉鸡为9周龄,大肠杆菌与乳酸菌在肠道内的数量随着日龄的增加而增加。雉鸡肠道内双歧杆菌的数量显著地低于AA+肉鸡(P<0.05),这可能是由于双歧杆菌分布在胃肠内的数量随日龄阶段的增长而减少,具体机制有待于进一步研究。
3.3 雉鸡与AA+肉鸡的肌肉品质的比较
雉鸡的胸肌及腿肌的肉色与AA+肉鸡没有显著性差异,但雉鸡胸肌及腿肌的肉色值均大于AA+肉鸡,说明雉鸡肌肉红度值高于AA+肉鸡,这与我们肉眼观察到的相一致。滴水损失率、蒸煮损失率与剪切力是评价肌肉品质重要的物理指标。滴水损失率反映肌肉在冷藏过程中的损失情况,用于评价肌肉在冷藏过程中的经济价值损失情况;水浴损失率直接反映肌肉的抗热处理情况,用于评价肌肉在热加工过程中的损失情况。戴四发等研究表明,雉鸡滴水损失率极显著低于AA+肉鸡(P<0.01);雉鸡蒸煮损失率显著低于AA+肉鸡(P<0.05)。本试验结果表明,雉鸡胸肌及腿肌滴水损失率与蒸煮损失率均低于AA+肉鸡,但差异不显著,这可能是由于本试验雉鸡与AA+肉鸡的周龄较大。有关肌肉剪切力方面,本试验结果表明:雉鸡胸肌及腿肌剪切力均极显著高于AA+肉鸡(P<0.01),约为AA+肉鸡的6倍左右,说明雉鸡的嫩度非常低,不具备AA+肉鸡那样适合于油炸工艺的加工性状,并不适合于快餐式的消费特点,但对于我国消费者的传统饮食习惯来说,野山鸡肉更适合采用较长时间的红烧方式进行加工,能体现出很好的烹饪性和咀嚼性,非常适宜工业化生产的传统即食食品。雉鸡胸肌与腿肌在肉色、滴水损失率、蒸煮损失率、水分、粗灰分方面与AA+肉鸡没有显著性差异。粗蛋白与粗脂肪也是评价肌肉品质重要的指标。张亚兰等研究表明,雉鸡胸肌粗蛋白含量与粗脂肪含量分别为25.13%、1.02%,腿肌粗蛋白含量与粗脂肪含量分别为22.31%、1.95%。王峰等研究表明,雉鸡肌肉粗蛋白含量显著高于AA+肉鸡,肌肉粗脂肪含量显著低于AA+肉鸡。本试验结果表明:雉鸡胸肌与腿肌中粗蛋白的含量极显著地高于AA+肉鸡(P<0.01),雉鸡胸肌与腿肌中粗脂肪的含量极显著地低于AA+肉鸡(P<0.01),试验结果与前人研究结果相一致。
4 结论
雉鸡的生长性能不如AA+肉鸡;但雉鸡的屠宰性能要优于AA+肉鸡;雉鸡的免疫性能不如AA+肉鸡;雉鸡胸肌与腿肌中粗蛋白的含量高于AA+肉鸡,粗脂肪的含量低于AA+肉鸡,肌肉嫩度较低。
(参考文献刊略,需者可函索464950211@qq.com)

