两种育肥方式对阿尔巴斯白绒山羊羔羊瘤胃发酵功能的影响
■张永胜 闫素梅孙国平
(内蒙古农业大学动物科学学院,内蒙古呼和浩特010018)
近年来,因羊绒价格低迷、羊肉需求量和价格的不断上涨,以及草场载畜量的限制,舍饲育肥已成为提高绒山羊经济效益的重要方式。内蒙古白绒山羊肉质鲜嫩、无膻味,价格要高于绵羊肉。羔羊肉因为营养丰富、柔嫩多汁、纤维较细、胴体瘦肉多、脂肪少、胆固醇含量低、饲料报酬高等特点深受人们的青睐(王锐等,2005)[1]。内蒙古白绒山羊一直以来以草场放牧为主,具有耐旱、耐粗饲、消化率高及抗病能力强等特点(蒙成志,2008)[2]。然而,近年来,为保护草原生态环境,我国加大了对绒山羊放牧饲养的限制,出于经济效益的考虑,绒山羊羔羊除少部分留作种用,其余均淘汰后作为肉用。因此,为提高生产效率,大部分绒山羊会转为舍饲育肥,而舍饲育肥会改变绒山羊的瘤胃发酵功能,进而影响绒山羊的健康和育肥效果。马慧忠(2008)[3]研究发现,绒山羊瘤胃pH值、乙酸、总挥发性脂肪酸(TVFA)浓度和乙/丙比会随着日粮精料比例的下降而提高。田靖(2016)[4]研究了不同精粗比日粮对奶山羊瘤胃发酵功能的影响,结果表明瘤胃菌体蛋白(BCP)和NH3-N浓度会随着饲粮精料的提高而增高,乙酸/丙酸则会显著下降。但目前关于两种育肥方式与绒山羊瘤胃发酵特性影响的报道较少。鉴于此,本试验旨在研究放牧补饲育肥与舍饲育肥条件下对绒山羊羔羊瘤胃的影响,从而为进一步制定和完善阿尔巴斯白绒山羊羔羊的育肥方案、不断提高肉品质和经济效益提供理论依据。
1 材料与方法
1.1 试验动物与试验设计
采用单因素完全随机试验设计,从内蒙古白绒山羊种羊场淘汰的羔羊中选择健康、体重、日龄相近的4月龄羯羔60只,将羔羊随机分为2组,每组30只。试验组进行放牧补饲育肥,即在原草场上放牧并按每只羊每天300 g的玉米(风干基础)进行补饲;试验组采用全混合日粮进行舍饲育肥。试验期为120 d,分为3个阶段:试验前期(1~30 d)、中期(31~60 d)和后期(61~90 d)。绒山羊羔羊自由采食,自由饮水。
1.2 日粮组成
对照组采食牧草的营养水平见表1;试验组日粮精粗比为4∶6(1~30 d),5∶5(31~90 d),干物质采食量分量为1.08、1.17、1.17 kg/d,日粮组成及营养水平见表2。
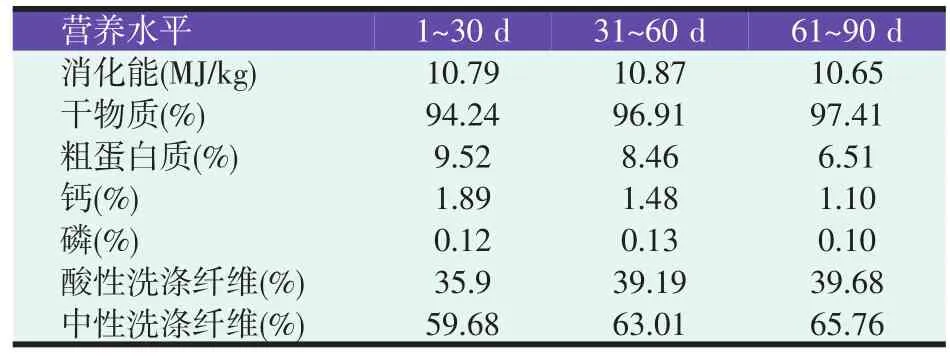
表1 对照组羔羊采食牧草营养水平(风干基础)

表2 试验组日粮组成及营养水平(风干基础)
1.3 瘤胃液的采集与预处理
待试验结束时,分别从对照组和试验组中选择接近平均体重的6只羯羔、禁食24 h、禁水2 h后屠宰,采集瘤胃液约0.4 L,并立即测定pH值。瘤胃液经4层纱布过滤,然后在4 000 r/min离心15 min,按照各项指标进行前处理,-20℃密封保存。
1.4 测定指标与方法
1.4.1 pH值及NH3-N浓度的测定
pH值的测定:采集瘤胃液后立即使用PHS-3S型高精度酸度计测定。
NH3-N浓度的测定:采用冯宗慈等(1993)[5]的方法进行。
1.4.2 瘤胃菌体蛋白(BCP)浓度的测定
采用考马斯亮蓝法测定BCP浓度Bradford(1976)[6],样品前处理参照John(1997)[7]的方法进行,具体试验步骤如下:从-20℃冰箱取待测样品,解冻并取上清液20 ml,在高速离心机12 000 r/min离心20 min,弃掉上清液用生理盐水冲洗,然后再离心,重复两次。加入蒸馏水20 ml并混匀,取1 ml该沉淀物水溶液与浓度为2 mol/ml的NaOH溶液等体积混合,然后将2 ml的混合溶液在水浴锅90℃条件下预热10 min,然后在高速离心机10 000 r/min离心5 min。取上清液与0.833 mol/ml的HCl按1∶1.5的比例混合,室温静置,然后用722型可见分光光度计测定其含量。
1.4.3 VFA浓度的测定
VFA的测定参照秦为琳(1982)[8]的内标法进行,用巴豆酸作为内标物具体试验步骤如下:从-20℃冰箱取处待测样品,解冻并取上清液1 ml,加入0.2 ml内标物并混匀,在高速离心机10 000 r/min离心10~15 min,用微量取样器准确吸取上清液,用日本岛津GC-2014型气相色谱仪测定VFA的含量。
1.5 数据处理
试验数据用Excel进行整理,应用SAS9.2统计程序进行t检验分析,统计结果P<0.05表明差异显著,0.05<P<0.10表明差异趋于显著。
2 结果与分析
2.1 两种育肥方式对绒山羊瘤胃pH值、NH3-N和BCP浓度的影响(见表3)

表3 育肥方式对羔羊瘤胃液pH值、NH3-N和BCP浓度的影响
表3的结果表明,试验组羔羊瘤胃NH3-N与BCP浓度显著高于对照组(P=0.011,P=0.026);pH值趋于显著低于对照组(P=0.06)。
2.2 两种育肥方式对羔羊瘤胃液中VFA浓度的影响
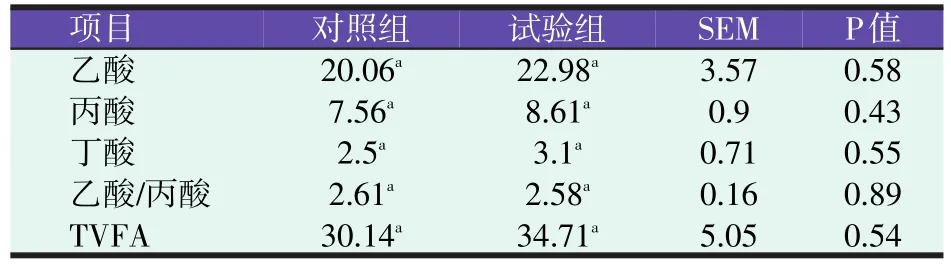
表4 育肥方式对羔羊瘤胃液VFA含量的影响(mmol/l)
表4的结果表明,试验组羔羊瘤胃乙酸、丙酸、丁酸、TVFA浓度及乙酸/丙酸比值与对照组相比差异均不显著(P>0.05),但除乙酸/丙酸外,其他指标在数值上均高于对照组。
3 讨论
3.1 两种育肥方式对羔羊瘤胃液pH值的影响
瘤胃pH值是反映瘤胃发酵程度和内环境稳定的一个重要指标,对反刍动物内环境的稳定起着重要的作用。pH值受到许多因素的影响,但主要以日粮组成与营养成分的影响为主(楼丽萍,2007)[9]。瘤胃发酵所生成的VFA大部分会通过血液吸收,其它会与唾液中和或随食物进入肠道,使pH值维持在一定范围之内,瘤胃液pH值的大概范围在5.5~7.5(Smet等,1995)[10]。瘤胃微生物对pH值变化极为敏感,超出正常的范围会影响微生物的活性甚至死亡,进而影响瘤胃发酵进程(赵广永等,2000)[11]。瘤胃pH值会影响羊瘤胃发酵参数,两组羔羊的瘤胃液pH值均在7.23~7.45之间变化,均在正常范围之内。说明在舍饲育肥采用的日粮,并不会使瘤胃pH值发生太大的变化,进而也不会危害绒山羊的健康。试验组羔羊的瘤胃pH值低于对照组主要与其日粮组成中较高比例的精饲料有关。
3.2 两种育肥方式对羔羊瘤胃液NH3-N浓度的影响
NH3-N含量是反刍动物瘤胃微生物和合成BCP的主要氮源,能反映瘤胃微生物对含N物质的利用情况与分解及瘤胃内蛋白质与合成分解的平衡程度。瘤胃中约有26%的细菌生长不可缺少NH3-N,约50%的细菌生长可将其作为唯一的氮源(杨春涛等,2014)[12]。瘤胃NH3-N水平受很多因素影响,主要包括动物的采食速率、饲粮结构和营养、唾液分泌量和瘤胃内挥发性脂肪酸的含量以及pH值等,其中饲粮结构的影响最大(刘哲等,2005)[13]。瘤胃液中NH3-N含量应保持在一定的范围内,过高会增加瘤胃氮循环中氮素的损失;过低则会影响瘤胃微生物合成菌体蛋白的活性,并限制瘤胃微生物合成和分解纤维素的效率(Hristov等,2002)[14]。瘤胃微生物生长需要一个适宜的NH3-N水平,只有在合适的浓度才能促进氮源的合理利用,其最佳浓度约为6.3~27.5 mg/100 ml(Murphy等,1987)[15]。
本试验,舍饲育肥方式改变了绒山羊日粮的精粗比例,即增加了精料的比例。试验组羔羊瘤胃NH3-N显著升高,但均在报道的范围内,舍饲育肥适当地提高了瘤胃NH3-N浓度而不会造成浪费。说明舍饲育肥,能够给瘤胃微生物提供充足的能量和N源,增加瘤胃微生物利用饲料中的蛋白合成BCP的速率,提高对纤维类物质的降解率,改善瘤胃的发酵功能并促进育肥生长。
3.3 两种育肥方式对羔羊瘤胃液BCP浓度的影响
BCP是反刍动物的主要氮源,能够为反刍动物提供一半以上的蛋白供应,能影响瘤胃微生物的数量、活性及代谢等。瘤胃微生物能够利用NH3-N以及碳水化合物而合成自身所需要的蛋白质(周贵等,2011)[16]。本试验舍饲组饲喂全混合日粮,可以为瘤胃微生物提供充足的氮源和能量来源,进而提高瘤胃微生物合成BCP的效率。因此,试验组的BCP浓度显著高于对照组,且与NH3-N浓度变化呈相同的变化规律。实验结果表明,舍饲育肥可以促进微生物对日粮氮源和碳源的利用,进而促进绒山羊羔羊的育肥效果。
3.4 两种育肥方式对羔羊瘤胃VFA浓度的影响
VFA主要是反刍动物重要的能量、脂肪来源,其含量及组成比例能反映瘤胃微生物的活力和发酵功能[17]。乙酸和丙酸分别是生脂和生糖脂肪酸,可为反刍动物提供80%~90%的葡萄糖(冯仰廉,2004)[18]。乙酸与丙酸是瘤胃VFA发酵类型的标志,比值大于3时,为乙酸型发酵,有利于泌乳动物乳脂率的提高,反之则为丙酸型发酵,提供能量较多,有利于家畜育肥(L.Kung,1998)[19]。当日粮中精料的比例越高时,乙酸/丙酸的比值越小(Ellis等,2012)[20]。
本试验研究得出,试验组的TVFA浓度与对照组差异不显著(P>0.5),但数值上有所增加,表明舍饲育肥对绒山羊羔羊的瘤胃发酵有一定的促进作用。而舍饲组与放牧补饲组相比乙酸/丙酸差异并不显著,这可能是由于舍饲育肥条件下均提高了乙酸和丙酸的浓度;但两种育肥方式下乙酸/丙酸均小于3,属丙酸型发酵,舍饲组在数值上要低于放牧组。这可能是,试验组日粮的精粗比增高,会提高TVFA的含量并促进瘤胃的丙酸型发酵,进而能满足瘤胃微生物的能量需求,促进BCP的合成,对绒山羊的育肥有积极作用。
4 结论
①与放牧补饲育肥相比,舍饲育肥能显著增加绒山羊羔羊瘤胃NH3-N和BCP浓度(P<0.05);趋于显著地降低瘤胃pH值(0.05<P<0.1);虽然对VFA浓度无显著变化(P>0.05),但在数值上有所改善。
②舍饲育肥可促进绒山羊羔羊的瘤胃发酵功能,对绒山羊的育肥有积极作用。

