杨树湿心材致病细菌及其拮抗细菌的鉴定
宋春草 梅 莉 蔡 丽 张 帅 樊孝萍
(1.乐山师范学院生命科学学院,四川 乐山 614000;2.华中农业大学园艺林学学院,湖北 武汉 430070; 3.华中农业大学植物科技学院,湖北 武汉 430070;4.湖北省林科院石首杨树研究所,湖北 荆州 434400)
杨树 (Populus) 是我国分布最广、面积最大的造林树种,在我国木材供应和生态环境建设中发挥重要作用。湿心材病是一种发病率高、危害大、防治难的枝干病害,在全世界范围内的多个树种上普遍发生,在杨树中发生尤为严重。2014年湖北省杨树湿心材调查结果显示,湖北省杨树湿心材平均发病达到了89.7%,且发生严重的林分平均湿心材面积比例达到了0.399[1]。杨树湿心材病变组织理化性质发生改变,对木材干燥、加工及利用造成严重不利的影响,已经成为限制我国杨树产业发展的重大难题[2]。
湿心材病主要是由微生物活动导致的,并一定程度上受林地环境条件的影响[3-4]。晁龙军等[5]从20多种杨树中分离出的层出镰刀菌 (Fusariumproliferatum) 能导致杨树植株出现典型湿心材症状;赵桂华等[6]从杨树湿心材组织中分离出了砖红镰刀菌 (F.lateritium) 和接骨木镰刀菌 (F.sambucinum),经田间接种实验证明其具有很强的致病性。因此,导致杨树湿心材病的致病菌可能是多样的,主要致病菌仍需要进一步分离鉴定。以往采用形态和生理生化方法鉴定杨树湿心材致病菌存在一定的局限性,结合分子生物学方法通过对细菌DNA的同源性、基因的遗传距离、系统进化等分析可以直接揭示不同细菌间的遗传进化关系,在鉴定菌种上更具客观性和可靠性优势[7-8]。宋春草等[9]结合形态、生理和分子生物学手段鉴定出一种胡萝卜果胶杆菌胡萝卜软腐亚种 (Pectobacteriumcarotovorumsubsp.carotovorum) 具有导致湿心材的明显致病性,并对该菌侵染杨树的主要途径进行了初步研究。
杨树湿心材病的防治尚无有效方法,是当前亟待解决的问题。郑华英等[10]曾尝试用林间化学杀菌剂防治杨树湿心材病,发现防治实验效果甚差。由于湿心材发病位置在树干内部,一般化学防治难以直达病理部位,而且化学农药的长期大量使用,会造成环境污染及病菌的抗药性增强问题。而内生拮抗菌在一些植物病害生物防治方面已有大量成功实例[11],杨树中也有相关成功的案例[12],但目前国内外尚没有关于杨树湿心材病的内生拮抗菌的研究。因此,从杨树体内分离筛选有益拮抗菌,对于杨树湿心材病及其他杨树枝干病害的防治具有重要意义。
1 材料与方法
1.1 实验材料
实验所用杨树湿心材采自湖北省石首市杨树研究所 (东经112°25′,北纬29°40′),以我国华中地区主栽杨树品种为病理组织采集对象,包括华石1号、I-69、I-63、I-72、南林895号、中潜3号、中石7号。标准菌株BrenneriasalicisLMG 2698T (BS), 标准菌株PaenibacillustaiwanensisBCRC 17411T (PT)。
1.2 实验方法
1.2.1致病菌筛选与致病性验证
用火烧消毒处理的生长锥于树木胸高处钻取木芯样品,每个品种取3棵树的心材,取病健交接处木质部组织,使用常规的组织分离法进行病原菌的分离,剪碎并加入灭菌生理盐水充分振荡摇匀获得菌液,30 min后划线接种于哥伦比亚血平板培养基上分离纯化,36 ℃培养12 h。筛选出10个优势菌株,温室栽培的当年生中石7号杨树实生苗为病菌回接对象。于7月底分别接种10个菌株,接种时苗高1 m左右,地径0.5 cm左右。
冻存菌株用LB液体培养基活化,36 ℃培养24 h,制备1 × 108CFU/mL菌悬液。用无菌注射器吸取菌液1 mL在距地表20 cm处茎段注入接种,深度为以伤及木质部为准,CK则用无菌培养基接种,各处理品种每株苗茎同时注射5次,每个处理品种重复接种10株苗。注射前在预注射部位用75%酒精消毒,注射后用脱脂棉浸透菌液包裹在伤口处,再用封口膜固定以防止水分散失。2个月后对接种材料进行截干,距离接种点上下15 cm处截断苗茎,取明显发病的茎段,用组织分离法对发病组织进行病原菌再分离,对比观察两次分离所得菌株的形态特征,提取再分离菌株与接种菌株的DNA,PCR扩增16SrRNA序列进行测序比对,同源性比对相同则表明接种成功。
1.2.2拮抗菌筛选方法
从发病轻微的杨树心材中分离拮抗细菌,分离方法与致病菌分离方法一致,共筛选出18个优势菌株。采用对峙培养法初筛 (菌液),具体是将致病菌和分离到的内生菌分别接种到LB液体培养基中,36 ℃ 160 r/min摇床培养14 h。然后取100 μL病原菌液均匀涂布于NA平板,静置数分钟,然后将直径1 cm的无菌滤纸片分别浸入各供试细菌菌液中,再将滤纸片贴在平板的相应区域 (以浸湿LB液体培养基的滤纸片为CK),每种菌3次重复,平板置于36 ℃培养箱中培养2~3 d,观察记录抑菌圈的有无及大小。
滤液复筛:使用发酵法,将初筛菌株分别接种到LB液体培养基中,36 ℃ 160 r/min摇床培养3 d,用0.22 mm细菌过滤器过滤供试细菌培养液,然后取100 μL病原菌液涂布NA平板,静置数分钟,然后将直径1 cm的无菌滤纸片分别浸入各供试细菌菌液中,再将滤纸片贴在平板的相应区域 (以浸湿LB 液体培养基的滤纸片为CK),每种菌3次重复,平板置于36 ℃培养箱中培养2~3 d,观察记录抑菌圈的有无及大小。观察是否有拮抗圈产生以及拮抗圈大小。
接种复筛:将筛选到的拮抗菌和病原菌分别接种到LB液体培养基中,36 ℃ 160 r/min摇床培养24 h,制备1 × 108CFU/mL菌悬液。选择生长一致的1年生杨树实生苗,用无菌注射器吸取1 mL菌液在距地表20 cm处茎段注入菌液接种,深度为以伤及木质部为准,共设置4个处理:T1,先接种拮抗菌,24 h后再接种病原菌;T2,只接种拮抗菌;T3,只接种培养基,作为阴性对照;T4,只接种病原菌,作为阳性对照。每处理3个重复,将处理好的杨树放置于防虫温室内培养。接种50 d后对处理材料截干。将截干枝条带回室内,在位于接种点上下高10~15 cm处截断,然后自中央髓心出纵向剖开,调查接种点上下髓心部及边材产生湿心材症状的长和宽,记录各处理湿心材发病情况 (表1),按公式 (1)~(2) 计算病情指数和防治效果。
病情指数=100 × ∑ (各级病株数 × 各级代表值)/(调查总株数 × 最高级代表值)
(1)
相对防治效果 (%)=[(对照病情指数-处理病情指数)/对照病情指数] × 100%
(2)

表1 杨树湿心材病心材症状等级Table 1 Symptom grade of heartwood from Populus with wet-heartwood disease
注:症状以心材变色长度为标准 (变色心材长度范围为1.7~15.4 cm)。
1.3 致病菌和拮抗菌的鉴定
1.3.1形态鉴定
无菌条件下,在直径9 cm的培养皿内,用PDA培养基对致病菌和拮抗菌进行划线培养,观察菌落的形状、边缘特征、表面是否光滑、凸起形状、透明度、色素产生情况等。利用负染法染色,透射电镜观察菌体形状、有无芽胞、芽孢数量和着生位置以及鞭毛特征 。
1.3.2生理生化鉴定
将BS作为对照菌株,参照任欣正[13]的方法分类和鉴定植物病原菌。
1.3.3全细胞脂肪酸分析
将致病菌株和BS于TSBA固体培养基中划线培养24 h后,收集菌体。脂肪酸分析由华中农业大学农业微生物学国家重点实验室完成。使用Sherolock全自动细菌鉴定系统 (MIDI公司,美国)。
皂化反应:加入1 mL溶液1 (45 g氢氧化钠溶于150 mL甲醇及150 mL蒸馏水),沸水浴30 min,杀灭细菌并使细胞裂解,从而使菌体中的脂肪酸游离;甲基化:加入2 mL溶液2 (190 mL浓盐酸、275 mL甲醇溶于135 mL蒸馏水),80 ℃水浴10 min,使游离的脂肪酸变为挥发性的脂肪酸;萃取:加入1.25 mL溶液3 (正己烷与甲基叔丁基醚的等体积混合液) 萃取脂肪酸甲酯;碱洗涤:加入3 mL溶液4 (10.8 g氢氧化钠溶于900 mL蒸馏水) 及数滴溶液5 (饱和氯化钠溶液),快速振荡5 min,取上层有机相置气相色谱样品专用瓶中备用。
1.3.4致病细菌分子鉴定
细菌DNA的提取:将待测细菌接于LB液体培养基中活化,36 ℃、160 r/min培养24 h,取1.5 mL菌液于2 mL离心管中离心得菌体,加无菌水再次离心,弃去上清液,使用细菌DNA提取试剂盒 (北京康为世纪生物科技有限公司,中国) 提取DNA。
16SrRNA扩增与测序:16SrRNA序列扩增采用细菌通用引物8F/1525R。
8F:5′-AGAGTTTGATCATGGCTCAG-3′,
1525R:5′-TACGGTTACCTTGTTACGACTT-3′ (上海桑尼生物技术有限公司合成)。
PCR反应体系:LAmp PCR Buffer (10×) 5 μL,NTP (2.5 mmol/L) 4 μL,8F (10 μmol/L) 2 μL,1525R (10 μmol/L) 2 μL,TaqDNA (5 U/μL) 1 μL,DNA 2 μL,C-Solution3 (5×) 10 μL,ddH2O 24 μL。
PCR扩增程序:94 ℃预变性5 min,94 ℃ 30 s,55 ℃退火30 s,72 ℃延伸40 s,35次循环,最后72 ℃延伸10 min。PCR反应结束后,用1%琼脂糖凝胶对反应产物进行电泳检测。PCR产物测序由上海桑尼生物科技有限公司完成。测得菌株的序列输入EzBioCloud网站 (http://eztaxon-e.ezbiocloud.net/) 的EzTaxon中,比较菌株12-1与其他已知细菌标准菌株的16SrRNA序列同源性,选取与测序菌株序列同源性高的菌株,在MEGA5.0中进行比对,用最大自然法ML构建系统进化树。
多基因序列分析 (MLSA) 研究选用gyrB、rpoB、atpD和infB这4个基因。PCR扩增引物参照李永[14]的方法,引物由上海桑尼生物技术有限公司合成。
PCR反应体系:10 × PCR buffer 5.0 μL,dNTP (2.5 mmol/L) 4.0 μL,F (10 pmol/L) 2.0 μL,R (10 pmol/L) 2.0 μL,Taq酶 (2.5 U) 1.0 μL,DNA (5~100 ng/μL) 2.0 μL,无菌超纯水34 μL。
PCR扩增程序:94 ℃预变性5 min,94 ℃ 45 s,55 ℃退火60 s,72 ℃延伸60 s,35次循环,最后72 ℃延伸8 min。PCR产物的电泳检测方法同16SrRNA序列检测法。从GenBank (http://www.ncbi.nlm.nih.gov/) 下载与12-1菌株相关的已知标准菌株的gyrB,rpoB,infB和atpD序列。使用Mega 5.0软件将这4个看家基因进行手工拼接组成一个大的完整的片段,顺序依次是gyrB、rpoB、infB和atpD。然后利用Mega 5.0对拼接好的的基因片段进行比对,用最大自然法ML构建系统进化树。
2 结果与分析
2.1 致病菌的分离及致病性
通过平板分离法分离纯化得到10个菌株 (表2),皆为杆状或棒状,除3~6号菌株外,其余9个菌株皆为革兰氏阴性菌。
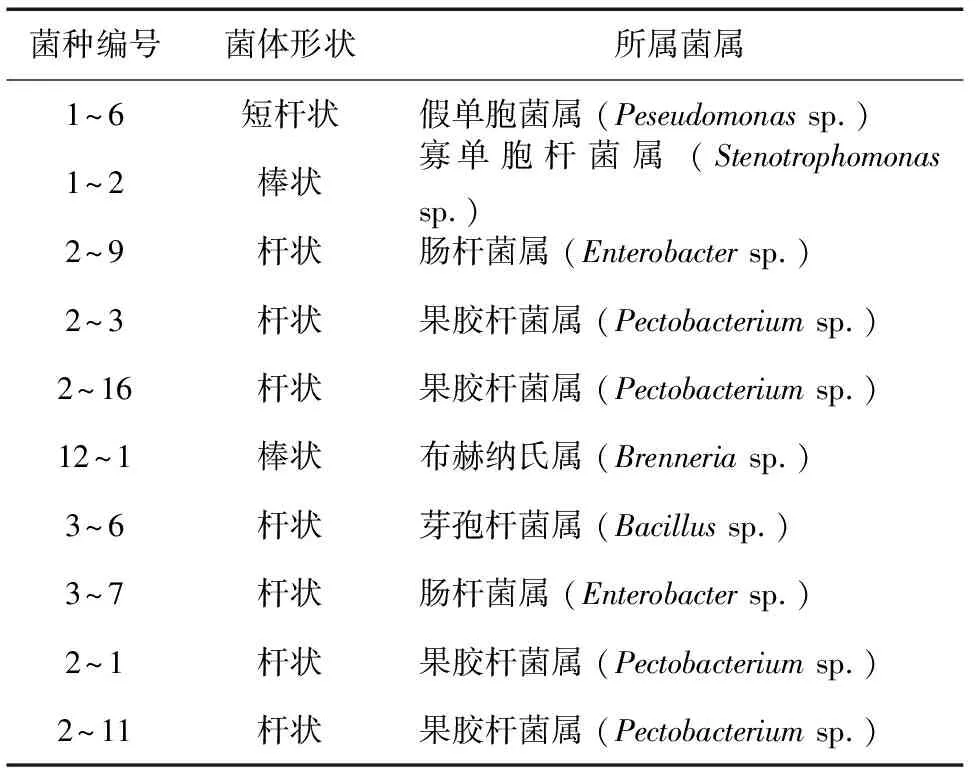
表2 杨树中分离出的10个细菌菌株形态特征Table 2 Morphological characteristics of 10 bacterium strains separated from Populus
将分离纯化的10个菌株分别回接到健康的1年生实生苗。结果表明:12-1能在杨树上引起典型的心材变色腐烂现象,病症从接种处分别向茎上下扩散,向上扩散较迅速,病斑纵向扩展较横向扩展明显,接种点边缘的树皮明显腐烂下陷 (图1a),CK则只有刺伤处伤口愈合痕迹,没有腐烂现象 (图1b)。
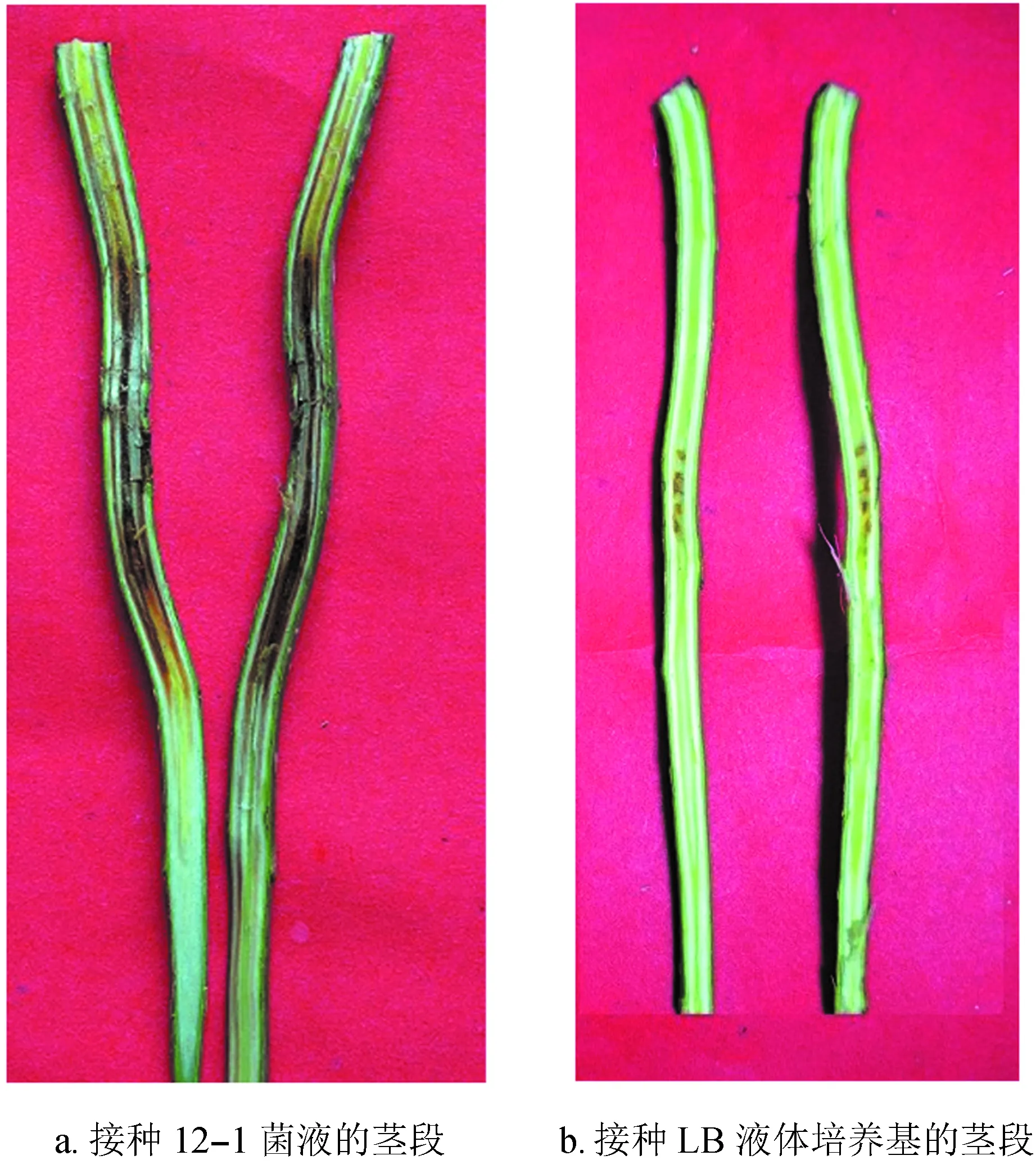
图112-1菌株回接杨树实生苗致病现象
Fig.1 Symptoms of wet-heart wood caused by 12-1 pathogen strain inPopulusseedlings
对接种后发病的杨树苗茎干进行病原菌再分离,均分离到与接种菌菌落形态一致,且16SrRNA基因序列一致的菌株,表明该菌是导致杨树湿心材的致病菌之一。
2.2 致病菌鉴定
2.2.1致病菌形态
在PDA培养基上,12-1菌落呈乳白色,边缘光滑、凸起、不透明、不产生色素 (图2a);革兰氏染色为红色、阴性,菌体呈短杆状 (图2b)。电镜下12-1菌体呈短杆状,两端钝圆,大小0.5~1 μm × 1~3 μm;周生鞭毛,无芽孢 (图2c)。
2.2.2致病菌生理生化特征
12-1菌株为革兰氏阴性菌,氧化酶和硝酸盐还原为阴性,葡萄糖氧化发酵,37 ℃不能生长 (表3)。表明12-1菌株各项生理生化特征和BS基本一致。

图212-1菌株形态鞭毛特征
Fig.2 Morphology and flagellation characteristics of 12-1 bacteria strain

表3 12-1和BS生理生化特征比较Table 3 Phenotypic characteristics between 12-1 and BS
注:+.阳性; -.阴性; /.不稳定。
2.2.3全细胞脂肪酸特征
致病菌株12-1主要脂肪酸为C14:0,C16:0,C17:0,iso-C16:1/C14:03-OH和 C16:1ω7c/iso-C15:02-OH。12-1菌株的脂肪酸种类和BS的脂肪酸种类基本相同,脂肪酸丰度较高的种类一致性更明显,如脂肪酸C12:0,C16:0,这2种脂肪酸的丰度都与BS的脂肪酸丰度一致 (表4)。
2.2.4致病细菌分子鉴定
16SrRNA基因序列分析, 12-1菌株基因片断长度为1 414 bp (GenBank登陆序列号KR401279)。
经16SrRNA序列同源性对比,结果显示12-1菌株和Brenneria属的BS同源性最高,达到99.18%,与其他标准菌株的同源性低于97%。

表4 菌株12-1与BS的脂肪酸特征Table 4 Fatty acid composition characteristics between 12-1 and BS
于NCBI下载与12-1菌株近缘种标准菌的16SrRNA序列,以标准菌株CronobactersakazakiiATCC 29544 T为树根,用软件MEGA 5.0构建ML系统发育进化树,序列大小为1 500 bp左右,1 000次验证,自展值大于50%显示。从构建的系统进化树结果可以看出,基于16SrRNA基因序列构建的ML进化树中,该菌种与BS聚成单独的进化枝 (自展值为99%) (图3)。

图3最大自然法构建的基于16SrRNA基因序列的12-1菌株系统进化树(自展值>50%显示)
Fig.3 Phylogenetic tree by the maximum likelihood method based on 16SrRNA gene sequences,showing the relationship of strain 12-1 and related species.Bootstrap values(> 50%)are shown at nodes
MSLA 分析,于NCBI下与12-1菌株亲缘关系近的标准菌株的gyrB、rpoB、atpD和infB基因序列,按顺序拼接,以标准菌株ErwiniaamylovoraLMG 2024T为树根,用软件MEGA5.0构建基于MLSA序列ML系统进化树,在进化树中,本研究的菌种12-1与BS聚成单独的进化枝(自展值均为100%,图4)。MSLA分析结果与16SrRNA基因序列构建的ML树主要分支基本一致。

图4最大自然法构建的gyrB、rpoB、atpD和infB基因序列的12-1菌株系统进化树(自展值>50%显示)
Fig.4 Phylogenetic tree by the maximum likelihood method based on concatenated partialgyrB,rpoB,atpDandinfBgene sequences,showing the relationship of strain 12-1 and related species.Bootstrap values (> 50%) are shown at nodes
2.3 拮抗菌筛选结果
从湿心材发病程度轻微的杨树中共分离得到18株菌株,利用平板对峙法初筛得到对杨树湿心材病原细菌有抑制作用的菌株3株,依次编号为J-4,J-5,J-6 (图5,表5)。用待测细菌滤液经平板对峙法进行筛选,结果滤液对病原细菌均无拮抗作用。将3种拮抗菌分别接种杨树实生苗,发现T4有最严重湿心材症状 (图6)。只接种拮抗菌和只接种培养基的杨树只在接种点伤口愈合处有轻微变色,但接种拮抗菌的杨树苗 (J-4、J-5) 发病程度显著比只接病原菌的低,其中接种J-4的发病程度最轻 (图5)。
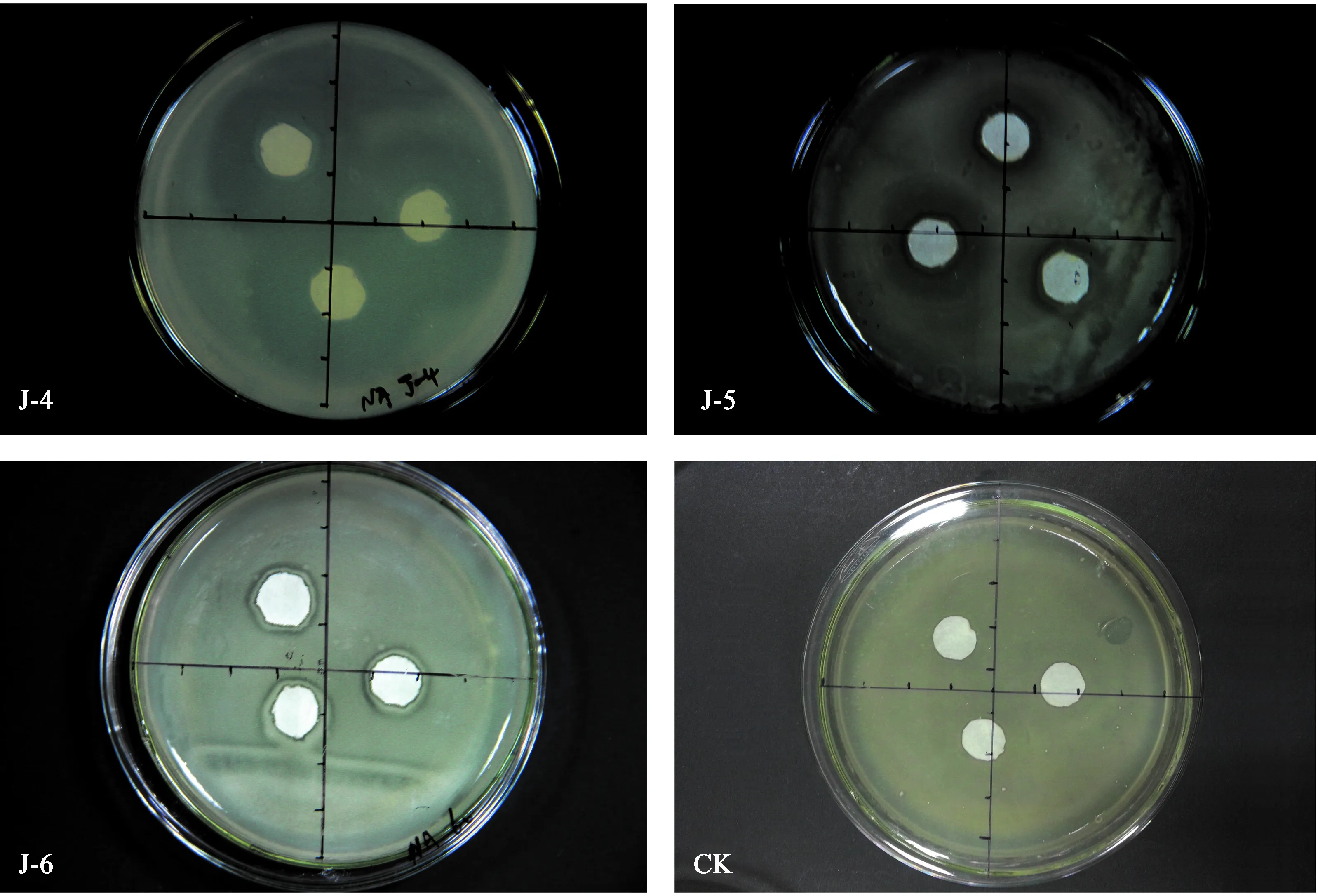
图5拮抗菌对12-1的抑菌效果
Fig.5 Antibacterial effect of antagonistic bacteria on 12-1

表5 拮抗菌对12-1的抑菌圈直径Table 5 The inhibition zone diameter of antagonistic antibacterial against 12-1
注:表中所列抑菌圈的直径为3个重复的平均值。
以病情指数和相对防治效果来衡量拮抗菌田间拮抗效果 (表6)。从筛选结果来看,菌株J-4在实生苗上对12-1致病菌具有较强的抑制作用,其防治效果达72.7%;菌株J-5的防治效果只有31.8%;而菌株J-6在实生苗上对12-1没有明显防治效果 (图6)。

表6 拮抗菌对12-1的防治结果Table 6 Control effect of antagonistic bacteria on 12-1

从左到右依次:1.先接种J-5,24 h后接种病原菌12-1的茎段;2.先接种J-6,24 h后再接种病原菌12-1的茎段;3.先接种J-4,24 h后再接种病原菌12-1的茎段;4.仅接种病原菌12-1的茎段。
图6拮抗菌接种对12-1病菌的防治结果
Fig.6 Effect of antagonistic to 12-1 bacteria on seedlings
2.4 拮抗菌J-4的鉴定
2.4.1形态特征
拮抗菌株J-4在NA培养基上菌落表面平滑湿润、边缘波状,呈灰白色。菌体杆状,可以产芽孢,周生鞭毛,革兰氏染色阴性,属于兼性厌氧菌 (图7)。菌株J-4为革兰氏阴性菌,接触酶反应为阳性,氧化酶反应为阴性,可以在pH 4.5的NA培养基上生长,可以分解淀粉,不产生吲哚。各项生理生化特征和PT生理生化特征一致。
2.4.2生理生化特征
菌株J-4为革兰氏阴性菌,接触酶反应为阳性,氧化酶反应为阴性,可以在pH 4.5的NA培养基上生长,可以分解淀粉,不产生吲哚。各项生理生化特征和PT基本一致。其他生理生化特征见表7。

图7 J-4拮抗菌形态鞭毛特征Fig.7 Morphology and flagellation characteristics of J-4 strain

项目结果J-4结果PT项目结果J-4结果PT接触酶反应++水杨苷++氧化酶反应--D-纤维二糖++pH 4.5生长4.5++D-蜜二糖--淀粉水解++蔗糖++吲哚产生--D-海藻糖++甘油++D-松三糖++核糖醇--D-棉子糖--D-半乳糖--淀粉--D-甘露糖--肝糖--肌醇--葡糖酸盐++苯丙氨酸脱氨酶--脲酶--苦杏仁苷++产生H2S --熊果苷--
注:+表示阳性;-表示阴性。
2.4.316SrRNA基因序列
通过引物PF和PR,以J-4细菌基因组DNA为模板进行PCR,获得大约为1.5 kb的特异性片段。序列测定结果表明,片断长度为1 423 bp,其序列见GenBank登陆序列号KR492891。
通过EzBioCloud网站 (http://eztaxon-e.ezbiocloud.net/) 的EzTaxon-e序列比较,比较菌株J-4与其他已知细菌标准菌株的16SrRNA序列同源性,结果显示J-4和Paenibacillus属的PT同源性最高,达到99.37%,与其他标准菌株的同源性低于97%。
从NCBI上下载与J-4近缘种标准菌株的16SrRNA序列,用软件MEGA 5.0构建基于这些序列的NJ和ML系统进化树,序列大小为1 500 bp左右,所打节点通过1 000次不同取样进行了验证,以标准菌株P.kobensisNBRC 15729T为树根。从构建的系统发树的结果来看,基于16SrRNA基因序列构建的NJ和J4ML树的主要分支枝基本一致。在这2个进化树中,本研究的菌种J-4与PT聚成单独的进化枝(自展值均为100%,图8~9)。
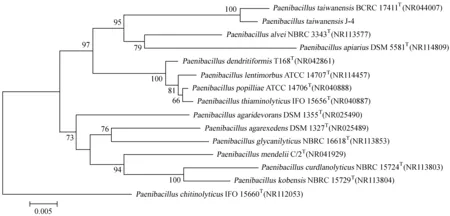
1 000次自举检验,自展值50%以上显示。除本研究的序列外,其他菌株的基因序列均来自GenBank。
图8相邻法构建的基于16SrRNA基因序列的J-4系统进化树
Fig.8 Neighbor-Joining method tree based on 16SrRNA gene sequences,showing the relationship of strain J-4 and related species

1 000次自举检验,自展值50%以上显示。除本研究的序列外,其他菌株的基因序列均来自于GenBank。
图9最大自然法构建的基于16SrRNA基因序列的J-4系统进化树
Fig.9 Maximum likelihood method tree based on 16SrRNA gene sequences,showing the relationship of strain J-4 and related species
3 结论与讨论
将从杨树湿心材组织分离出的10株优势菌株回接实生苗,结果表明12-1菌株具有强致病性,被侵染植株出现典型湿心材症状。综合形态特征,生理生化指标分析,全细胞脂肪酸分析,16SrRNA序列分析以及多基因序列分析的方法,鉴定12-1致病菌为杨柳欧文氏杆菌,与郑华英等[10]研究中分离出的细菌同属一个种。研究发现,杨柳欧文氏杆菌在柳树体内达到一定浓度时可引发柳树水痕病病害,也有该病菌可以侵染柳树 (Salix)、杨树以及桤木 (Alnuscremastogyne) 等多种树木引发病害的报道[15-16]。李永[14]在欧美杨 (Populus×canadensis) 内分离到优势菌株杨柳欧文氏杆菌 (Brenneriasalicis),迟淼[17]在分离杨树内生菌时也分离到杨柳欧文氏杆菌,但并没有进一步研究该菌的致病性,也未对该细菌进行系统的分子鉴定。本研究观察到的杨树发病情况及发病规律与其他研究中杨柳欧文氏杆菌引发病害的规律基本一致。病细菌的系统鉴定结果为该病害的有效防控奠定了基础。关于导致杨树湿心材的该病菌以何种途径传播,病原菌致病机理以及病原菌与杨树植株间的互作机理尚有待进一步研究。
从植物体内筛选的拮抗菌株,在植物体内具有很好的定殖能力,是植病生物防治的一类极具应用潜能的新资源微生物。内生拮抗细菌在一些植物病害生物防治方面已有大量成功实例,如在香蕉 (Musanana) 内叶面喷洒荧光假单胞菌 (Pseudomonasfluorescens) 和枯草芽孢杆菌 (Bacillussubtilis) 株混合制剂,不仅能够降低香蕉束顶病的发病率,也能提高植株生长速率[18]。Brooks等[19]通过室内接种从橡树 (Heveabrasiliensis) 中分离到的内生细菌脱氮杆菌 (Bacillusdenitrificans),大大降低了栎枯萎病发病率。利用植物内生细菌也是林木防病治病切实可行的方法,国内外学者对杨树内生细菌也开展了部分研究,胥丽娜[20]从杨树组织块中分离得到37株内生细菌,经筛选得到几株对杨树水泡溃疡病菌具有较好拮抗作用的拮抗菌。国外学者在分离杨树内生菌时也获得了一些内生细菌菌株,发现一些菌株可以固定碳源和促进植物新陈代谢[21-22],但目前尚没有涉及利用杨树内生细菌防治杨树湿心材病的研究。在杨树中筛选出对湿心材致病菌有拮抗作用的内生细菌,不仅对杨树湿心材病的研究和防治有着直接的意义,也将对其他树种以及其他植物病害的防治有重要的指导意义。
本研究从杨树湿心材组织分离并纯化出致病菌杨柳欧文氏杆菌,为该病害的有效防控奠定了基础。同时,从杨树心材中分离的菌株J-4表现出对杨树湿心材具有较强的抑制作用,防治效果高达72.7%。经生理生化鉴定和16SrRNA序列分析,初步确定这株对杨树湿心材病原菌菌拮抗作用的内生细菌为类芽孢杆菌,这是首次报道该菌对湿心材病原菌具有拮抗作用,这对于生防菌在杨树湿心材生物防治中的实际应用具有重要意义。

