结肠癌组织SGK3的表达及临床意义
宋泰宁,贾喜花,王静苗,李卫奇
(1.承德医学院,河北承德 067000;2.保定市第一中心医院)
结肠癌组织SGK3的表达及临床意义
宋泰宁1,贾喜花2△,王静苗2,李卫奇2
(1.承德医学院,河北承德 067000;2.保定市第一中心医院)
目的:探讨结肠癌组织血清/糖皮质激素调节蛋白激酶-3(serum/glucocorticoid regulated kinase 3,SGK3)的表达及临床意义。方法:采用免疫组化SP法检测70例结肠癌组织和30例癌旁正常组织中SGK3的表达情况,并分析SGK3表达与结肠癌临床病理特征的关系。结果:结肠癌组织SGK3的阳性表达率为74.3%(52/70),明显高于癌旁正常组织[16.7%(5/30),P<0.05]。结肠癌组织SGK3表达与年龄、性别、肿瘤大小、分化程度无关(P>0.05);与肿瘤TNM分期、浸润深度、淋巴结转移有关(P<0.05)。结论:SGK3在结肠癌组织中呈高表达,提示SGK3可能参与了结肠癌的发生、发展过程,且可能与结肠癌不良预后有关。
SGK3;结肠癌;免疫组织化学
结肠癌是危害人类健康的常见消化道恶性肿瘤。随着我国人民生活水平的提高,结肠癌的发病率不断升高。近年来针对肿瘤的综合治疗水平在不断提升,但并不能有效遏制结肠癌的进展过程,结肠癌的死亡率仍居高不下。因此,探究结肠癌发生发展的分子机制,寻找预测其生物学行为的标志物对于结肠癌的预后判断及发现潜在的药物作用靶点具有重要意义[1]。血清/糖皮质激素调节蛋白激酶-3(serum/glucocorticoid regulated kinase 3,SGK3)是近年来发现的SGK家族新成员,与AKT具有同源性,且多种肿瘤细胞系均表现出SGK3依赖性[2]。已有研究证实,SGK3是PI3K信号通路下游信号分子,在PI3K突变所致的肿瘤发生中发挥至关重要的作用[3]。本研究采用免疫组化法检测了结肠癌组织中SGK3的表达情况,以期为进一步研究结肠癌的发生、发展机制及预后判断提供理论依据。
1 资料与方法
1.1 标本来源 收集2014年1月至2016年12月保定市第一中心医院经病理诊断证实为原发结肠腺癌的手术切除组织70例。男性38例,女性32例;年龄28岁~83岁,中位年龄63岁;组织学分级:高分化25例,中分化30例,低分化15例;淋巴结转移:有转移25例,无转移45例。按2010年AJCC和UICC修订的TNM分期:Ⅰ期~Ⅱ期23例,Ⅲ期~Ⅳ期47例。患者术前均未行放、化疗等各种治疗,病历资料完整。另选择同期30例距肿瘤边缘>5cm的癌旁组织标本作为对照。
1.2 试剂来源 兔抗人SGK3抗体购自GeneTex公司,通用免疫组化SP试剂盒和DAB显色试剂购自上海杰浩生物技术有限公司。
1.3 免疫组化染色及结果判定 应用免疫组织化学染色SP二步法,SGK(1:100)阳性染色呈棕黄色颗粒状,主要位于细胞浆。切片在双盲情况下由两名病理科医师观察评价。结果判定按照半定量积分方法[4]:①每例标本随机观察5个(×400)高倍视野,计数阳性细胞数占细胞总数的百分比:阳性细胞数为0计为0分,≤25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;②按染色强度评分:无色计为0分,淡黄色计1分,棕黄色计2分,棕褐色计3分;根据①、②两项积分之和:0分~2分为阴性,3分~7分为阳性。
1.4 统计分析 使用SPSS 19.0版统计软件进行数据分析。计数资料采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 SGK3在结肠癌和癌旁组织中的表达 SGK3在结肠癌组织中的阳性表达率为74.3%(52/70),明显高于癌旁正常组织16.7%(5/30),差异有统计学意义(P<0.05)。
2.2 SGK3表达与结肠癌临床病理特征的关系 结肠癌组织SGK3表达与性别、年龄、肿瘤大小、分化程度无关(P>0.05);与TNM分期、浸润深度、淋巴结转移有关(P<0.05):SGK3阳性表达率TNM分期Ⅲ期、Ⅳ期明显高于Ⅰ期、Ⅱ期,浸润深度T3、T4明显高于T1、T2,有淋巴结转移明显高于无淋巴结转移。见附表:
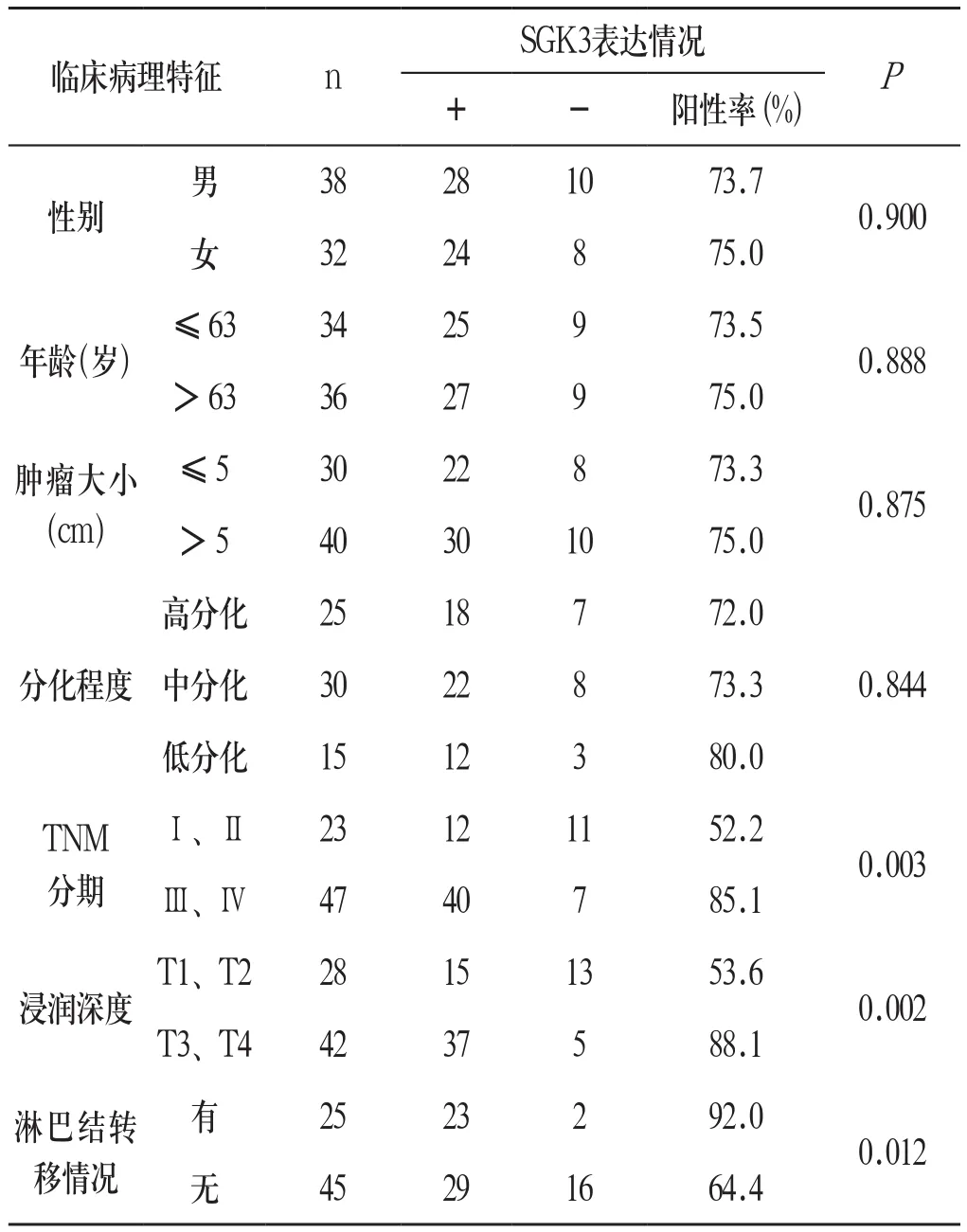
附表 SGK3表达与结肠癌临床病理特征的关系
3 讨论
PI3K/AKT(SGK3)/mTOR信号通路是一条经典的抗凋亡、促存活信号通路,蛋白激酶(SGK)是PI3K信号传导通路的重要成员之一,可能作为细胞磷酸化级联反应的一个功能性交汇点,通过作用于下游底物参与信号通路和细胞应答反应的调节,并且在肿瘤形成、肿瘤细胞浸润或转移及恶性转化过程中起重要作用[5-6]。SGK3是近年发现的SGK家族新成员,几乎在人体所有组织中均有表达,主要参与细胞膜的离子转运及细胞增殖和存活的信号转导[7]。PI3K信号通路中3,4-二磷酸肌醇(PI-3,4-P2)在上游启动基因的作用下形成3-磷酸肌醇(PI-3-P),生成的PI-3-P可进一步上调SGK3的表达,过表达的SGK3通过抑制下游抑癌基因N-myc、调节基因(NDRG1)的表达,进而导致肿瘤的形成,同时还对肿瘤细胞的增殖、转移等恶性生物学行为具有促进作用[7-10](信号通路见附图)。
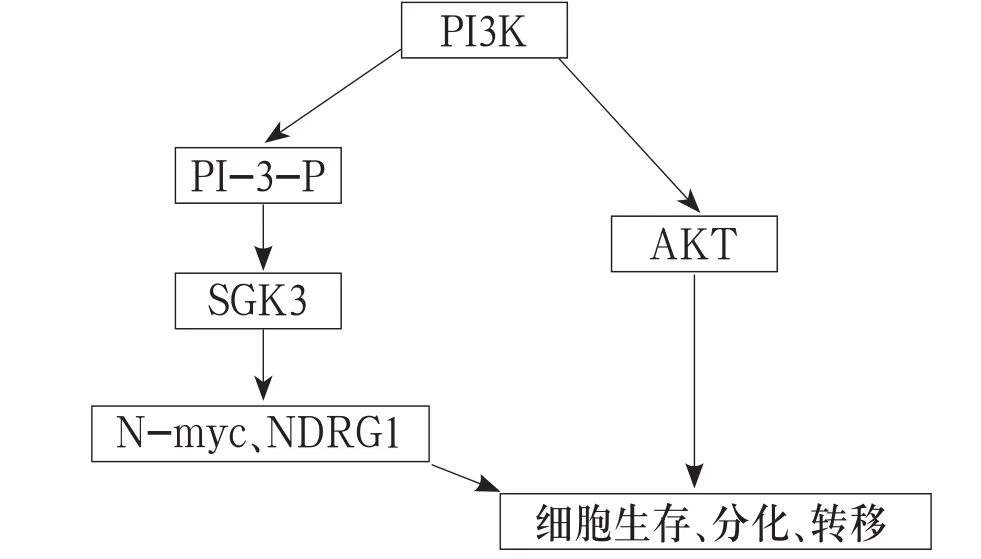
附图 PI3K/AKT(SGK3)/mTOR信号通路示意图
有研究发现,SGK3不仅能作为雄激素受体的靶点促进前列腺癌细胞的增殖,还能促进雌激素受体介导的乳腺癌细胞的存活[2,11];而通过抑制SGK3的活性,可以抑制黑色素瘤细胞的细胞周期,使细胞周期停滞在G1期[7,12];另外,SGK3在卵巢癌和肝癌等多种肿瘤细胞中的表达水平明显高于正常组织,提示其可作为肿瘤的预后标志物和肿瘤治疗的新的分子靶标[13]。上述研究提示,SGK3与多种肿瘤的发生发展有关,但目前国外对于SGK3在结肠癌中的研究较少,而国内对于其在结肠癌中表达情况的研究罕见。本研究采用免疫组化法观察了结肠癌组SGK3的表达情况,发现结肠癌组织SGK3的阳性表达率明显高于癌旁正常组织;并且,结肠癌组织SGK3的表达与TNM分期、浸润深度、淋巴结转移有关,提示SGK3可能参与了结肠癌的发生、发展过程,推测SGK3高表达可能与结肠癌的恶性程度和疾病进展有关。
综上所述,SGK3可能参与了结肠癌的发生发展过程,因此,检测结肠癌组织中SGK3的表达水平对判断结肠癌的恶性程度及患者预后具有一定的临床参考价值。
[1]杨倩,马翔,李华驰,等.基因组学与蛋白质组学在结直肠癌研究中的进展[J].中国临床医师杂志,2013,7(3):1252-1255.
[2]郭红艳,孙晓杰,李淑艳,等.蛋白激酶SGK3与乳腺癌临床病理相关性研究[J].现代预防医学,2016,43(6):1142-1145.
[3]Wang Y, Xu W, Zhou D, et al. Coordinated regulation of serum and glucocorticoid-inducible kinase 3 by a C-terminal hydrophobic motif and Hsp90-Cdc37 chaperone complex[J].J Biol Chem,2014, 289(8): 4815 -4826.
[4]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[5]Lim HJ, Crowe P, Yang JL, et al. Current clinical regulation of PI3K/PTEN/AKT/mTOR signalling in treatment of human cancer[J]. J Cabcer Res Clin Oncol, 2015, 141(4):671-689.
[6]Liu M, Chen L, Chan TH. Serum and glucocorticoid kinase 3 at 8q13.1 promotes cell proliferation and survival in hepatocellular carcinoma[J]. Hepatology, 2012, 55(6):1754-1765.
[7]Gasser JA, Inuzuka H, Lau AW, et al. SGK3 mediates INPP4B-dependent PI3K signaling in breast cancer[J].Mol Cell, 2014,56(4):595-607.
[8]Gewinner C, Wang ZC, Richardson A, et al. Evidence that inositol polyphosphate 4-phosphatase type II is a tumor suppressor that inhibits PI3K signaling[J]. Cancer Cell, 2009, 16(2):115-125.
[9]Hodgson MC, Shao LJ, Frolov A, et al. Decreased expression and androgen regulation of the tumor suppressor gene INPP4B in prostate cancer[J]. Cancer Res, 2011, 71(2): 572-582.
[10]Moniz LS, Vanhaesebroeck B. AKT-ing out: SGK kinases come to the fore[J].Biochem J, 2013, 452(3): e11-e13.
[11]Wang Y, Zhou D, Chen S. SGK3 is an androgen-inducible kinase promoting prostate cancer cell proliferation through activation of p70 S6 kinase and up-regulation of cyclin D1[J]. Mol Cell Endocrinol, 2014, 28(6): 935-948.
[12]Scortegagna M, Lau E, Zhang T, et al. PDK1 and SGK3 Contribute to the Growth of BRAF-Mutant Melanomas and Are Potential Therapeutic Targets[J]. Cancer Res, 2015, 75(7): 1339-1412.
[13]Liu HK, Wang Q, Li Y, et al. Inhibitory effects of γ-tocotrienol on invasion and metastasis of human gastric adenocarcinoma SGC-7901 cells[J]. J Nutr Biochem, 2010, 21(2): 206-213.
EXPRESSION AND CLINICAL SIGNIFICANCE OF SGK3 IN COLON CANCER
SONG Tai-ning, JIA Xi-hua, WANG Jing-miao, et al
(Chengde Medical College, Hebei Chengde 067000, China)
Objective:To investigate the expression and clinical signi fi cance of serum/glucocorticoid regulated kinase 3 (SGK3) in colon cancer.Methods:SP immunohistochemical method was used to detect the expression of SGK3 in 70 cases of colon cancer tissues and 30 cases of adjacent normal tissues; And the relationships between SGK3 expression and pathological features of colon cancer were also analyzed.Results:The SGK3 expression in colon cancer was 74.3% (52/70), which was significantly higher than that in adjacent normal tissue (16.7%, 5/30) (P<0.05). In colon cancer, the SGK3 expression was related to TNM stage, depth of invasion and lymph node metastasis (P<0.05); but was irrelevant to age, gender, tumor size and histopathological differentiation (P>0.05).Conclusions:High expression of SGK3 may participate the development of colon cancer, and maybe related with the poor prognosis of colon cancer.
△ 通讯作者
SGK3; Colon cancer; Immunohistochemistry
R735.3
A
1004-6879(2018)01-0003-03
2017-04-21)

