高效液相色谱-串联质谱法同时测定玉米中AFB1和三种除草剂
■李洪波 宋志超 吴宁鹏* 黄志伟 刘利晓
(1.驻马店市畜牧局,河南驻马店 463000;2.河南省兽药监察所,河南郑州450008)
玉米是全世界产量最高的粮食作物,也是重要的饲料原料。然而玉米在种植、储存和运输过程中极易受到多种霉菌的感染,在适宜的环境中就会产生大量的霉菌毒素,其中最主要的是黄曲霉毒素B1(AFB1)。AFB1是由黄曲霉的多种菌株通过聚酮途径产生的二呋喃香豆素的衍生物。玉米、花生、棉籽以及饼粕最易被AFB1污染,小麦、高粱和甘薯次之,豆粕被AFB1污染的程度较轻[1]。根据联合国粮农组织(Food and Agriculture Organisation,FAO)估计全球约25%的粮食作物被AFB1污染[2]。被广泛污染的食品、饲料等植物性产品已经被世界卫生组织(World Health Organization,WHO)列为食源性疾病的重要根源[3]。高秀芬等(2011)对中国部分地区玉米中4种AF污染调查中发现,所测定的279份玉米样品,AF阳性率为75.63%,阳性样品平均浓度为44.04 μg/kg。四川、湖北、广西、河南、广东和吉林各省样品的阳性率依次为90.48%、93.75%、87.50%、36.96%、91.84%和52.17%。由此可以看出玉米的AF污染比较普遍,且以AFB1为主[4]。AFB1的检测方法种类很多,目前已经建立起来的检测方法主要有:酶联免疫法[5]、薄层色谱、液相色谱法[6-7]和液相色谱串联质谱法[8]。影响玉米质量安全的另一因素是农药残留。为了保证玉米的产量,大量的杀虫剂和除草剂在种植过程中使用,造成的残留问题已引起广泛关注。近年来,我国对农药的需求量显著增加。其中,除草剂的增长率远高于杀虫剂和杀菌剂的发展水平,约占到农药产量比重的1/3[9]。不可否认,除草剂的使用提高了农业生产的效率,但其除草剂残留对农产品和环境的污染也日益严重。目前农药除草剂常用的检测方法主要有:酶联免疫法、色谱分析法和液相色谱串联质谱法[10-12]。国内残留限量中食品安全国家标准规定玉米中AFB1的限量为20 μg/kg,饲料卫生标准规定玉米中AFB1的含量应小于40 μg/kg。我国制定的玉米中甲草胺的最大残留限量为0.2 mg/kg,乙草胺为0.05 mg/kg,丁草胺为0.5 mg/kg;欧盟法规(EC)No1525/98规定AF总量不超过4 μg/kg[13-15]。因此建立同步、高效、高灵敏检测玉米中AFB1和农药残留的新方法对于保障玉米及饲料质量安全具有十分重要的意义。
1 材料和方法
1.1 仪器
Acquit UPLC-Xevo TQ-S质谱联用仪(Waters公司);3-30k台式高速冷冻离心机(Sigma公司);TTLDCⅡ氮吹仪(北京同泰科技发展有限公司);IKAMS3.Basic圆周振荡器(广州仪科实验室技术有限公司);AG125电子天平(梅特勒-托利多仪器有限公司);VX-Ⅲ多管涡旋振荡器(北京踏锦科技有限公司);Plexa固相萃取柱(安捷伦公司)。
1.2 试剂
甲醇、乙腈均为色谱纯(德国默克),甲酸为色谱纯(天津市科密欧化学试剂有限公司),正己烷为分析纯(国药集团化学试剂公司),微孔滤头(上海安谱实验科技股份有限公司),实验用水为经mili-Q净化系统制备的去离子水;对照品:AFB1购于Pribolab公司,甲草胺、乙草胺和丁草胺均购于上海市农药研究所有限公司。
1.3 标准储备液的配制
标准储备液的配制:将AFB1标准物质(标示量1.0 mg)用甲醇转移并定容至10 ml容量瓶中,制成100 μg/ml的标准储备液。精密称取甲草胺、乙草胺和丁草胺各10 mg于100 ml容量瓶中,用甲醇稀释并定容,制成100 μg/ml标准储备液。
混合标准中间液的配制:精密量取AFB1、甲草胺、乙草胺、丁草胺各0.1 ml标准储备液于10 ml容量瓶中,用甲醇稀释、定容,制成1.0 μg/ml混合标准中间液。
以上标准储备液于-20℃避光保存;混合标准中间液于4℃避光保存。
1.4 样品前处理
1.4.1 样品提取
称取制备玉米样品(2.00±0.05)g于50 ml聚四氟乙烯离心管中,加入90%乙腈溶液10 ml,置于超声波中超声20 min,中间振荡两次,取出后6 000 r/min离心5 min,倒出上清液于另一50 ml离心管中。重复提取一次,合并两次上清液,准确量取上清液5 ml于10 ml离心管中,50℃氮气吹至约0.5 ml,加5%甲醇溶液5 ml,涡旋混匀,待净化。
1.4.2 样品净化
Plexa固相萃取柱依次用5 ml甲醇、5 ml水活化,待净化液全部过柱,流速不超过1.0 ml/min,用5 ml 5%甲醇淋洗,吹干。用5 ml甲醇洗脱至10 ml离心管中,洗脱液于50℃氮气吹干,残余物用35%乙腈(含0.1%甲酸)1.0 ml溶解,用流动相稀释5倍后过0.22 μm微孔滤头,供超高效液相色谱质谱联用仪测定。
1.5 方法
1.5.1 色谱条件
流动相:乙腈和0.1%甲酸水,色谱柱:ACQUITY UPLCTM BEH C18(1.7 μm,2.1×100 mm),柱温:35 ℃,流速:0.4 ml/min,进样量:5 μl,梯度洗脱条件见表1。
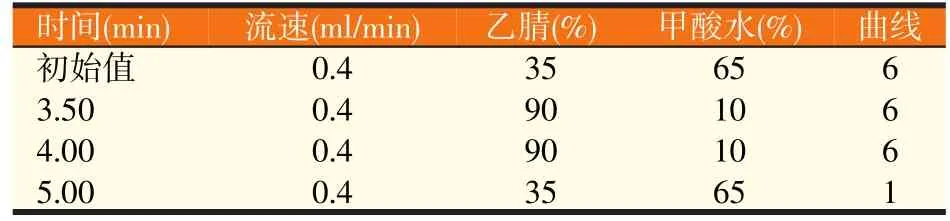
表1 色谱梯度洗脱程序
1.5.2 质谱条件
电离模式:电喷雾正离子模式(ESI+);检测模式:多反应监测(MRM)模式;毛细管电压:0.6 kV;离子源温度:150℃;去溶剂温度:500℃;锥孔气体流速:150 L/Hr;去溶剂气体流速:1 000 L/Hr;碰撞气体流速:0.15 ml/min;监测定性、定量离子对见表2。
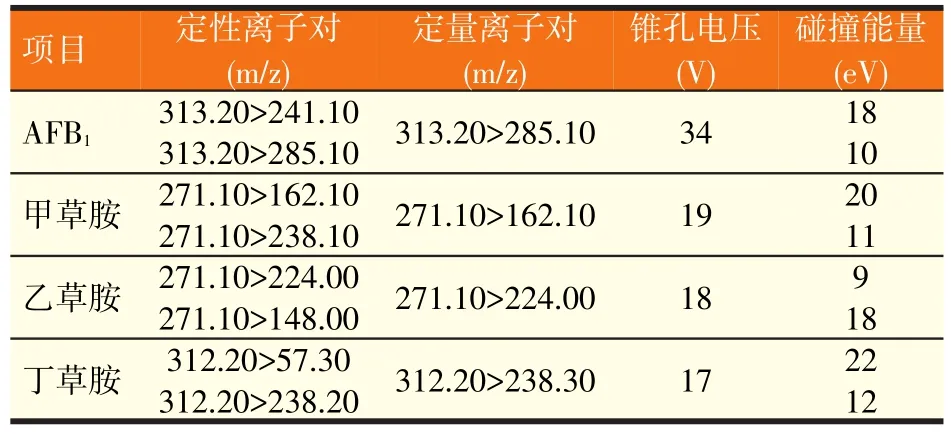
表2 AFB1、甲草胺、乙草胺和丁草胺的监测离子对、锥孔电压和碰撞能量
2 结果与讨论
2.1 色谱质谱条件的优化
根据相关文献[16-17]和AFB1、甲草胺、乙草胺和丁草胺的化合物易结合H+的结构特征,选择ESI+模式进行检测。分别将各组分化合物配制成0.1 μg/ml的混合标准溶液;超高效液相色谱质谱联用仪在待机状态下,用乙腈/0.1%甲酸水(50/50)的流动相、0.4 ml/min流速与10 μl/min流速的0.1 μg/ml的混合标准溶液联合进样。仪器自动调谐,在一级质谱中扫描各组分的母离子,在二级质谱中,母离子在碰撞池经高纯氩气碰撞后生成不同质荷比的子离子,并优化毛细管电压、锥孔电压、碰撞能量等参数。得到子离子中,选择两个丰度较大的子离子作为定性离子;在两个定性离子中选择丰度最大的一个作为定量离子。从而确定质谱条件和调谐参数。
超高效液相色谱质谱中的ESI+模式对流动相要求较高,流动相不仅影响各组分的相对保留时间和峰形,还影响各组分的质子化效率。因此应选择合理的流动相组成,配合最佳的梯度洗脱程序,从而提高各组分的响应值和分离度。为提高各组分的质子化效率,固定水相中加入0.1%甲酸。由于各组分在不同的通道,因此本文不将流动相对相对保留时间的影响作为考察重点,而重点考察流动相对质子化效率和峰形的影响。有机相分别选择乙腈、甲醇和乙腈/甲醇(50/50),通过试验最终选择乙腈/0.1%甲酸在表1梯度条件下得到的峰形和响应值最好。在此色谱质谱条件下得到的各组分离子流图见图1。
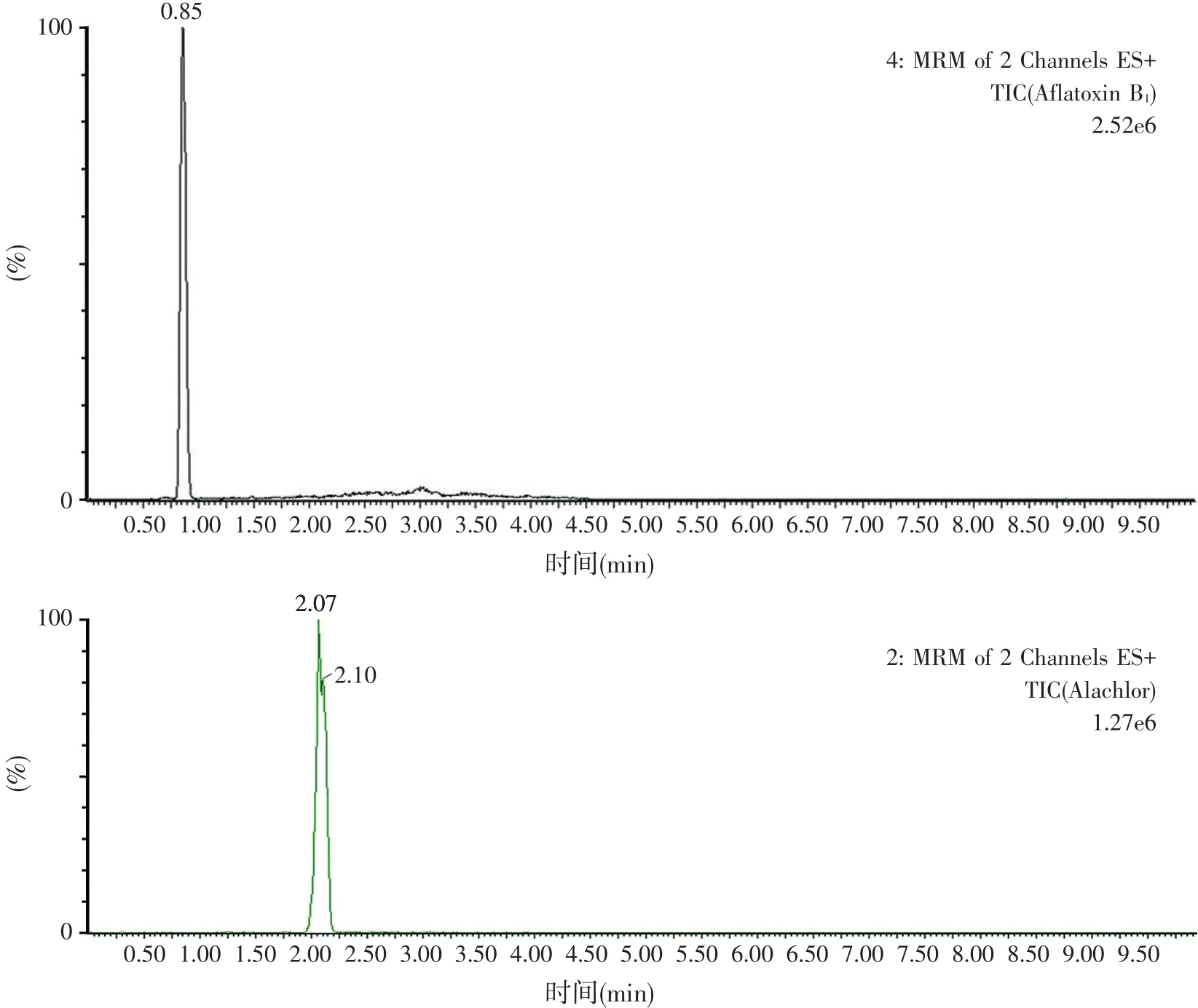
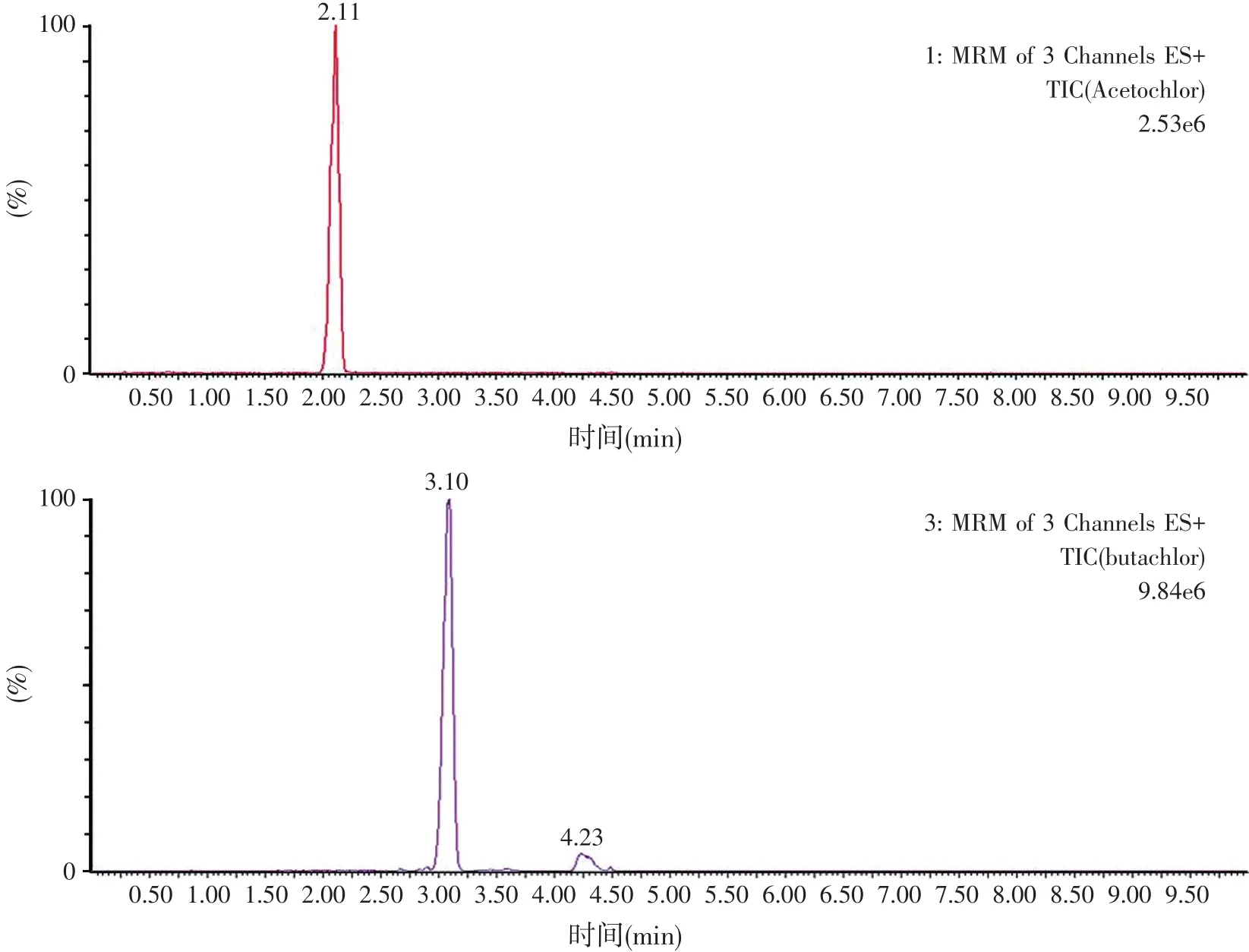
图1 AFB1、甲草胺、乙草胺和丁草胺的离子流图
2.2 前处理条件的优化
根据文献报道[18-19],检测AFB1和甲草胺等农药残留的提取溶剂多为乙腈、甲醇、丙酮等,样品经溶剂提取后固相萃取柱进一步净化。多数文献报道倾向于使用乙腈作为提取溶剂,乙腈不但提取效果好,而且可以沉淀蛋白质等大分子物质,溶出杂质较少,因此选择乙腈作为提取溶剂,为了既保证试验结果的准确可靠,又尽可能减少有机试剂的使用,对不同比例的乙腈水作为溶剂进行考察;本文分别考察了60%乙腈、80%乙腈、90%乙腈和纯乙腈作为提取溶剂的提取效果。由图2可以看出90%乙腈和纯乙腈作为提取溶剂AFB1和甲草胺等农药残留的回收率相对较高,为在保证检测准确度的前提下减少有机试剂的使用,因此确定采用90%乙腈作为提取溶剂。
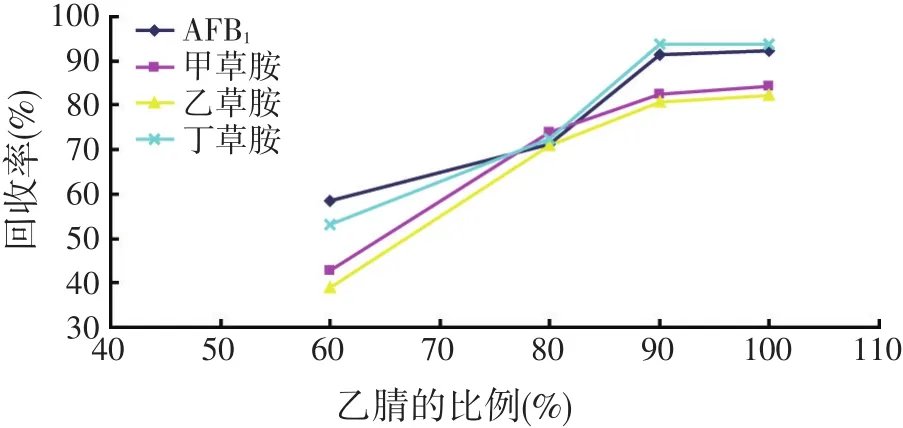
图2 不同比例乙腈水提取后的回收率
根据AFB1、甲草胺等农药的化学性质,选择OasisHLB柱、Cleanert PEP-SPE柱和Bond Elut Plexa作为考察对象,按照各固相萃取小柱的使用说明进行样品净化步骤的操作。以所得样品的回收率为指标考察各固相萃取柱的净化后的效果,结果见图3。由此可见Bond Elut Plexa柱对AFB1、甲草胺等农药残留的净化效果最好。
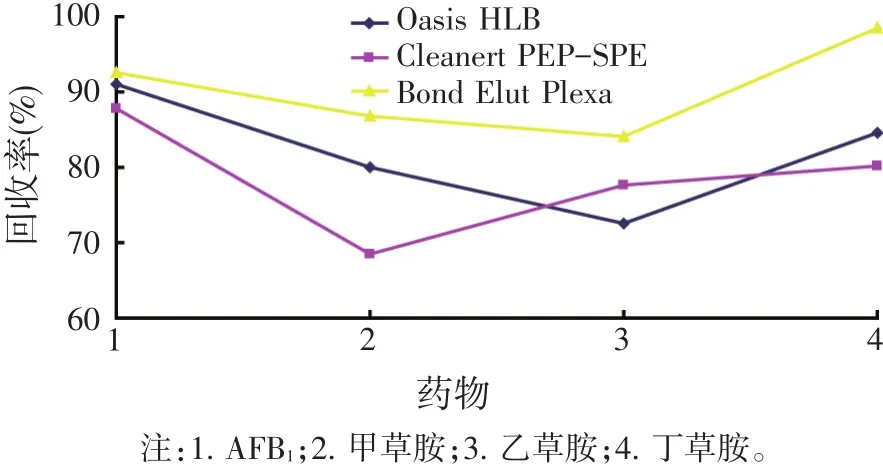
图3 三种固相萃取柱净化后的回收率
2.3 标准曲线与检出限
分别准确量取AFB1、甲草胺、乙草胺、丁草胺标准储备液适量,用35%乙腈(含0.1%甲酸)作为稀释溶液对标准储备液进行稀释,配制成AFB1的浓度为0.2、0.5、1.0、2.0、5.0 ng/ml,丁草胺的浓度为 2、5、10、20、50 ng/ml,甲草胺、乙草胺的浓度为10、20、50、100、200 ng/ml的系列标准溶液,依次进行测定,以得到的峰面积为纵坐标,对应标准溶液的浓度为横坐标,绘制标准曲线。
将标准储备液用35%乙腈(含0.1%甲酸)按一定的比例逐级稀释,在“1.5.1”与“1.5.2”所述的色谱质谱条件下测定,计算每个浓度下的信噪比,并由此推算,当S/N=3时样品的浓度即为本方法的检测限(LOD);当S/N=10时样品的浓度即为本方法的定量限(LOQ)。标准曲线及检出限结果见表3,结果表明各目标化合物在所测定的浓度范围内,线性关系良好。
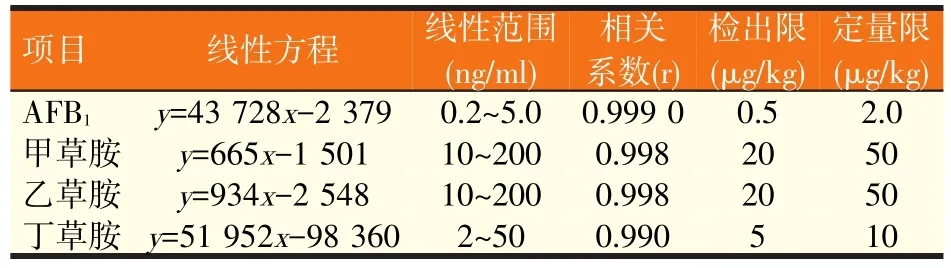
表3 AFB1、甲草胺、乙草胺和丁草胺的线性方程、线性范围、相关系数、检出限和定量限
2.4 方法回收率和精密度
在空白基质样品中添加3个不同浓度水平的标准溶液,按照“1.4”和“1.5”中的试验方法进行提取、净化和测定。每个浓度水平重复5次,计算3个水平的平均回收率和相对标准偏差RSD,结果见表4。由表4可见,AFB1、甲草胺、乙草胺和丁草胺的加标回收率在74.7%~102.1%之间,RSD值在1.2%~4.2%之间。由此可见该实验方法准确可靠,可以满足实际样品检测分析的要求。
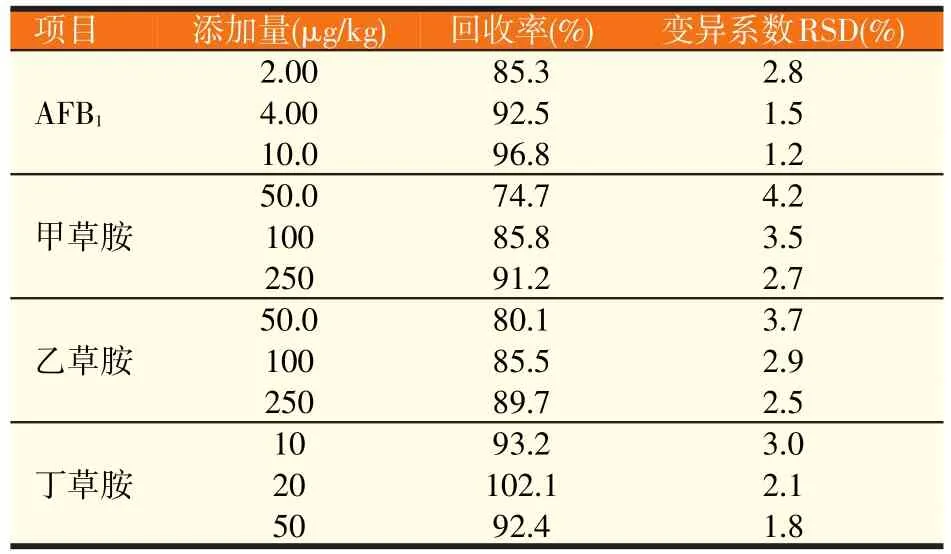
表4 空白玉米样品加标回收率和精密度试验结果(n=5)
2.5 实际样品的测定
利用建立的玉米中AFB1、甲草胺、乙草胺和丁草胺同步检测新方法对从河南省不同饲料企业,不同产地的玉米样品进行检测分析,结果所测定的30批样品中,AFB1检出3批,含量分别为6.8、12.4、51.3 μg/kg;农药残留甲草胺、丁草胺各检出1批,含量均未超定量限,乙草胺全部未检出。由检测结果可知,目前玉米有不同程度的AFB1的污染,受农药残留的影响较小,因此,玉米中AFB1污染问题将成为我们今后关注的焦点,玉米中AFB1污染的防治与检测将是我们以后工作的重点。
3 结论
通过对前处理方法的优化和对色谱质谱条件的优化,建立了液相色谱串联质谱法同步检测AFB1和三种除草剂农药残留的新方法。本方法准确、灵敏、操作简便,可用于玉米中AFB1和三种除草剂的检测,为全面保障玉米产品质量提供新的技术支撑。

