混菌固态发酵豆渣生产酸化饲料工艺条件研究
■侍宝路 王计伟刘春雪 孙海林 王二柱 胡丹丹
(安佑生物科技集团股份有限公司,江苏太仓215437)
在我国豆渣是一种常见的食品副产物,其水分高(80%左右),产量大(2 000万吨/年)[1]。豆渣中富含膳食纤维、微量元素、维生素B1等,是良好的饲料原料[2]。但未经处理的新鲜豆渣适口性差,不易贮存,除少部分作为饲料使用外,大部分豆渣被直接丢弃造成环境污染[3]。通过微生物发酵的方式有效改善新鲜豆渣的适口性,提高其贮藏性能和营养价值,在畜禽养殖中具有现实意义。
有学者通过利用霉菌和酵母菌发酵分解豆渣中的纤维素等多糖生产蛋白饲料[4-6]。辜澜涛等使用乳酸菌、酵母菌和枯草杆菌复合菌剂发酵豆渣,粗蛋白含量由发酵前的19.76%提高为28.06%[7]。张永根等向豆渣中添加乳酸菌和枯草芽孢杆菌,通过优化发酵条件,将其转变为富含有机酸、耐贮存的反刍饲料[8]。张文佳等通过白地霉和产朊假丝酵母混菌发酵豆渣,改善其适口性并提高了贮存性能[9]。
酸化饲料通常是在饲料中添加酸化剂,降低饲料的pH值,在达到防霉效果的同时可以提高饲养效益[10],提高猪尤其是幼龄仔猪的肠道健康[11]。豆渣中含有较高的纤维素,限制了适口性和使用量,关于通过发酵降解豆渣中中性洗涤纤维(NDF)并提高其酸度的研究尚未见报道。因此本试验以豆渣为原料,添加麸皮为辅料,利用乳酸菌和酵母菌发酵改善其适口性并降低物料的pH值,降低NDF含量,将其变成耐贮存、适口性强的酸化饲料,用于提高动物肠道健康。
1 材料与方法
1.1 材料
1.1.1 试验材料
原料:豆渣(来自于江苏省太仓市彬彬豆业食品有限公司)。
辅料:麸皮(购于江苏省太仓市某农贸市场)。
1.1.2 试验菌种
乳酸菌:安佑研究院微生物研究所菌种库乳酸菌5株(编号:X-1、X-2、X-3、X-4、X-5),具有甘油管和固体菌粉制剂两种形式,5种固体菌粉制剂为经生产调配后浓度相同,且活菌数均大于1×109cfu/g。
酿酒酵母:来自安佑研究院微生物研究所,菌粉活菌数大于1×108cfu/g。
1.1.3 培养基
固体培养基:湿豆渣与麸皮按7∶3比例混合后水分约为60%的发酵物料。
MRS液体培养基和MRS琼脂培养基:购自广东环凯微生物科技有限公司。
1.2 试验设计
1.2.1 高产酸乳酸菌株筛选
将5株乳酸菌甘油管接种至MRS肉汤培养基中,在37℃恒温培养箱中静置培养8~10 h,活菌数达到大于109cfu/ml为止。
1.2.1.1 初筛
① 溶钙圈法:将活化好的菌液接种于100 ml MRS液体培养基中,37℃恒温静置培养24 h;使用牛津杯法测量溶钙圈直径大小,牛津杯中加入250 μl菌液[12],每个菌株做3个重复。
②酸碱滴定法[12]:
将活化好的菌液接种于100 ml MRS液体培养基中,恒温静置培养48 h,取1 ml发酵液稀释消除底色干扰,以1%酚酞作指示剂,用0.1 mol/l的NaOH溶液滴定至为微红色,每个菌株做3个重复。酸度以100 ml发酵液消耗的NaOH的摩尔数来表示:

式中:CNaOH——NaOH标准溶液的摩尔浓度(0.1 mol/l);VNaOH——滴定所用的NaOH标准溶液的体积(L)。筛选出钙溶圈较大且酸度较强的3株乳酸菌进入复筛。
1.2.1.2 复筛
进入复筛的乳酸菌菌种,经固态发酵生产工艺调配后浓度相同,且活菌数均大于1×109cfu/g。取一定量固体培养基,分别接种进入复筛的乳酸菌菌粉制剂,接种量均为2‰,混匀后装进发酵袋中,排出空气将袋口扎紧,模拟养殖场的发酵密封条件,36℃发酵72 h,每个处理3个重复,测定发酵后物料中总酸含量,来确定产总酸最多的1株乳酸菌。
1.2.2 乳酸菌与酵母菌混合比例的确定
1.2.3 正交试验设计筛选最佳发酵条件组合
采用乳酸菌和酿酒酵母菌在上述试验中得到的最佳配方比例,选择接种量(A)、含水量(B)、发酵温度(C)、发酵时间(D)为考察因素,每个因素设定3个水平,以发酵产物的活菌数和pH值作为综合考察指标,进行L9(34)正交试验,试验因素和水平见表1。
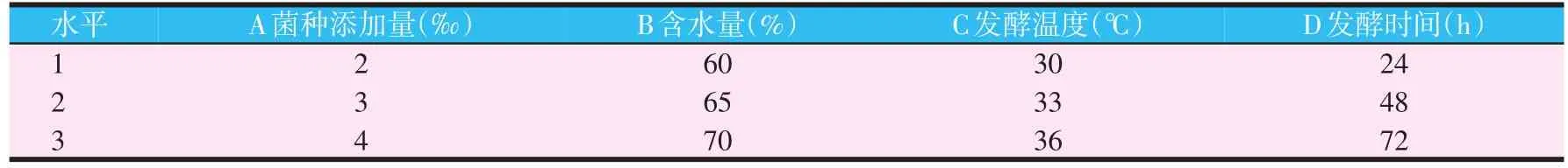
表1 正交试验的因素水平设计
1.2.4 最佳发酵条件下物料的营养成分在发酵前后的变化
通过单因素筛选试验和正交试验得到的最佳发酵条件,在此条件下得到发酵产物,在物料质地、pH值、总酸、粗蛋白质、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量等方面比较发酵前后的变化。
1.3 方法
1.3.1 饲料营养成分的测定
饲料中的水分、总酸和粗蛋白质含量测定分别按照GB/T 6435—2014、GB/T 6432—1994和GB/T 12456—2008方法;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)参照Van Soest等[13]方法进行测定;pH值采用PHS-3C型酸度计直接测定。
1.3.2 活菌数的测定
牙周-牙髓联合病变涉及牙周、牙髓及根尖周组织,三者互相影响且可呈现多种临床表现,其中Ⅰ型牙周-牙髓联合病变主要是由牙髓及根尖周病引起的牙周病变[1-2]。若牙周-牙髓联合病变病程持续时间较长,则易导致牙槽骨缺损;经完善的根管治疗及牙周治疗后,牙周病变可得到明显改善,而牙周组织的破坏能否较好的修复则有待观察[3]。近年来,再生性牙周手术的应用越来越普遍,主要包括引导性组织再生术(Guided tissue regeneration, GTR)及植骨术[4]。本研究对Ⅰ型牙周-牙髓联合病变患牙进行GTR联合骨移植术,以探讨其对牙周组织病变修复治疗的有效性。
乳酸菌总数和酵母菌总数测定分别参照GB 4789.35-2016和GB 4789.15-2016方法。
1.3.3 乳酸菌与酵母菌混合比例的确定
以本试验总酸和ΔNDF含量(NDF降解量)为考察指标,予不同的权重系数,总酸和ΔNDF含量分别为0.5和0.5,再进行加权评分,综合评分(OD)=0.5A/Amax+0.5B/Bmax,(A为总酸含量,B为ΔNDF含量)。
2 结果与分析
2.1 发酵原料的营养成分
发酵原料为新鲜豆渣与麸皮按7∶3比例混合,其常规营养成分如表2所示。
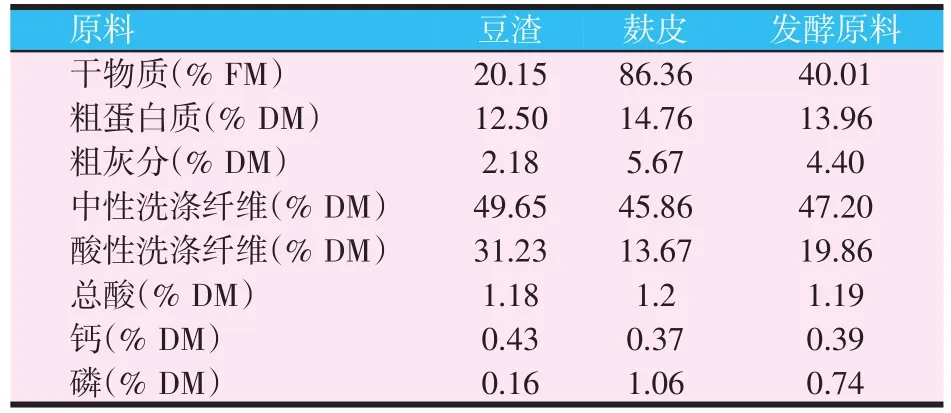
表2 发酵原料的常规营养指标
2.2 高产酸乳酸菌株初筛
对5株乳酸菌进行溶钙圈试验,牛津杯中发酵菌液含有的有机酸和培养过程中乳酸菌生长代谢产生有机酸,渗透到含有1%CaCO3培养基中,形成透明圈。在充足的时间内产酸量不同,形成的溶钙圈大小不同。溶钙圈测量结果如表3所示。
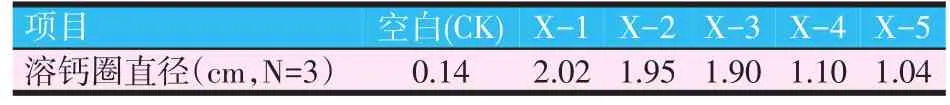
表3 溶钙圈测量结果
采用酸碱滴定法测定5株乳酸菌的发酵酸度,结果见图1。菌株X-1、X-2和X-3的发酵酸度较高,且验证了溶钙圈法结果,因此进入复筛的3株乳酸菌为:X-1>X-2>X-3。
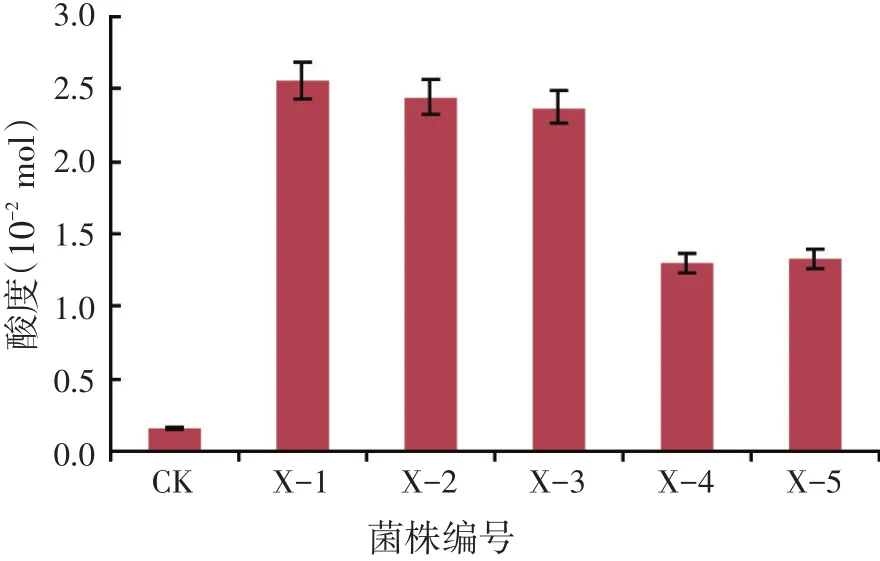
图1 各菌株产酸量
2.3 高产酸乳酸菌株复筛(见表4)
由表4可以看出,以新鲜豆渣为原料,麸皮为辅料,接种进入复筛的乳酸菌,恒温厌氧发酵后,菌株X-2发酵产生总酸最多,因此菌株X-2为本试验产酸量高的乳酸菌株,为植物乳杆菌。

表4 3株乳酸菌发酵豆渣中总酸含量(绝干基计)
2.4 植物乳酸菌与酿酒酵母菌混合比例的确定(见表5)
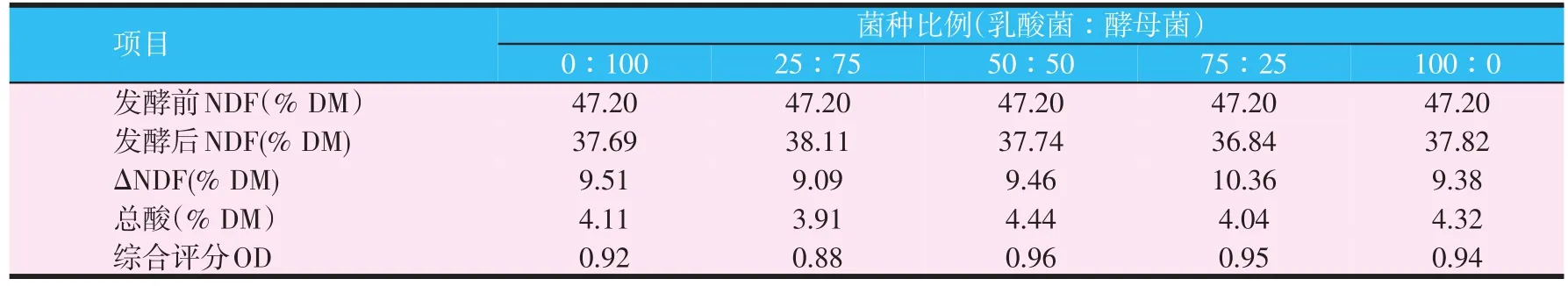
表5 两种菌株以不同比例发酵后综合评分
由表5可以看出,混合比例为50∶50时综合评分OD最高,能够有效降解物料中NDF的同时产生更多的有机酸。
2.5 正交试验结果
选定植物乳杆菌和酿酒酵母菌复合比例为50∶50,按照正交试验设计的因素水平试验,测定各因素水平下活菌数和pH值,其结果见表6。由试验结果可以看出最佳的试验组合为A1B3C3D3,即最佳工艺条件:接种量为2‰,发酵原料含水量为70%,发酵温度为36℃,发酵时间为72 h。
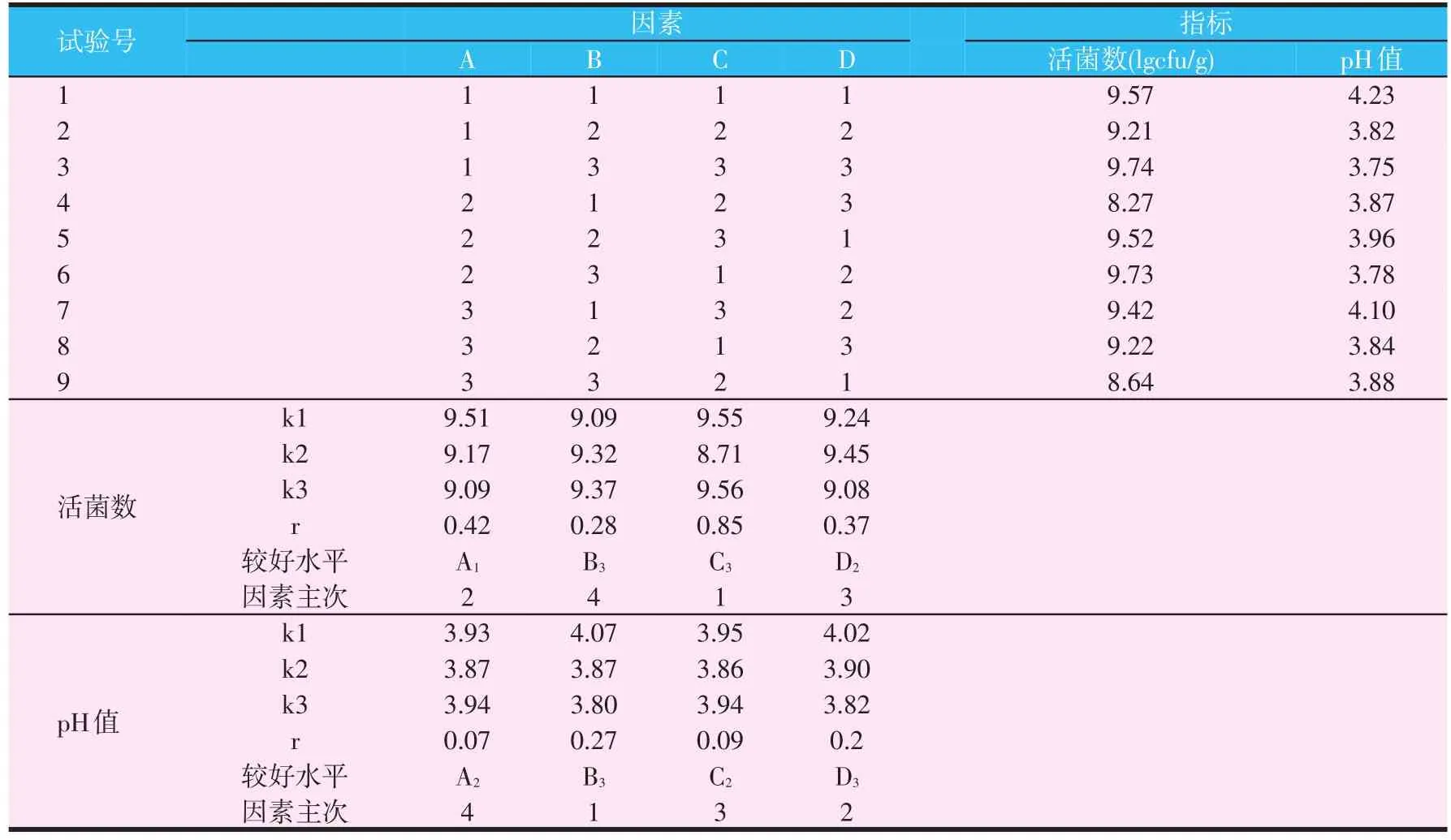
表6 正交试验结果与分析
2.6 发酵前后物料的感官指标和部分营养指标变化(见表7)
由表7可知,物料经发酵后由原来的豆腥味变为发酵酸香气味,NDF含量由49.65%降为36.09%,总酸含量由1.19%增加为3.45%,发酵后物料pH值由6.44降为3.75,适口性大大提高,酸性条件下有利于储存。

表7 发酵前后部分营养参数的比较
3 讨论
3.1 高产酸乳酸菌筛选
由于新鲜豆渣湿度较大,若暴露在空气中,易造成霉菌和一些好氧细菌的生长繁殖,其温度及pH值随之升高,新鲜豆渣开始腐败,影响豆渣的保质期[14]。而在新鲜豆渣中接种乳酸菌,通过密闭厌氧发酵,迅速生长繁殖成为优势菌群,同时产生乳酸、乙酸等有机酸,降低物料的pH值,抑制腐败微生物菌群的生长繁殖,达到保鲜的目的[15]。有研究发现有机酸通过改变致病菌细胞膜电位达到抑菌的效果[16];同时改变有害微生物生存环境的pH值,抑制其生长繁殖[17]。因此,为了延长发酵豆渣的保质期,应筛选出产酸量高的乳酸菌。由试验结果比较5株乳酸菌的产酸能力,以豆渣为发酵基质时,植物乳杆菌为高产酸乳酸菌株。
3.2 植物乳杆菌与酿酒酵母菌混合比例的确定
为了模拟养殖场的厌氧发酵条件,将发酵袋排除空气后扎紧袋口,未经抽真空处理,故在发酵过程中发酵袋并非严格厌氧。植物乳杆菌为耐氧性厌氧菌,微氧环境并不影响它的生长繁殖[18]。酵母菌有氧条件下代谢产生风味有机酸[19]和厌氧条件下产生乙醇,均可改善豆渣的风味。酵母菌拥有丰富的酶系统,能够产生淀粉酶、内生葡聚糖酶、内生糖苷酶、木聚糖酶等。通过两种菌株的混合发酵降低豆渣中的NDF含量,一方面降低物料的pH值,延长保质期;另一方面发酵产生的有机酸、乙醇及一些风味物质明显改善豆渣的适口性,而纤维含量与适口性有很大关系,常用NDF含量来表示[20]。综合评价是根据多项试验结果的重要性,确定每项所占的权重,将多项试验结果化为单项试验结果,以求得其优劣等级的一种评价方法[21]。试验通过发酵后豆渣的NDF降解量和总酸含量的综合评分(OD)来确定最佳的发酵比例。由试验结果可以看出,乳酸菌与酵母菌混合最佳比例为50∶50。
3.3 正交试验结果
对于混菌发酵技术而言,接种量、含水量、发酵时间和发酵温度等因素相互影响,对发酵效果有重要影响。接种量的大小影响着发酵菌种的生长繁殖速度,加大接种量可以使发酵菌短时间内成为优势菌群,减少杂菌污染,提高发酵效果。考虑实际生产成本,为使发酵效益最大化,选择最合适的接种量是发酵的关键。由试验结果可以看出,选取A1为该因素的最佳水平,即最适宜的接种量为2‰。
提高物料的起始含水量,可增加水解酶的产生并促进其扩散;同时提高物料营养物质的利用和减少代谢产物对发酵菌种的抑制作用,有助于发酵菌种的生长代谢[22-23]。本试验结果中显示B3为该因素最佳水平,即发酵原料最佳含水量为70%,与前人研究结果相符。
发酵温度影响微生物生长代谢相关的酶活,影响代谢产物的形成和发酵效果[24],所以要严格控制发酵温度。试验所用酿酒酵母与乳酸菌的最适培养温度不同,由试验结果看出,C3为该因素最佳水平,即发酵温度为36℃。
发酵时间是确定发酵是否可结束的时间点。发酵时间过短,会导致发酵底物未被充分利用,未到达预期效果,发酵时间过长,导致物料损耗过多,发酵成本增加,并增加了发酵物料染菌几率。本试验结果选取D3为该因素的最佳水平,即最佳发酵时间为72 h。
3.4 发酵后部分营养参数的变化
通过正交试验得到最佳发酵条件下的发酵豆渣,产物由原来的豆腥味变为发酵酸香味,且后期随着贮存时间的延长,酿酒酵母持续发酵产生的酒香气味更加浓郁。豆渣经发酵后,NDF含量下降了27%,总酸含量提高了1.9倍,pH值降为3.75。发酵的酸性条件有利于抑制杂菌生长,延长贮存时间,张永根等研究,利用复合乳酸菌和枯草芽孢杆菌发酵豆渣与麸皮混合物,可降低其pH值,延长其贮藏时间[8],与本试验结果一致。
4 结论
本试验采用植物乳杆菌和酿酒酵母菌混合固态发酵豆渣,最佳发酵工艺条件为:接种量2‰,含水量70%,发酵温度36℃,发酵时间72 h。在最佳发酵条件下,发酵底物NDF含量为36.09%,比发酵前下降了27%,总酸含量为3.45%,比发酵前提高了1.9倍,pH值降为3.75,使其成为一种低pH值、耐贮存并有助于提高动物肠道健康的新鲜饲料原料,且此发酵方案在养殖场具有实际操作性。

