发酵羊乳及其抗氧化活性肽的研究
马岚,赵存朝,黄艾祥
(1.云南省泸西县农业环境监测保护站,云南泸西 652499;2.云南农业大学食品科学技术学院,昆明 650201)
0 引 言
山羊乳营养丰富、易于吸收是乳品中的精品,主要营养成分含量均高于牛乳和人乳,其中酪蛋白、氨基酸和低聚糖组成模式接近母乳,具有独特的生物活性性质,是一种理想的牛乳替代品[1-6]。山羊乳营养研究结果再次把山羊乳推荐为“替代牛乳治疗营养不良儿童的有益选择”,其中含有某些生长因子和生物活性物质,而这些物质在牛奶中可能并不存在[7]。近年来,乳及乳制品中的生物活性肽功能被大量研究。生理功能活性肽是从多种食物蛋白质经胃肠消化和食品原料经乳酸菌发酵而产生[8]。许多乳蛋白衍生肽具有抗菌、降血压、抗血栓形成、抗氧化及免疫调节活性[9]。Korhonen等从酶消化的各种食物蛋白质中分离出降压肽或ACE抑制肽[10],Nakamura等利用乳酸菌和酵母菌发酵脱脂乳纯化出ACE抑制肽[11],Gobbetti等经嗜热菌蛋白酶水解山羊β-乳球蛋白纯化出4种新的ACE抑制肽[12];Suetsuna等证明αs-酪蛋白衍生肽具有清除自由基活性并能抑制酶促和非酶促脂质过氧化反应[13];IL Expósito等经胃蛋白酶水解绵羊乳发现4种抗菌肽。更多的研究表明源于山羊乳的抗血栓肽[14]、酪蛋白磷酸肽[15]、阿片类活性肽[16]等受到人们的极大关注。
酸奶一直被认为是一种功能性食品,除了含营养素外,还含有促进身体功能的成分[17]。酸奶在制作过程中加入活菌,增加酸乳制品的营养质量和风味。益生菌可以通过活菌在体内直接作用,另外,通过活菌细胞代谢产物间接作用,发酵乳中的多肽如酪新素[18]、酪激肽[19]、降血压肽[20]、乳铁蛋白肽[21]、凝血素抑制肽[22]等一些还没被具体鉴定的肽。流行病学和动物实验结果表明:酸奶及其细菌性成分对宿主免疫系统及其疾病控制起到了重要的作用,如免疫刺激特性[23]、肠道疾病[24]、癌症[25]、心血管疾病[26]、乳糖不耐症等[27]。本研究通过筛选高产抗氧化活性肽的乳酸菌,利用响应面法对产肽条件进行优化确定最优产肽参数,进而采用二次通用旋转研制一种高产抗氧化肽的山羊发酵乳,并经体外胃肠道模拟测试山羊发酵乳抗氧化稳定性,同时促进山羊乳资源的开发利用,为抗氧化功能性乳制品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂与菌株
L-谷光甘肽,北京北纳创联生物技术研究院;2,2-联苯基-1-苦基肼基(DPPH)、30%过氧化氢(H2O2)、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),上海晶纯生化科技股份有限公司;胃蛋白酶、胰蛋白酶,索莱宝生物科技有限公司。
CICC 6063嗜热链球菌(Streptococcus thermophilus);CICC 6064瑞士乳杆菌(Lactobacillus helveticus);CICC 20264植物乳杆菌(Lactobacillus plantarum);CICC 20022植物乳杆菌亚种(Lactobacillus plantarum subsp.plantarum);CICC 20241副干酪乳杆菌(Lactobacillus paracasei);CICC 20262干酪乳杆菌(Lactobacillus paracasei);CICC 22150嗜酸乳杆菌(Lactobacillus acidophilus)。
1.1.2 仪器与设备
URA14M 0018分光光度计,上海翱艺仪器有限公司;TGL20M高速冷冻离心机,湖南湘立科学仪器有限公司;SVJ-358智能商用型酸奶机,北京世纪阳光;UL40BC乳成份分析仪,杭州浙大优创科技有限公司;SW-CJ-IF单人双面超净无菌操作台,苏州江东精密仪器有限公司;HPX-9272ME恒温培养箱,上海博讯实业有限公司;GMSX-280压力蒸汽灭菌器,北京市永光明医疗仪器有限公司。
1.2 方法
1.2.1 抗氧化活性肽的提取
取100 mL山羊乳85℃灭菌15 min,冷却至45℃,接种乳酸菌,42℃发酵后4℃冷藏12 h,沸水浴灭酶10 min,4℃ 4 000×g离心10 min,取上清液,4℃冷藏备用。
1.2.2 发酵羊乳菌种筛选
(1)菌种活化分别取适量乳杆菌菌株冻干菌粉接种于10 mL灭苗MRS肉汤培养基中,旋涡混匀于37℃在恒温培养箱中培养24 h得到一代菌悬液。按5%的接种量将一代菌悬液接种于MRS肉汤培养基中,37℃恒温培养24 h得二代菌悬液。重复上述步骤37℃恒湿培养18 h,进行第三次活化得到三代活化菌悬液,4℃冰箱储存备用。
(2)菌种驯化将活化后的乳酸菌接种到山羊乳中训化增殖,依次调整菌种接种量为8%,4%,2%,40℃恒温培养至凝乳,保证菌种活力能在4 h内凝乳。
(3)高产抗氧化肽菌种筛选按3%的接种量分别接种7株乳酸菌于灭菌山羊乳中,以水解度及ABTS自由基清除活性为指标,筛选高产抗氧化肽菌种。
1.2.3 发酵羊乳产抗氧化肽工艺优化
(1)发酵羊乳菌种配比
选取水解度及ABTS自由基清除能力最大的乳酸菌与嗜热链球菌和瑞士乳杆菌以4%的接种量按(1∶1∶1;1∶2∶1;1∶1∶2;2∶1∶1;1∶1∶3))5种配比进行复配,接种发酵后取上清液测定水解度及ABTS自由基清除能力,确定山羊发酵菌种的最佳配比。
(2)发酵羊乳产抗氧化肽的单因素实验
以水解度为评价指标,考察接种量(2%、3%、4%、5%、6%、7%)、发酵时间(6、7、8、9、10、11 h)、后熟时间(4、8、12、16、20、24 h)3个因素对其的影响,确定响应面最佳因素水平。
(3)响应面试验因素水平表
在单因素试验的基础上,利用响应面Box-Behnken试验设计,以水解度为响应值,选取水解度影响较为显著的A接种量、B发酵时间、C后熟时间3个因素,进行3因素3水平的试验设计,优化发酵山羊乳产抗氧化肽的工艺参数。响应面分析因素及水平见表1。

表1 响应面试验分析因素与水平
1.2.4 水解度测定
水解度测定采用甲醛滴定法。
1.2.5 抗氧化活性测定
(1)DPPH·自由基清除能力测定参考等SLin的方法[28]。谷光甘肽作为标准品,绘制标准曲线回归方程 为 :y=0.301x+0.203(0.301~1.81 mg/mL,R2=0.996);y为DPPH自由基清除率,x为谷光甘肽浓度。
(2)还原能力测定参考徐怀德等的方法[29]。谷光甘肽作为标准品,绘制标准曲线回归方程为:y=0.0003x+0.0435(301~1806 mg/mL,R2=0.9986);y为吸光度,x为谷光甘肽浓度。
(3)总抗氧化能力测定(TEAC)参考T Valeriaa等的方法[30]。谷光甘肽作为标准品,绘制标准曲线回归方程为:y=0.004x+0.027(30.1μg/mL~180.6μg/mL,R2=0.996);y为ABTS自由基清除率,x为谷光甘肽浓度。
1.2.6 发酵羊乳的研制
(1)工艺流程
山羊乳100 kg→65℃预热→6~8 MPa均质→85℃杀菌15 min→冷却至45℃→接种发酵剂→灌装→发酵→冷藏→成品
(2)发酵羊乳单因素实验
以感官评分为指标,考察糖添加量(7%、7.5%、8%、8.5%、9%)、淡奶油添加量(1%、1.5%、2%、2.5%、3%)、发酵温度(38、40、42、44、46℃)3个因素对其影响,确定二次通用旋转最佳因素水平。
(3)二次通用旋转试验因素水平表
在单因素试验的基础上,选择糖添加量、淡奶油添加量和发酵时间3个因素,采用二次通用旋转试验设计,进行3因素5水平试验,试验因素水平见表2。
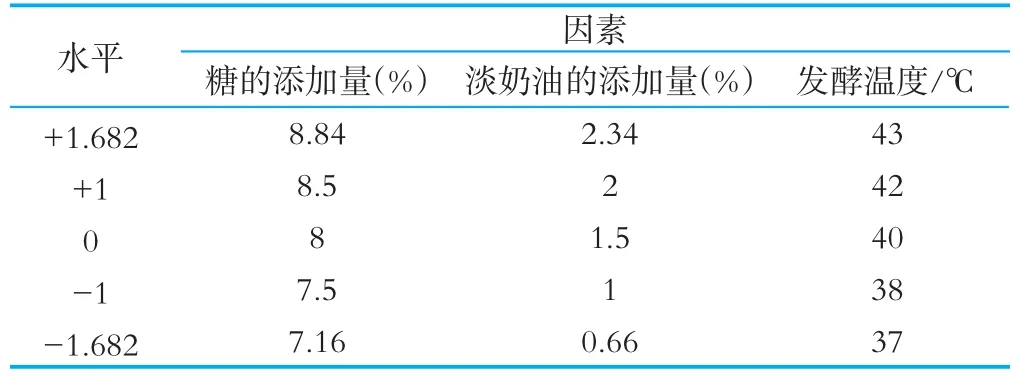
表2 二次通用旋转因素水平表
(4)感官评价
组织15位具有一定专业知识的人员经培训组成评价小组,分别从色泽1分、气味2分、滋味4分及组织状态3分4个方面对山羊发酵乳进行评定,最后得分为15位评分员评分的算术平均值。具体以上感官项目权重的分布见表3。

表3 山羊奶发酵乳的感官评价标准
1.2.7 模拟胃肠道消化
人工模拟肠液的配制:磷酸氢二钾6.89 g,加500 mL蒸馏水溶解,再用0.4 mol/L NaOH溶液将其pH调至6.8,另取胰蛋白酶10 g加适量蒸馏水溶解,将两液混合后,加水定容至1 000 mL。
人工模拟胃液的配制:将23.4 mL浓盐酸加水稀释至100 mL得到稀盐酸,取16.4 mL稀盐酸,加水约800 mL与10 g胃蛋白酶,混匀后加水稀释至1 000 mL。
取山羊奶发酵乳5 mL,4℃4000×g离心10 min,取上清液测定抗氧化活性。山羊奶发酵羊乳p H值调至2.0,然后取1 mL接于含9 mL的人工胃酸试管中,充分混匀后37℃保温2 h,沸水浴加热10 min以终止反应。测定消化前后的抗氧化活性。再将其p H调至6.8,以1∶9的体积比加入至人工肠液中,于37℃恒温水浴中模拟消化2 h,沸水浴加热10 min以终止反应,再取样测定其抗氧化。
2 结果与分析
2.1 发酵羊乳菌种筛选
乳酸菌没有假单胞菌、枯草杆菌、地衣芽胞杆菌等的蛋白水解力,但其对乳制品蛋白水解具有改善制品风味和质地的作用,在干酪成熟中乳酸菌的蛋白水解及菌体破裂后释放的酶发挥着重要作用。由图1可以看出,7株乳酸菌在相同条件下ABTS自由基清除能力及水解度不同,且山羊乳蛋白水解度及ABTS自由基清除能力具有相关性;副干酪乳杆菌具有较强的蛋白水解能力及抗氧化活性,可用于山羊发酵乳的制作。

图1 高产抗氧化肽的山羊发酵乳菌种筛选
2.2 发酵羊乳产抗氧化肽工艺优化
2.2.1 发酵羊乳菌种配比

图2 乳酸菌配比对产抗氧化肽的影响
在酸奶、Mozzarella干酪的发酵过程中、混合菌株间的共生作用让蛋白水解以促进菌株的生长;由图2可知:试验采用传统发酵菌嗜热链球菌、瑞士乳杆菌及筛选的高产抗氧化肽菌株副干酪按不同比例进行复配,发现1∶1∶2的比率能有效促进山羊乳蛋白水解且具有较强的抗氧化活力。
2.2.2 接种量对发酵羊乳产抗氧化肽的影响

图3 乳酸菌接种量对发酵山羊乳产抗氧化肽的影响
如图3所示:随着接种量的增加,水解度呈现先增大后减小的趋势,在接种量为4%处达到最大值。随着接种量的继续增加,水解度反而降低,可能是由于山羊乳中的蛋白难以满足过多菌体生长需求,产酸过多抑制了蛋白的水解;或菌体释放的蛋白酶不利于在强酸条件下作用,活性被抑制。
2.2.3 发酵时间对羊乳产抗氧化肽的影响

图4 发酵时间对山羊乳产抗氧化肽的影响
由图4可以得出:随着发酵时间的延长,山羊乳发酵在不过进行,水解度呈上升趋势,但在发酵9h后,山羊发酵乳水解度趋于平缓;可能是由于随着发酵乳发酵时间延长,羊乳中营养物质不足,抑制了乳酸菌的生长。
2.2.4 发酵羊乳后熟时间对产抗氧化肽的影响

图5 后熟时间对山羊乳产抗氧化肽的影响
由图5可知:随着后熟时间的延长,水解度吴上升趋势,山羊发酵乳的水解度缓慢增加;可能因为随着发酵乳,发酵进行,羊乳中营养物质不足,为保证自身生产需要,乳酸菌菌体内的蛋白酶将多肽讲一步水解,从而表现出水解度缓慢上升。
2.3 响应面优化
2.3.1 响应试验设计及结果
根据单因素试验结果,建立Box-Behnken Design中心组合设计试验模型,通过拟合二次方程计算最优工艺组合以及发酵山羊乳最大理论水解度。选择接种量(X1)、后熟时间(X2)、发酵时间(X3)进行三因素三水平响应面实验,试验结果见表3。
2.3.2 模型建立及显著性检验
利用Design-Expert8.0.6软件对表3进行多元回归拟合,得到山羊发酵乳水解度与菌种添加量/%(X1)、后熟时间(X2)、发酵时间(X3)的二次方程模型为:Y=8.29+0.82X1-0.069X2+0.80X3-0.33X1X2+0.57X1X3+0.092X2X3-1.10X12-0.81X22-0.84X32回归模型的方差分析结果见表4。

表3 响应面分析方案及结果

表4 水解度回归模型方差分析表
由表3方差分析可知:水解度回归模型显著性检验P=0.0001<0.01,说明二次多元回归模型极显著;水解度回归模型失拟性检验P=0.1305>0.05,可以认为所选山羊发酵乳水解度二次回归模型与实际试验拟合性充分模型失拟不显著。山羊发酵乳水解度回归诊断表明,决定系数R2=98.32%,信噪比Adeq precisior=3.16,这表明方程的拟合度和可信度均很高,可用于山羊发酵乳水解度评价。离散系数C.V(Y的变异系数)表示实验本身的精确度,C.V值越小,实验的可靠性越高,水解度拟合C.V值为3.16%。综上所述,回归模型拟合程度良好,试验误差小,能够准确的分析和预测山羊发酵乳水解度,说明实验操作可信度高,具有一定的实践指导意义。由回归系数显著性表明,在所取因素水平范围内,各因素对山羊乳水解度影响的顺序为:接种量>发酵时间>后熟时间。
2.3.3 响应面优化
通过观察图6图7中响应面的变化情况和等高线的稀疏程度可直观地反映山羊发酵乳菌种添加量/%(X1)、后熟时间(X2)、发酵时间(X3)交互作用对水解度的影响,当等高线呈圆形时表示两因素交互作用不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著。

图6 菌种添加量/%(X 1)、后熟时间(X 2)对水解度的影响

图7 后熟时间(X2)、发酵时间(X3)时间对水解度的影响
图6图7为有二次回归方程拟合得到的响应值Y的等高线及三维曲面图,是回归方程的形象描述。由图可知,X1与X2,X1与X3之间交互作用显著(P<0.05),对山羊乳水解度影响较大;由图6可知,山羊发酵乳随后熟时间和菌种添加量的增加而提高后趋近于平缓,后熟时间及添加量为12 h及4%时,山羊发酵乳趋于平缓,与单因素和方差分析结果相符。由图7可知,发酵时间及添加量变化曲面比较陡峭,随着发酵时间及添加量的增加水解度的呈先增长后下降的趋势;交互作用显著与方差分析结果一致。
2.3.4 最佳条件的确定和回归模型的验证
回归模型通过响应面法得到最优山羊发酵乳产肽工艺条件为菌种添加量4.31%,后熟时间10.99 h,发酵时间9.54 h。考虑实际操作情况与设备参数状况,确定山羊发酵乳产肽工艺条件为:菌种添加量4%,后熟时间11 h,发酵时间9.5 h,山羊发酵乳水解度预测值8.69%。在上述最佳条件下进行验证实验,得到山羊发酵乳水解度平均值9.43%,与理论值接近。
2.4 发酵羊乳单因素试验
以感官评分为指标,考察糖添加量、淡奶油添加量、发酵温度个因素对其影响,确定二次通用旋转最佳因素水平,实验结果见图8-图10。
图8-图10为发酵羊乳不同糖的添加量、淡奶油添加量、发酵温度对感官评分影响的单因素试验结果。由图8可知:随着糖的添加量增加,感官评分值呈现先增大后减小的趋势,糖的添加量为8%时山羊发酵乳感官评分值最高为8%;由图9可知:淡奶油添加量增加,感官评分只增加,但超过1.5时山羊发酵乳的独特膻味被掩盖,失去了山羊发酵乳原有风味,故选取最适添加量为1.5%;由图10可知:随着发酵山羊乳温度的增加,感官评分值呈现先增大后减小的趋势,在40℃时,山羊综合感官评分值最优,但超过40℃时,山羊发酵乳不同程度的出现乳清析出,影响感官评分指标,故选取最适温度为40℃。
2.5 发酵羊乳二次通用旋转试验
2.5.1 二次通用旋转试验方案及结果
在单因素试验的基础上,选择糖的添加量、淡奶油添加量(%)和发酵温度(%)3个因素,采用二次通用旋转试验设计,实验结果见表5。
2.5.2 数学模型的建立与检验
二次通用旋转试验方案及结果见表3。利用DPS软件对试验结果进行分析,得到二次回归模型为:Y=7.92216+0.00815X1+0.35746X2+0.01724X3-0.28935X12-0.12848X22+0.04122X32+0.02375X1X2-0.21375X1X3-0.12125X2X3
2.5.3 变量轮换直接寻优
根据已建立的数学模型,在-1.682≤X i≤1.682(i=1,2,3)范围内,每个因素取5个水平(±1.682,±1,0),对53=125个方案进行统计寻优,在试验范围内感官评分最高值为8.59,此时各因素取值为:X1=-1,X2=1.682,X3=1.682,对应着糖的添加量7.5%,淡奶油添加量2.34%,发酵温度43℃。
2.5.4 频率分析及统计寻优

图8 糖的添加量对感官评分的影响

图9 淡奶油添加量对感官评分的影响

图10 发酵油温度对感官评分的影响
对不同设计水平下的组合进行模拟试验,以均值7.66为临界值,获得大于临界值的方案49个,各变量取值的频率分布见表7。
由表7可以看出,在95%的置信区间感官评分值大于7.66的优化方案为:糖的添加量7.3505%~7.6495%,淡奶油添加量为1.057%~1.943%,发酵温度为39.3℃~40.7℃。为了贴近实际的工业化生产,可将优化方案定为:糖的添加量7.5%,淡奶油添加量为1.5%,发酵温度为40℃。
2.6 发酵羊乳在模拟胃肠液中抗氧化的变化
食物进入口腔、食管、胃、十二指肠、小肠、大肠时,胃是主要的消化场所,把大分子物质(主要是糖与蛋白质)分解为小分子;十二指肠也是消化的场所,主要是消化脂类;小肠是最主要的吸收场所,大部分营养都在小肠吸收;大肠是贮存食物残渣的场所,同时吸收少量水分。经人工胃液、人工肠液消化后,发酵羊乳中抗氧化活性变化如表8所示。

表5 二次通用旋转试验方案及结果

表6 回归方程方差分析表

表7 优化提取方案中X i取值频率分布表
由表8可见,山羊发酵乳中含有抗氧化活性肽,且具有较强的抗氧化能力;经模拟胃液和肠液消化试验后,抗氧化活性较消化前有所下降,但下降幅度较小,消化后抗氧化活性依然存在,可见混合发酵菌株产生的活性肽经胃胰蛋白酶水解后,生成的产物仍具有一定的抗氧化活性。
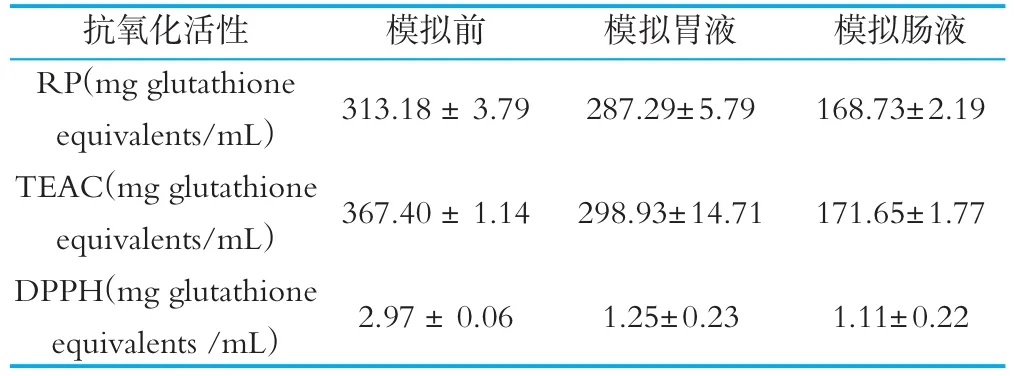
表8 体外模拟胃肠道前后山羊乳多肽抗氧化活性变化
3 结 论
传统发酵菌株保加利亚乳杆菌及与副干酪乳杆菌按1∶1∶2的菌株比例复配,山羊发酵乳水解度较高、ABTS自由基清除活性较强;通过响应面及二次通用旋转旋转试验优化发酵羊乳的最适菌种添加量4%、蔗糖7.5%、淡奶油1.5%、40℃发酵9.5 h、后熟时间11 h。产品色香味俱佳、无明显羊奶膻味,还原能力、总抗氧化、DPPH自由基清除等抗氧化活性较强。发酵羊乳的研究,为特色乳制品的开发提供参考,有利于促进羊乳产业的发展。

