脓毒症患者血常规动态变化及预后相关性分析*
张 怡,宗 媛,武 敏,张 燕,尹贻明,寻 萌
(1.陕西省人民医院重症监护室,西安 710068;2.陕西省人民医院中心实验室,西安 710068;3.西安交通大学医学部基础医学院病原生物学与免疫学系,西安 710061)
脓毒症是指由感染因素作用于机体而继发的全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS),根据器官功能障碍程度、低灌注或低血压、少尿、酸中毒、意识状态等又可进一步发展为严重脓毒症、脓毒症休克和多器官功能障碍综合征(MODS)[1],是重症监护病房(intensive care unit,ICU)最常见的死亡原因,病死率可高达30%~50%[2]。脓毒症发病机制非常复杂且尚未阐明,病情进展凶猛,给临床诊断和治疗工作带来极大困难。因此,迫切需要有效的方法和生物标志物帮助临床医生判断患者的病情变化和预后并给予患者及时合理的治疗,提高患者存活率。本研究回顾性分析脓毒症患者入院及出院或死亡2个时间点的血常规水平,探讨血常规动态变化与脓毒症进展的相关性,评价血常规监测对于评价脓毒症预后的价值。
1 资料与方法
1.1一般资料 选取陕西省人民医院ICU 2016年6月至2017年5月收治的脓毒症患者82例为研究对象。诊断标准符合国际脓毒症会议制定的脓毒症诊断治疗标准[3]。排除标准:人类免疫缺陷病毒感染(血清HIV抗体阳性);口服糖皮质激素类药物超过1个月;入组后24 h内死亡,因各种原因放弃治疗及不同意参加本研究者。
1.2方法 所有患者入科24 h内进行急性生理学与慢性健康状况评分Ⅱ(APSCHEⅡ)及序贯器官衰竭估计评分(SOFA),并于入院当天及出院或死亡当日行血常规检查。采用KX-21血细胞自动分析仪(日本西森美康公司)分析患者静脉血中白细胞计数、中性粒细胞比率、淋巴细胞比率、单核细胞比率、红细胞计数、血红蛋白、红细胞比积和血小板计数。
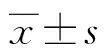
2 结 果
2.1基本资料 患者82例,男59例,女23例,年龄18~96,平均(66.13±18.26)岁,均为汉族。其中一般脓毒症5例,严重脓毒症24例,脓毒症休克53例。平均住院时间(13.23±10.07)d。肺部感染50例,腹腔感染15例,癌症8例,糖尿病5例,外伤3例,中枢神经系统感染1例。54例死亡,28例存活。死亡组及存活组患者临床基本资料在性别、年龄方面差异无统计学意义(P>0.05),但死亡组APSCHEⅡ及SOFA均比存活组高,差异有统计学意义(P<0.05),见表1。

表1 存活组与死亡组临床基本资料比较
2.2入院血常规检测 入院当天行血常规检查,死亡组白细胞、红细胞、血红蛋白均低于存活组,但差异无统计学意义(P>0.05),见表2。
2.3出院或死亡时血常规检测 出院或死亡当日行血常规检查,死亡组淋巴细胞比率、单核细胞比率、红细胞计数、红细胞比积及血小板计数均低于存活组,差异有统计学意义(P<0.05);中性粒细胞比率高于存活组,差异有统计学意义(P<0.05),见表3。
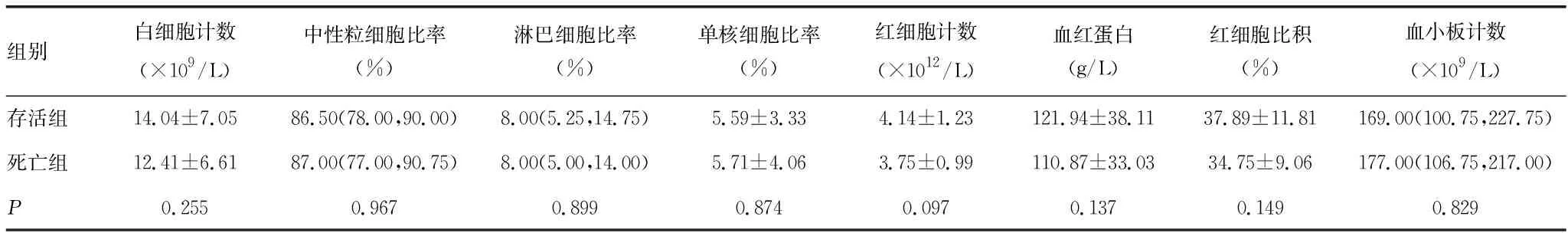
表2 存活组与死亡组入院血常规检测

表3 存活组与死亡组出院或死亡时血常规检测
2.4Logistic回归分析 对死亡与存活病例间有统计学差异的变量进行Logistic回归分析。结果显示:血小板计数是脓毒症患者死亡的独立预测因素(OR=1.010,P=0.000)。
3 讨 论
全世界脓毒症的发病率以每年1.5%~8.0%的速度增加[1]。我国每年大约有300万脓毒症患者,病死率高,花费巨大。目前,治疗方法主要以对症支持为主。因此,寻找有效的生物标志物帮助临床医生判断患者的病情变化和预后,并给予患者及时合理的治疗非常必要。
血常规是临床上最基本及廉价易行的检验项目,主要检测白细胞、红细胞、血小板及血红蛋白等血液有形成分的质和量及形态变化。血液参与机体的代谢及每一项功能活动,在保证机体的新陈代谢、功能调节及人体内外环境平衡等方面发挥重要作用[3]。血液中的任何成分发生病理变化,都会影响全身的组织器官。反之,组织或器官的病变也可引起血液成分发生变化[4]。因此,血液学分析对了解疾病的严重程度有很大的帮助。本研究对脓毒症患者的血常规指标进行了动态观察,Logistic回归分析显示血小板数量减少是脓毒症患者死亡的独立预测因素。
血小板由骨髓造血组织中的巨核细胞产生,定向分化成原始的巨核细胞,又进一步成为成熟的巨核细胞[5]。成熟的巨核细胞膜表面形成许多凹陷,伸入胞质之中,相邻的凹陷细胞膜在凹陷深部相互融合,使巨核细胞部分胞质与母体分开。最后这些被细胞膜包围的与巨核细胞胞质分离开的成分脱离巨核细胞,经过骨髓造血组织中的血窦进入血液循环成为血小板。血小板在凝血过程、血栓形成及机体免疫反应中扮演重要的角色[6-8]。
脓毒症时血小板减少的原因主要有生成减少,破坏或消耗增加及激活的血小板进入外周血黏附血管壁形成微血栓等。脓毒症往往导致骨髓功能严重受损,细菌毒素和炎症因子抑制骨髓中增生活跃的造血细胞,使巨核细胞不能正常分裂增殖、成熟、产生血小板。脓毒症时过度的炎性反应导致血小板过度消耗。细菌及代谢产物通过免疫途径激活补体、破坏血小板。部分患者体内出现抗自身血小板抗体,使血小板破坏增多。另外,弥漫性血管内凝血引起血小板破坏和消耗增多。研究显示在脓毒症的早期,大量炎症物质及病原微生物进入机体,导致血小板过度活化,活化后黏附、聚集和释放,形成微血栓,消耗大量的血小板及凝血物质,最终导致弥漫性血管内凝血的发生,加速脓毒症患者器官功能的损伤[9-10]。另外,肝素类、磺胺类抗菌药物及氯霉素等治疗药物和持续肾脏替代治疗等也可导致血小板减少[11-12]。
脓毒症时血小板数量降低可导致机体凝血功能异常,易发生出血[13]。同时,血小板减少可促进肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6) 等炎症因子的释放,导致机体免疫调节失衡,进而损害宿主的防御功能,加重脓毒症的进展[14]。此外,由于激活的血小板可与中性粒细胞和巨噬细胞等相互作用,发挥清除病原菌的作用,血小板减少可导致机体固有防御的下降,进而增加患者病死率。
因此,在临床脓毒症救治过程中,需要高度重视患者血小板的功能变化,积极采取有效的干预措施,从而提升脓毒症患者的治愈率。2012版严重脓毒症/脓毒性休克治疗指南指出,输注血小板的指导原则来源于专家共识意见和化疗引起的血小板减少症的经验[3]。陈朴等[15]的研究结果显示重组人血小板生成素治疗能够有效促进脓毒症患者血小板计数恢复,减少患者输注浓缩血小板等血制品的数量,降低患者的病死率。
综上所述,本研究回顾性分析脓毒症患者血常规变化水平,发现血小板减少程度与患者死亡之间存在正相关关系,血小板减少是脓毒症患者死亡的独立预测因素。因此,应对脓毒症患者应密切监测其血常规,及时纠正血小板减少,改善患者的预后。

