毛细管电泳对水体中多类抗生素的同时分离检测*
谭 韬,刘应杰,唐 倩,钟文武,兰作平
(1.重庆医药高等专科学校 401331;2.重庆市药物制剂工程技术研究中心 401331)
有报道表明,我国地表水中测出了60余种抗生素[1],其浓度水平与检出频率均高于其他国家。残留抗生素源于生活污水、畜牧养殖废水及粪渣[2]、制药厂[3]和医院废水[4-5]的排放,使得水环境维持低水平抗生素,对水生生物造成远期毒性作用,并使水中微生物群落产生耐药性[6]。自然水体中残留抗生素多为“ng/L”至“μg/L”级别[7]计算,常用固相萃取-高效液相色谱法(SPE-HPLC)[8]、固相萃取-高效相色谱-串联质谱法(SPE-HPLC-MS/MS)[9]等方案进行富集、分离,但存在预处理耗时、昂贵等问题。虽毛细管电泳在灵敏度和重现性略输于HPLC[10],但因其具备抗样品基质干扰能力强、样品预处理简单等优点,已广泛应用于抗生素的分离检测[11-13]。有报道称,中国地表水环境中抗生素检出频率较多的种类有磺胺类(SAs)、喹诺酮类(FQs)、四环素类(TCs)等[1],因此,建立一种同时对自然水体中多类残留抗生素的分离检测方案,对于残留抗生素的快速、全面监控显得十分必要。
本研究经综合对比后,采用了毛细管电泳法中最为稳定的区带电泳技术,用紫外检测器,对缓冲液种类、pH、分离电压及进样方式等电泳条件进行了摸索和优化,实现了自然水体中诺氟沙星(NOR)、氧氟沙星(OFL)、四环素(TC)、土霉素(OTC)、磺胺嘧啶(SDZ)、磺胺甲噁唑(SMZ)等3类6种抗生素的同时分离检测,探讨了缓冲溶液种类对分离、分析的影响。
1 材料与方法
1.1材料 CL 1020高效毛细管电泳仪(配CL 101C型±30 kV可调高压电源、紫外检测器、HW-2000色谱工作站,北京彩陆仪器有限公司,中科院研究生院应化所,中国);熔融石英毛细管柱65 cm×75 μm ,有效长度55 cm(河北永年锐沣色谱器件有限公司,中国);Orion828型pH仪(奥立龙公司,美国);GWA-UN1型超纯水器(北京普析通用仪器有限公司,中国);Discovery DV215CD十万分电子天平(奥豪斯公司,美国)。NOR、OFL、TC、OTC、SDZ、SMZ均为美国Sigma公司产品,纯度大于0.98;四硼酸钠(Na2B4O7,分析纯,重庆博艺化学试剂有限公司,中国);磷酸二氢钾(KH2PO4分析纯,西安化学试剂厂,中国);磷酸二氢钠(NaH2PO4)、磷酸氢钠(Na2HPO4)、磷酸钠(Na3PO4)、柠檬酸、柠檬酸钠等其余试剂的纯度均为分析纯;自然水体采自嘉陵江石门大桥段。
1.2方法
1.2.1缓冲溶液的制备 精密称取Na2B4O7、KH2PO4、NaH2PO4、Na2HPO4、Na3PO4、柠檬酸、柠檬酸钠适量,分别用超纯水溶解制成0.05、0.2、0.2、0.2、0.2、0.2、0.2 mol/L贮备液。根据种类和浓度需要配制运行缓冲溶液,若需调节缓冲溶液pH时,则通过滴加1 mol/L NaOH及磷酸(H3PO4)溶液调节,用pH计精密测量。缓冲溶液使用前用0.22 μm微孔滤膜过滤。
1.2.2对照品贮备液的制备 精密称取NOR、OFL、TC、OTC、SDZ、SMZ对照品适量,用超纯水(已用5 mol/L HCl调节pH至3.0左右)分别稀释制成2.0 mg/mL对照品贮备液。
1.2.3供试品溶液的制备 精密称取NOR、OFL、TC、OTC、SDZ、SMZ对照品适量,用自然水(已用5 mol/L HCl调节pH至3.0左右)分别稀释制成1.0、2.0、2.0、3.0、1.0、1.0 mg/mL的样品贮备液。分别精密量取上述样品贮备液各1 mL于50 mL容量瓶中,加自然水30 mL,用测试用缓冲溶液定容至刻线,摇匀,用0.22 μm微孔滤膜过滤即得。临用前配制,超声处理10 min。
1.2.4电泳条件
1.2.4.1毛细管的处理 毛细管使用前,按顺序用超纯水、甲醇、超纯水冲洗20、20、3 min,再分别用1 mol/L NaOH活化10 min、0.1 mol/L NaOH活化40 min,最后用超纯水、缓冲溶液分别冲洗5、10 min即可。每次进样前都应分别用0.1 mol/L NaOH冲洗5 min,超纯水冲洗3 min,缓冲溶液冲洗5 min。
1.2.4.2优化电泳条件 电动进样25 kV×10 s,分离电压22 kV,操作温度20~22 ℃,优化缓冲溶液为20 mmol/L Na2B4O7+10 mmol/L KH2PO4(pH=8.60),检测波长确定为260 nm。取1.2.3项下供试溶液实验,其分离结果见图1。

图1 最优电泳条件下的供试溶液毛细管电泳图
2 结 果
2.1毛细管电泳分离条件优化
2.1.1检测波长的选择 《中国药典》2015年版记载,SMZ及其制剂定量检测多采用240与254 nm,SDZ及其制剂定量检测多采用260 nm,NOR及其制剂定量检测多采用255~280 nm,OFL及其制剂定量检测多采用290 nm,TC及其制剂定量检测多采用280 nm、OTC及其制剂定量检测多采用280 nm进行检测。为保证待测物质均有较大吸收,本方法采用260 nm为检测波长。
2.1.2进样方法的选择 毛细管电泳的进样方法常有压力进样和电动进样两种方式。相对于样品无差别进样的压力进样方式,电动进样对样品中目标检测品有一定的选择性。当采用压力进样,自然水体中存在的泥沙胶体、腐殖质等小粒径悬浮物也进入进样端,使得检测时基线不稳、毛刺增多,干扰严重。本方法采用了正极端进样,在电动进样方式下,自然水体中的悬浮颗粒受电场影响,进入进样端的量大大降低,可使基线噪声降低、色谱峰峰形变好,能达到在线样品净化效果,降低干扰,提高检测灵敏度和准确度。因此,本方法选择了电动进样方式。
2.1.3缓冲溶液种类、浓度及pH的优化
2.1.3.1缓冲溶液种类的选择 在采用了Na2B4O7-KH2PO4、Na2B4O7-NaH2PO4、Na2B4O7-Na2HPO4、Na3PO4-NaH2PO4、Na3PO4-Na2HPO4、柠檬酸钠-柠檬酸等缓冲溶液体系后,本方案最终选择了Na2B4O7-KH2PO4体系。本研究发现,缓冲溶液种类对毛细管区带电泳的分离效率影响极大,甚至大过缓冲溶液pH的影响。在pH为8.6时,分别以Na2B4O7-KH2PO4、Na2B4O7-NaH2PO4、Na3PO4-NaH2PO4体系为缓冲溶液,并保持近似的缓冲溶液离子强度。结果表明,硼砂体系的分离效率明显优于磷酸钠盐体系,磷酸钾盐体系优于磷酸钠盐体系,如图1、2所示。因此最终选择Na2B4O7-KH2PO4体系为缓冲液。

A:20 mmol/L Na2B4O7+15 mmol/L NaH2PO4;B:20 mmol/L Na3PO4+15 mmol/L NaH2PO4
2.1.3.2缓冲溶液浓度的优化 随着缓冲液Na2B4O7-KH2PO4浓度的增加,样品的出峰时间逐渐推后,并且基线噪音逐渐增大,提示这与缓冲溶液离子强度变大,运行体系电流增加有关系。优化后的缓冲溶液浓度为20 mmol/L Na2B4O7+10 mmol/L KH2PO4。
2.1.3.3缓冲溶液pH的优化 本方法考察了不同pH对组分迁移时间和分离效率的影响,见图3。最终确认缓冲液优化pH为8.60。

图3 20 mmol/L Na2B4O7-10 mmol/L KH2PO4缓冲溶液不同pH对迁移时间的影响
2.1.4分离电压的优化 在分离电压大于25 kV时,SDZ和SMZ、NOR和OFL无法实现良好分离,且毛刺明显增多;分离电压小于18 kV时分离时间超过50 min,组分自然扩散加剧,峰展宽严重。最终的分离电压确定为22 kV。
2.2方法学验证
2.2.1重现性试验 取1.2.2对照品贮备液,按“1.2.4”项下电泳优化条件连续进样测定5次,考察各组分峰面积和迁移时间的相对平均偏差(RSD)。6种抗生素峰面积的RSD为2.5%~4.7%,迁移时间的RSD为0.31%~0.48%,重现性良好,见表1。
2.2.2线性范围 在优化条件下,配制6组不同浓度的6种抗生素的混合标准溶液,各浓度重复进样3次,以峰面积的平均值计算线性方程和相关系数,结果见表1。可见,0.5~40.0 mg/L范围内6种抗生素的线性相关系数大于0.988,线性关系良好。
2.2.3检出限 如表1所示,在优化条件下,根据6种抗生素各为0.5 mg/L的供试溶液的峰高及基线噪音,以信噪比(S/N)≈3计算,6种抗生素的检出限在0.08~0.55 mg/L。
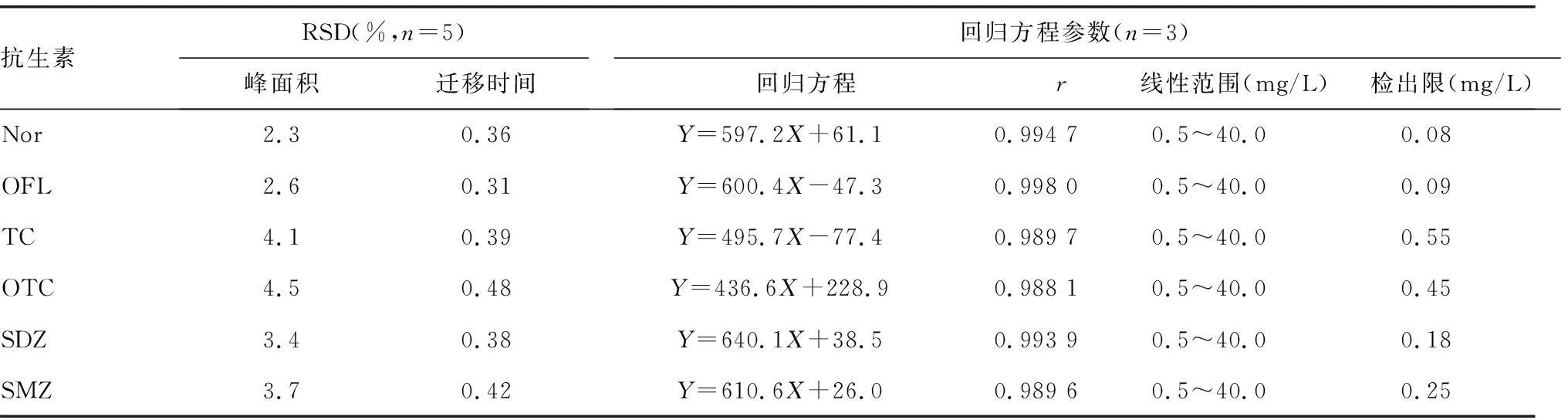
表1 毛细管电泳重现性验证
2.2.4回收率试验 按优化条件,以自然水体为基质,对按“1.2.3”配制的供试溶液中6种抗生素进行了50,100和200 μg/L水平的加标回收率实验,在每个浓度水平进行5次平行测定,得到的加标回收率见表2,数据表明本文所建立的分析方法可靠性较高。

表2 加标样品回收率(n=5)
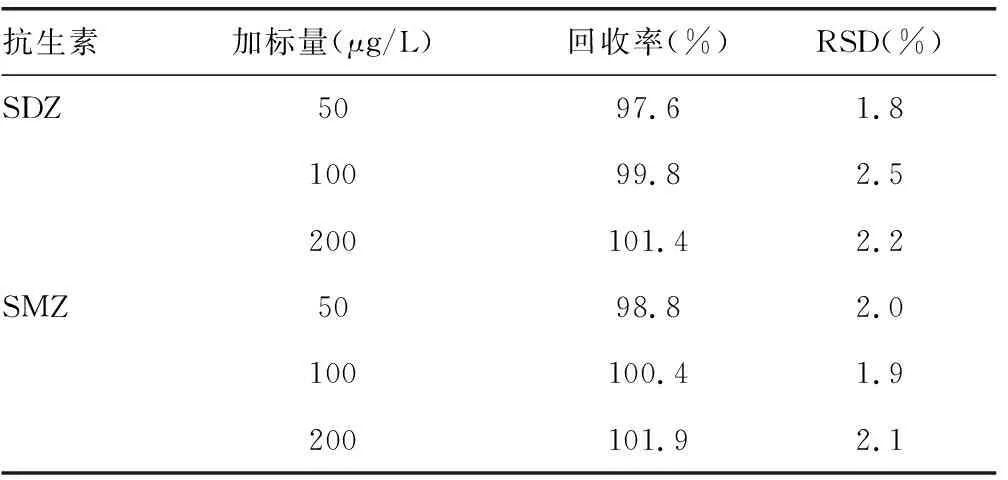
续表2 加标样品回收率(n=5)
3 讨 论
本研究建立了水体中3类6种抗生素的分析方法,考察了缓冲溶液类型、pH、进样方式、分离电压等因素对6种抗生素分离效果的影响。本研究发现缓冲溶液种类的选择对毛细管区带电泳的分离效率影响极大,本方法最终选择了Na2B4O7-KH2PO4体系作为缓冲溶液。已知SMZ的pK=5.69[14],SDZ的pK=6.36[14];NOR的pK1和pK2分别为6.18和8.60[15],OFL的pK1和pK2分别为6.20和8.20[15];TC的pK1、pK2、pK3分别为3.2、7.5、8.9[12],OTC的pK1、pK2、pK3分别为3.3、7.8、9.6[12]。根据各组分pK可知,在pH为6~7的供试品溶液中,各组分应略带正电荷;而自然水体中存在大量的泥沙胶体、腐殖质等粒径小于100 nm的悬浮粒主要带负电荷[16]。基于待测组分和悬浮颗粒电荷的区别,本研究组采用了电动进样方式以正极端进样。在进样时悬浮颗粒受电场的影响,进入进样端的量大大降低,降低了水体中带电悬浮颗粒对分离的干扰,实现了在线的样品净化,使得检测的稳定性、准确度和灵敏度大幅提高。
本方法样品预处理简单,分析时间短,具有明显优势,能够满足自然水环境中残留抗生素的检测要求,为水环境中残留抗生素的监测提供了一种简单可行的方案。

