神经细胞黏附分子阳性初治原发急性髓系白血病临床特点分析
姜艳红,陈光意,盛家和,许青霞
(郑州大学附属肿瘤医院检验科,郑州 450008)
急性髓系白血病(acute myeloid leukemia,AML)是由于造血干细胞发生了染色体畸变、融合基因形成和/或同时存在体细胞突变等异常事件,导致正常造血干细胞的增殖失控、分化受阻及调控异常,从而促使其恶性转化并且无限增殖的一类高度异质性血液系统疾病。神经细胞黏附分子(CD56)抗原是存在于细胞表面的一种糖蛋白,属于免疫球蛋白超基因家族,主要在自然杀伤细胞和部分T 细胞表面上表达,是自然杀伤细胞特异性分化抗原,与细胞黏附有一定关系。有文献报道15%~35% 的AML患者可表达CD56[1]。本文通过对比分析CD56+与CD56-初治原发AML常见临床特征的差异,为AML的诊断分型、治疗选择、随访监测、预后估计及发病机制的探讨提供参考数据。
1 资料与方法
1.1一般资料 收集2015年1月至2016年12月河南省肿瘤医院血液科所有初治原发AML住院患者232例,所有患者经细胞形态学、免疫学、遗传学、分子生物学分析,AML诊断和疗效标准参照WHO[2]和张之南主编的《血液病诊断及疗效标准》[3],排除骨髓增生异常综合征转化型AML、治疗相关AML及其他类型非原发AML和非初治AML患者,最终选出144例资料完整的AML患者纳入本研究。本研究均获得患者知情同意,并经本院医学伦理委员会批准。
1.2方法
1.2.1血常规检查 抽取患者外周静脉血2 mL并用乙二胺四乙酸二钾(EDTA-K2)抗凝,用Sysmex-3000血常规分析仪进行血常规检查。
1.2.2细胞形态学检查 抽取骨髓液制涂片,快速干燥后进行瑞氏染色,根据需要进行特殊细胞化学染色,包括过氧化物酶、碱性磷酸酶、特异性酯酶、非特异性酯酶及糖原染色等,进行形态学分型。
1.2.3免疫学分型检查 抽取骨髓液2 mL并用肝素抗凝,应用流式细胞仪和荧光标记的单克隆抗体检测白血病细胞的表面抗原,并通过计算幼稚细胞抗原的表达比例来确定阳性细胞数;以细胞膜抗原表达大于或等于20%,细胞质抗原表达大于或等于10%为标准,计算抗原的阳性率。
1.2.4细胞遗传学检查 通过骨髓细胞直接法和(或)24 h培养法,按照常规制备染色体,正常核型至少要分析20个分裂象,异常核型至少要分析10个分裂象。核型异常描述依据《人类细胞遗传学国际命名体制(ISCN 2013)》的规定进行[4]。
1.2.5分子生物学检查 通过荧光定量聚合酶链反应(PCR)检测AML1-ETO、PML-RARα、CBFβ/MYH11等13种AML相关融合基因,采用二代测序方法检测NPM1、FLT3-ITD、FLT3-TKD等53种AML相关基因突变。
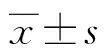
2 结 果
2.1一般临床特点分析 144例初治AML患者,其中男76例,女68例,正常核型59例(40.97%),异常核型85例(59.03%);按照FAB分型标准,M1型11例、M2a型38例、M2b型26例、M3型21例、M4型2例、M5型45例、M6型1例;既往病史包括高血压5例、糖尿病2例、皮肤病1例、胃炎1例、前列腺炎1例、乳腺炎1例、乳腺癌1例、肝炎1例、痛风1列、脑梗死1例、过敏性哮喘1例;根据患者免疫分型检查是否有CD56表达,分为CD56+组与CD56-组,一般临床特点见表1,CD56+组与CD56-组初治原发AML相比较,易出现发热症状,而少见乏力和出血,差异有统计学意义(χ2=4.064,4.704,5.262;P=0.044,0.030,0.022;P<0.05);性别、年龄、既往病史和常见临床症状的面色苍白、肢体疼痛与牙龈受侵在两组中的差异均无统计学意义(P>0.05),见表1。

表1 CD56+与CD56-初治原发AML一般临床特征
a:通过连续校正法计算得出的P值
2.2血细胞常规和骨髓细胞形态分析 骨髓中原始细胞比例,外周血中白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)和血小板(PLT)的量在CD56+和CD56-组间的差异均无统计学意义(P>0.05),见表2。
2.3FAB分型分析 按FAB分型,纳入研究的144例患者中伴CD56+的AML在M1、M2a、M2b、M3、M4、M5和M6组所占比例分别为54.55%、31.58%、61.54%、9.52%、0、26.67%和0;CD56+组与CD56-组初治原发AML相比较,有较高比例的M2b型,较低比例的M3型AML,差异有统计学意义(χ2=11.359、6.272;P=0.001、0.012;P<0.05);而在M1、M2a、M4、M5和M6型AML中的差异均无统计学意义(P>0.05),见表3。
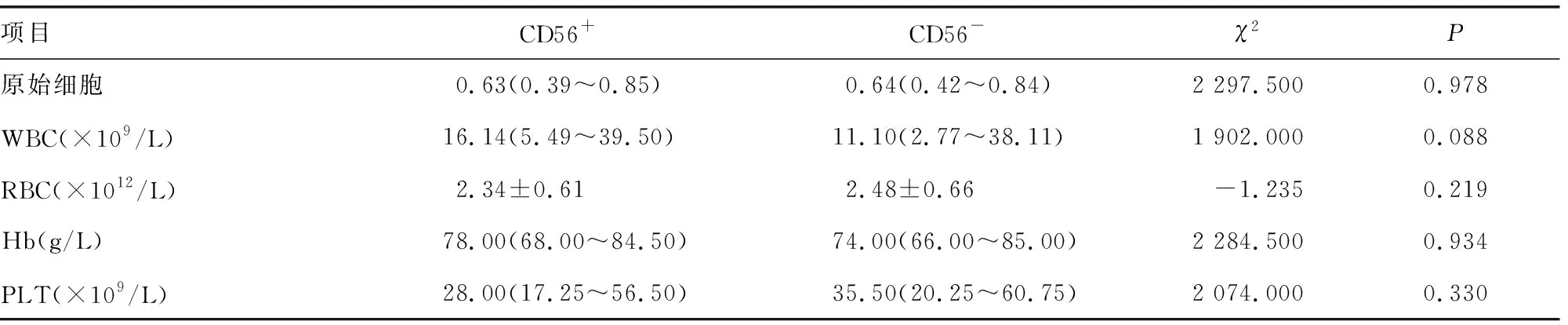
表2 CD56+与CD56-初治原发AML血细胞常规和骨髓细胞形态分析

表3 CD56+与CD56-初治原发AML的FAB分型分析
a:通过连续校正法计算得出的P值,b:通过确切概率法直接计算得出的P值
2.4细胞遗传学分析 染色体核型按对预后影响进行分组,分为预后良好、预后中等和预后不良组,预后不良组按复杂核型和单体核型的有无分组,CD56+组与CD56-组初治原发AML相比较,差异均无统计学意义(均P>0.05),见表4。
2.5融合基因分析 纳入研究的144例患者,检测到的常见融合基因有AML-ETO、PML-RARA、CBFβ-MYH11和MLL-ELL,CD56+AML患者在伴有以上融合基因患者中所占比例分别61.54%、9.52%、0和0;CD56+组与CD56-组初治原发AML相比较,AML-ETO在CD56+组所占比例高于CD56-组,PML-RARA在CD56+组所占比例低于CD56-组,差异均有统计学意义(均P<0.05);而CBFβ-MYH11和MLL-ELL在CD56+组和CD56-组所占比例的差异均无统计学意义(均P>0.05),见表5。

表4 CD56+与CD56-初治原发AML细胞遗传学分析
a:通过连续校正法计算得出的P值
2.6基因突变分析 对144例入选患者进行基因突变检测,共检测到33种突变基因,DNMT3A和IKZF1突变在CD56+组中分别为0例和6例(75.00%),而在CD56-组分别为11例(100.00%)和2例(25.00%),差异有统计学意义(χ2=4.442、4.781;P=0.035、0.029;P<0.05);除去以上2种突变基因,其他31种突变基因在CD56+组和CD56-组组间的差异均无统计学意义(P>0.05),见表6。

表5 CD56+与CD56-初治原发AML融合基因分析

续表5 CD56+与CD56-初治原发AML融合基因分析
a:通过连续校正法计算得出的P值,b:通过确切概率法直接计算得出的P值
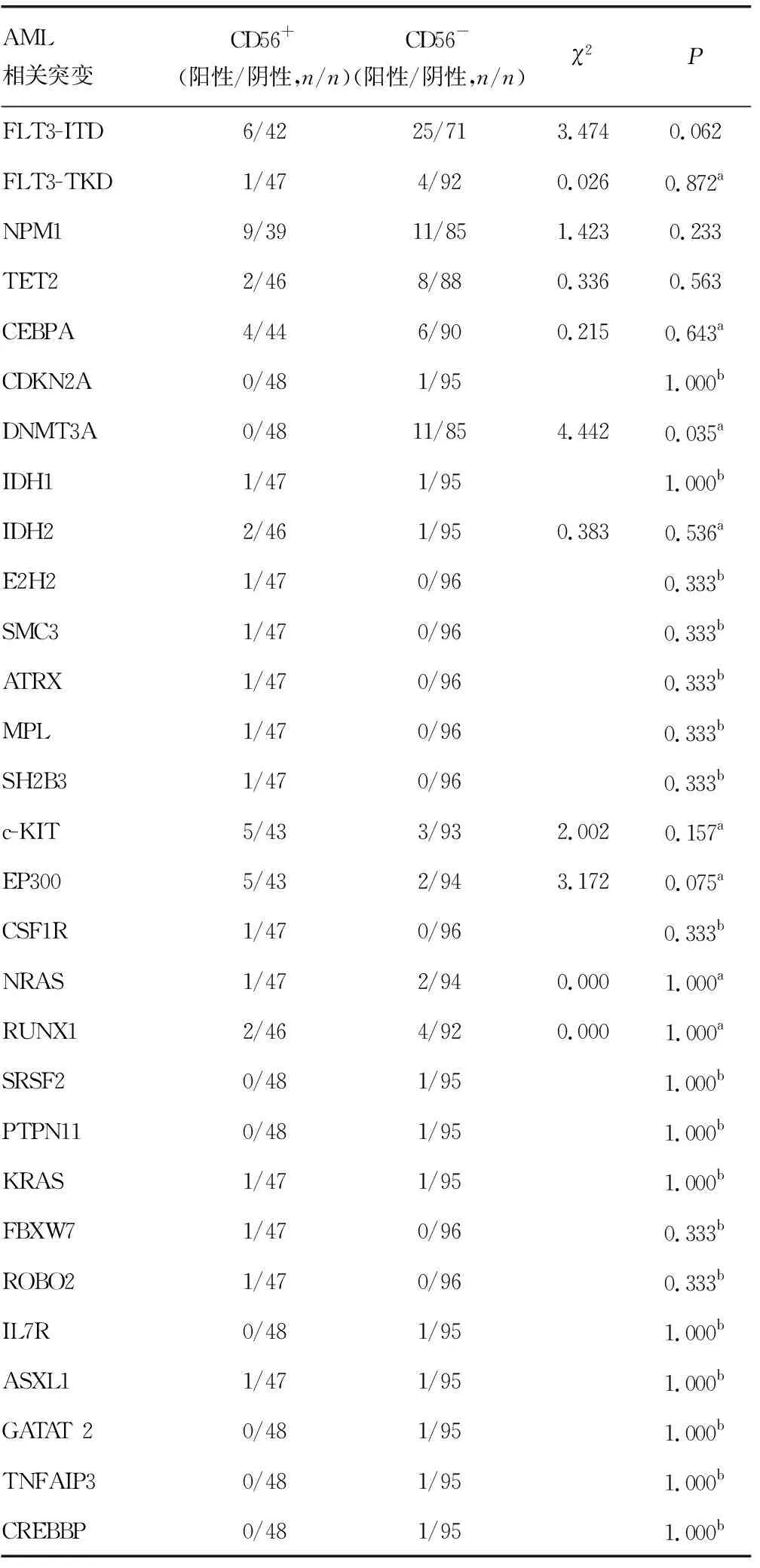
表6 CD56+与CD56-初治原发AML基因突变分析
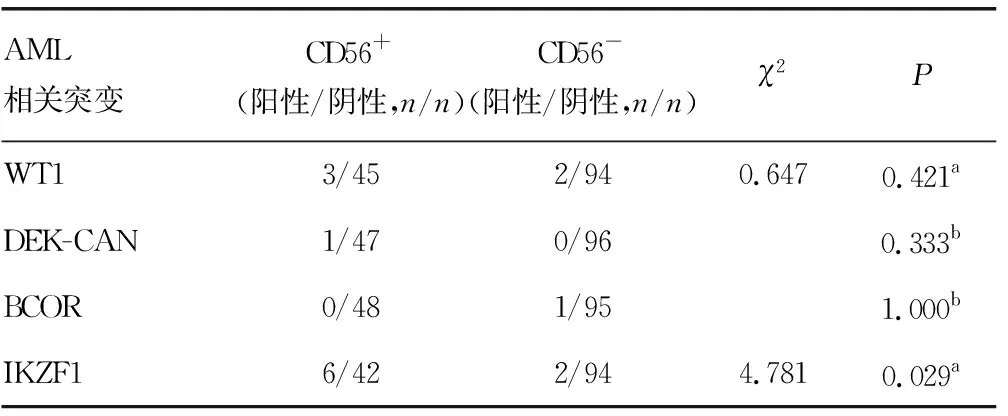
续表6 CD56+与CD56-初治原发AML基因突变分析
a:通过连续校正法计算得出的P值,b:通过确切概率法直接计算得出的P值
3 讨 论
CD56主要在NK细胞和部分T 细胞表面上表达,是NK细胞特异性分化抗原,与细胞黏附有一定关系。有文献报道15%~35%的AML患者可表达CD56[5]。本研究144例AML患者中,有48例伴有CD56表达(33.33%),与文献相符。有研究显示CD56 的表达与AML 患者疗效呈负相关,为预后不良因素[6]。
本研究中CD56+组男性患者所占比例(47.92%)低于女性(52.08%),而CD56-组男性(52.08%)高于女性(44.79%),但差异并无统计学意义(P=0.409),可见伴不伴有CD56表达并不受性别的影响。白血病发病的机制为基因位点改变而导致一些系列特异性基因在本不该表达的情况下被错误地表达出来,而基因位点改变主要受机体内在因素和外界环境因素的影响。患者年龄越大,受到这两种因素影响的机会就越大,那么基因位点的改变的概率就大。本研究发现在不同年龄分组中,CD56+与CD56-患者所占比例差异并无统计学意义(P=0.365)。常见病如高血压、糖尿病、皮肤病、胃炎、前列腺炎、乳腺炎、肝炎等,在CD56+与CD56-组所占比例均较低,且差异无统计学意义(P=0.616),可见既往病史的常见病并不是CD56跨系表达的影响因素。本文中有发热的AML患者在CD56+组所占比例(56.25%)高于CD56-组(38.54%),差异有统计学意义(P=0.044),究其原因,可能是表达CD56的白血病细胞会引起某种内生致热源(EP)的升高而导致发热。贫血常引起乏力,而白血病患者多伴有贫血,患者常感乏力,本研究发现有乏力的AML患者在CD56+组所占比例(27.08%)低于CD56-组(45.83%),差异有统计学意义(P=0.030),可能是由于伴有CD56表达的AML患者贫血较轻的原因,这与本文关于AML患者外周血Hb的分析是一致的(CD56+组Hb有高于CD56-组的趋势,但差异无统计学意义)。面色苍白是贫血的主要表现,虽然CD56+组所占比例低于CD56-组,但差异并无统计学意义(P=0.898),可能是由于本研究病例少,统计量代表性不好。出血是白血病的常见症状,而本文数据显示,出血患者在CD56+组所占比例(10.42%)低于CD56-组(27.08%),差异有统计学意义(P=0.022),这与本文关于AML的FAB分型的分析中CD56-组AML-M3病例所占比例高是一致,M3患者往往伴有出血。白血病患者出现肢体疼痛是骨髓中白血病细胞大量增殖而引起骨髓腔中压力过大造成的,本研究发现,两组间出现肢体疼痛患者所占比例的差异无统计学意义(P=0.055),说明二者的骨髓增生程度没太大差别,这与本文关于骨髓原始细胞比例分析结果是一致的。有研究认为伴CD56表达的AML一般分化较差,容易出现髓外浸润[7]。本文对AML患者有无牙龈受侵进行了分析,并未发现CD56+组和CD56-组存在太大差异(P=0.708),与上述文献不符,但与本文关于AML的FAB分型中AML-M5在两组中所占比例的分析是一致的,AML-M5常常伴有牙龈受侵。
本研究中尽管CD56+组的骨髓原始细胞比例、外周血RBC和PLT的量有低于CD56-组的趋势,而外周血WBC和Hb有高于CD56-组的趋势,但两组间的差异并无统计学意义(均P<0.05),这可能与CD56的生理功能有关,CD56抗原是存在于细胞表面的一种糖蛋白,属于免疫球蛋白超基因家族, 富含聚唾液酸,可形成一种高腺苷酸屏障,降低细胞的黏附力,使肿瘤细胞更易侵袭性生长。可见CD56与AML患者白血病细胞的髓外侵袭性有关,而对骨髓的增殖并无影响,所以CD56+组与CD56-组间骨髓原始细胞比例和外周血WBC、RBC、Hb和PLT的差别不大。
有文献报道15%~35% 的AML 患者可表达CD56,主要在M1、M2、M5 中表达[4];按FAB分型,本文纳入研究的144例患者中伴CD56+的AML在M1、M2(包括M2a和M2b)、M3、M4和M6组所占比例分别为54.55%、43.75%、9.52%、0、26.67%和0,可见CD56在M1中表达最高,其次是M2、M5,与上述文献相符。但通过对AML的FAB分型的各亚型在CD56+组和CD56-组所占的比例进行分析,发现M2b型在CD56+组所占比例高于CD56-组,而M3型在CD56+组所占比例低于CD56-组,差异均有统计学意义(P=0.001、0.012),这与本文关于这两亚型特有的融合基因的分析结果是一致的;而其他亚型在CD56+组和CD56-组所占比例间的差异均无统计学意义(P>0.05)。本研究把染色体核型按照对预后的影响进行分组,分为预后良好、预后中等和预后不良组,预后不良组按有无复杂核型和单体核型进行分组,CD56+组与CD56-组初治原发AML患者各种核型所占比例比较,差异均无统计学意义(P>0.05),与上述文献不符,究其原因,可能是AML的细胞遗传学异常研究的分组标准与本研究的不同所造成的。
IRIYAMA等[8]的研究结果显示伴AML-ETO的AML患者中,CD56表达率约为65%,高于AML其他亚型CD56的平均表达水平,且CD56表达是评估该类AML患者病情复发的独立预后因子[7];MONTESIONS等[9]发现,APL白血病细胞若表达CD56,则患者治疗效果差,无进展生存期较短,总生存期缩短[9]。纳入研究的144例患者,检测到的常见融合基因有AML-ETO、PML-RARA、CBFβ-MYH11和MLL-ELL,CD56+AML患者在伴有以上融合基因患者中所占比例分别61.54%、9.52%、0和0;可见CD56在伴有AML-ETO的AML患者中表达的频率与有学者的研究结果接近。结合本文前面关于AML的FAB分型各亚型的分析,CD56在伴有AML-ETO的AML-M2b患者中表达的频率最高,与有学者的研究结果相符合。但通过统计学分析,CD56+组与CD56-组初治原发AML相比较,AML-ETO在CD56+组所占比例高于CD56-组,PML-RARA在CD56+组所占比例低于CD56-组,差异均有统计学意义(均P<0.05);而CBFβ-MYH11和MLL-ELL在CD56+组和CD56-组所占比例的差异均无统计学意义(均P>0.05),结合前面关于AML的FAB分型,可得出CD56在AML中的跨系表达,易见于伴有重现性遗传学异常的AML-M2b,而少见于伴有重现性遗传学异常的AML-M3。
近年研究证实,DNMT3A(DNAmethyltransferase 3A, DNMT)与实体肿瘤及血液恶性肿瘤的发生、发展密切相关,在白血病细胞株和急性髓系白血病、骨髓增生异常综合征患者中均有异常表达[10]。约11%~35%正常核型AML患者具有该类突变。多项临床研究显示合并DNMT3A基因突变的AML患者预后较差,DNMT3A突变往往与FLT3-ITD/NPM1突变共存在[11]。本文144例患者中,发生DNMT3A突变的有11例,占所有患者的7.64%;正常核型有59例,发生DNMT3A突变的有10例,占正常核型AML的16.95%,与上述文献相符。但这11例DNMT3A突变患者全都不伴有CD56表达,与CD56+组相比较,差异有统计学意义(P=0.035)。IKZF1基因表达于造血干细胞、所有的淋巴细胞及部分髓系细胞。IKZF1突变发生于基因组水平,是ALL发病的一个重要促进因素,也是ALL患者独立的预后不良因素[12]。IKZF1突变在急性髓性白血病中的突变情况鲜有报道,本组资料144例AML患者中,48例伴有CD56表达的患者中有6例发生IKZF1基因突变,而96例不伴有CD56表达的患者中仅有2例发生IKZF1基因突变,两组间差异有统计学意义(P=0.029)。通过以上分析,可以发现伴有CD56表达的AML患者,易见IKZF1基因突变,而较少见DNMT3A基因突变,至于它们之间的相关性,有待于进一步收集更多病例进行分析。
综上所述,与CD56阴性初治原发AML患者相比,CD56阳性AML患者易见发热症状,伴有重现性遗传异常的AML-M2b和IKZF1基因突变;而少见乏力和出血症状,伴有重现性遗传异常的AML-M3和DNMT3A基因突变。

