肺奴卡菌病2例并文献复习
赵璀莲 农光民
肺奴卡菌病是由奴卡菌引起的少见而严重的肺部感染,近年来发病率有上升趋势, 但国内有关肺奴卡菌病的报道还是较少, 尤其鲜见儿童肺奴卡菌病的报道。主要发生于伴有基础疾病以及免疫功能低下者, 免疫功能正常者也可患病。常见临床表现为发热、咳嗽、咳痰, 部分患者伴有胸痛、呼吸困难及体重下降, 肺空洞、结节或实变以及胸腔积液是常见的影像学表现, 呼吸道标本致病菌的培养及鉴定是诊断金标准。治疗主要是TMP-SMX为基础的联合用药。
1 临床资料
病例1:患儿, 男, 2岁8月, 因“咳嗽1月余, 加重伴发热5 d”于2016年8月1日入院, 患儿入院前1个月余无明显诱因下出现咳嗽, 咳时有痰, 无发热, 病后曾在当地医院住院治疗, 肺部CT示两肺炎症, 予阿奇霉素及伊曲康唑抗感染治疗后症状缓解出院, 入院前5 d咳嗽、咳痰症状加重,伴发热, 热峰39.5℃, 再次到当地医院就诊, 行肺部CT示左肺脓肿;诊断:①支气管肺炎;②左侧脓胸;③血小板减少性紫癜;先后给予头孢他啶、头孢硫脒抗感染治疗后仍有发热, 为进一步诊治, 遂至本院就诊。
既往3~5月因“血小板减少性紫癜”间断应用甲强龙。母亲有系统性红斑狼疮(SLE)病史, 孕期一直服用泼尼松治疗。
入院查体:体温(T):37.2℃, 心率(P):130次/min, 呼吸频率(R)50次/min, 血压(BP)150/110 mm Hg(1 mm Hg=0.133 kPa)。神志清楚, 全身浅表淋巴结未触及肿大, 未见鼻扇, 三凹征(-)。无发绀, 胸廓对称, 左下肺叩诊浊音, 双肺呼吸音粗, 左侧呼吸音减弱, 可闻及少许湿啰音。心律齐, 心音有力, 未闻及杂音, 右锁骨中线肋下2 cm可触及肝脏, 剑突下未触及,脾脏肋下未触及。未见杵状指(趾), 四肢无水肿。
辅助检查:血常规:白细胞22.43×109/L, 中性粒细胞百分比0.743, C反应蛋白(CRP)52.68 mg/L, 降钙素原2.320 ng/ml;血沉64 mm/h, 胸部CT示左肺下叶见斑片状、条索状高密度影, 边缘模糊, 左侧胸膜增厚, 胸膜腔见半月形水样密度影, 内密度气体影, 右侧胸膜腔未见积液。胸水常规:眼观黄色浑浊, 李凡他试验2+, 有核细胞总数1120×106/L, TH-间皮及组织细胞5%, 多页核细胞百分比30%, 单个核细胞百分比65%, 胸水生化:腺苷脱氨酶58.9 U/L, 葡萄糖(浆膜腔)1.5 mmol/L, 蛋白测定(浆膜腔)47.4 g/L, 乳酸脱氢酶测定(浆膜腔)2292 U/L, 白蛋白33.7 g/L。胸水涂片疑似找到诺卡菌。胸水培养及鉴定:诺卡菌属, 亚洲诺卡菌。未培养出真菌。
诊断:①支气管肺炎-左侧脓胸(诺卡菌感染);②血小板减少性紫癜;③高血压病。
治疗:入院后先后予头孢曲松、头孢哌酮舒巴坦静脉滴注及伊曲康唑口服抗感染治疗, 患儿仍有反复发热、咳嗽、咳痰及气促表现。2016年8月9日确诊诺卡菌感染后开始加用复方新诺明口服治疗, 同时继续予头孢哌酮舒巴坦静脉滴注及口服伊曲康唑联合抗感染治疗;2016年8月10日体温恢复正常, 8月18日本院查胸部CT示:左肺下叶炎症, 左侧胸膜增厚, 左侧包裹性液气胸(见图1, 患儿初始治疗时,左肺下叶见斑片状、条索状高密度影, 边缘模糊, 左侧胸膜增厚, 左侧包裹性液气胸)。血常规:白细胞13.00×109/L, 中性粒细胞百分比0.823, CRP<10 mg/L, 病情好转, 出院后继续口服复方磺胺甲噁唑片, 定期门诊复诊。目前恢复可(见图2, 患儿治疗2个月后, 左肺下叶见斑片状、条索状高密度影,左侧胸膜增厚, 左侧胸膜腔少量包裹性积液)。

图1 患儿初始治疗时(2016年8月18日)
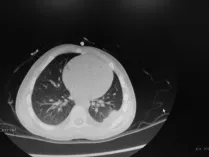
图2 患儿治疗后(2016年10月24日)
病例2:患者, 女, 43岁, 因“反复咳嗽、发热1年余,气紧半月”于2013年10月6日入院, 患者入院前1年无明显诱因下出现咳嗽、咳痰, 为黄色浓痰, 伴间断发热, 体温波动于38.5~39.℃, 5月+前在当地医院住院治疗10余天(具体诊治不详), 症状稍好转后出院, 半月前症状加重, 咳嗽逐渐增多, 伴咳黄痰及暗红色血痰, 并出现胸闷胸痛、气紧、呼吸困难, 不能从事日常劳作, 为进一步诊治, 至本院就诊。
入院查体:T 39.2℃, P 133次/min, R 42次/min, BP 128/79 mm Hg。神志清楚, 急性病容, 全身浅表淋巴结未触及肿大, 呼吸急促, 未见鼻扇, 三凹征(-)。无发绀, 胸廓对称,双肺叩诊呈浊音, 双肺呼吸音粗, 可闻及大量湿性啰音。全腹柔软, 肝脾未触及肿大。心律齐, 心音有力, 未闻及杂音,未见杵状指(趾), 四肢无水肿。
辅助检查:血气分析:pH=7.433, 二氧化碳分压(PCO2)33.3 mm Hg, 氧分压 (PO2)54.5 mm Hg, 钾 (K)2.7 mmol/L, 钠 (Na)132 mmol/L, 血乳酸(LAC)3.6 mmol/L, 示Ⅰ型呼吸衰竭, 血常规白细胞8.70×109/L, 单核细胞百分比0.216, 肝功能:白蛋白26.3 g/L, 示低蛋白血症, 心肌酶及肾功能未见明显异常。电解质钾3.32 mmol/L, 胸部CT左肺上叶舌段、右肺中叶及两肺下叶各段见多发团状、片状实变影, 左侧胸膜腔少量胸腔积液。降钙素原8.810 ng/ml, 血糖7.8 mmol/L。葡萄糖化血红蛋白6.30%, 血脂:总胆固醇1.25 mmol/L, 高密度脂蛋白胆固醇0.31 mmol/L, 低密度脂蛋白胆固醇0.39 mmol/L, 载脂蛋白A 0.332 mmol/L, 免疫球蛋白(Ig)G 5.590 g/L, IgA 1.092 g/L,IgM 1.025g/L, 痰涂片找到G+杆菌, 疑似诺卡菌, 未找到抗酸杆菌及真菌。痰一般细菌及真菌培养:曲霉菌伴疑似诺卡菌混合生长, 请结合临床。
诊断:①重症肺炎(奴卡菌感染);②肺曲霉菌病;③低钾血症。
治疗:患者入院后给予特治星、莫西沙星抗感染以及支持疗法等治疗, 病情无好转, 入院第3天病原学结果回报后将抗感染方案更改为复方新诺明、阿米卡星、特治星, 入院第4天患者出现病情变化, 予气管插管呼吸机辅助呼吸治疗,家属签字放弃治疗。
2 相关文献复习
使用中国期刊全文数据库和万方数据库, 以“肺奴卡菌”及“肺诺卡菌”为检索词, 搜集2011~2016年数据库收录的资料完整的43例肺奴卡菌感染病例, 包括本文2例, 共计45例肺奴卡菌感染患者, 其中, 男27例, 女18例, 男女比例1.5∶1,除本研究报道的1例为2岁8月的儿童外, 其余44例均为成人,44例发病年龄18~80岁, 平均年龄(54.5±14.93)岁。
2.1 宿主危险因素 除5例患者(11.1%)无明显危险因素外,其余均并存1种或多种基础疾病。其中, 较长时间服用糖皮质激素17例, 支气管扩张9例, 慢性阻塞性肺疾病7例, 较长时间使用免疫抑制剂6例, 糖尿病、皮肌炎、肾病综合征及支气管哮喘各4例, 获得性免疫缺陷综合征3例, 低蛋白血症及慢性乙型病毒性肝炎各2例, 系统性红斑狼疮、免疫性血小板减少性紫癜及免疫性全血细胞减少症各1例。本研究所报道的1例儿童患儿, 合并有血小板减少性紫癜, 有较长时间服用糖皮质激素史。
2.2 临床表现 最常见临床表现为咳嗽、咳痰、发热[97.8%(44/45)、82.2%(37/45)、80.0%(36/45)], 胸痛及胸闷分别发生于24.4%(11/45)及17.8%(8/45)的患者。本研究所报道的1例儿童患儿, 其临床表现为咳嗽、咳痰、发热, 与成年患者无异。
2.3 影像学特点 45例患者影像学表现为肺实变影29例,空洞13例, 胸腔积液12例, 结节11例, 囊状影、纵隔淋巴结增大及胸膜增厚4例, 心包积液3例。本研究中的1例儿童患儿, 主要临床表现亦为肺实变及胸腔积液, 无特异性表现。
2.4 病原学检查 45例患者经痰培养出奴卡菌而确诊的有22例, 占48.9%, 肺组织活检及胸水培养各5例、血培养、脓液培养及肺泡灌洗液培养各3例、痰DNA测序及肺穿刺液各2例。鉴定分型的奴卡菌中, 星型奴卡菌14例(31.1%),巴西奴卡菌5例(11.1%), 豚鼠耳炎诺卡菌、盖尔基兴奴卡菌、鼻疽奴卡菌各1例, 其余23例未分型。
2.5 治疗及转归 45例肺奴卡菌病患者治疗药物中, 磺胺类药物39例, 三代头孢9例, 碳青霉烯类9例, 阿米卡星3例,利奈唑胺2例, 头孢吡肟2例, 庆大霉素2例, 特治星、莫西沙星、万古霉素、替加环素、依替卡星、左氧氟沙星及头孢米诺各1例。4例患者未详细记录治疗药物, 除2例患者外(1例单用头孢米诺, 另1例单用头孢吡肟), 均为磺胺类药物为主的联合治疗。总体预后:5例放弃治疗, 4例死亡, 3例患者未详细记录治疗转归, 1例痊愈, 其余好转。
3 讨论
肺奴卡菌病是奴卡菌感染肺部所致的急慢性化脓性病变为主的疾病, 是一种少见而严重的感染, 临床表现和影像学表现缺乏特异性, 易误诊、漏诊, 而诊断及治疗的延误往往导致较高的死亡率[1]。
2011~2016年文献所报道的病例均为成年患者, 仅本研究所报道1例为儿童患儿。
3.1 病因及危险因素 奴卡菌是一种需氧放线菌, 革兰染色及抗酸染色阳性, 主要存在于土壤、腐烂植物以及水中,被公认为机会性感染致病菌, 在免疫功能正常宿主中也可致病[2]。恶性肿瘤、使用糖皮质激素和(或)免疫抑制剂、实质器官或骨髓移植、糖尿病、慢性阻塞性肺疾病及人类免疫缺陷病毒(HIV)感染是常见的危险因素。本研究中1例儿童患儿合并血小板减少性紫癜, 并较长时间服用糖皮质激素,其余44例成年患者, 仅5例既往体健, 其余至少有1种基础疾病, 主要为肾病综合征、支气管扩张、支气管哮喘、糖尿病等。
3.2 临床及影像学表现 临床及影像学表现均无特异性。咳嗽(80%)和发热(50%)是两个首要的症状, 而肺实变(50%)和胸腔积液(40%)是主要的影像学表现[3]。本研究中, 咳嗽44例(97.8%), 咳痰37例(82.2%), 发热36例(80.0%), 斑片状实变影29例(64.4%), 伴空洞13例(28.9%), 胸腔积液12例(26.7%), 单个或多发结节影11例(24.4%)。仅有1例儿童患儿,亦以发热、咳嗽、咳痰为主要临床表现, 其影像学主要表现为肺实变和胸腔积液, 并无特异性。
3.3 诊断 肺奴卡菌病临床与影像学表现均缺乏特异性,临床诊断困难。由于特殊的微生物学特性, 奴卡菌培养分离较为困难, 且分离率偏低, 它在培养基生长慢, 在温室或普通培养基上培养多数于2~7 d内才可肉眼观察到菌落[4]。故临床上有危险因素而常规抗感染效果不好的患者应高度怀疑奴卡菌感染可能, 临床医生应告知实验室医师, 便于实验室选择适当的培养基(其中沙堡培养基易得阳性结果)以及延长培养时间, 提高阳性率[5]。
3.4 治疗 尽管国内外文献关于TMP-SMX药敏试验结果的报导有争议, TMP-SMX仍是目前治疗肺奴卡菌病的一线药物, Brown-Elliott对美国6个主要的实验室所分离的552珠奴卡菌进行研究, 结果仅发现2%分离株对TMP-SMX耐药[6]。临床上磺胺药治疗奴卡菌失败的报道也较少见。耐药程度高者往往提示预后不佳。经验性治疗一般为TMPSMX联合三代头孢、阿米卡星或亚胺培南(或美罗培南), 在磺胺类药物耐药情况下, 可以选择头孢曲松联合阿米卡星或米诺环素或氟喹诺酮, 耐药程度高且病重者必要时可用利奈唑胺[7]。
本研究中的1例儿童患儿经予TMP-SMX及头孢哌酮舒巴坦联合抗感染治疗, 好转出院, 随访无复发, 复查胸部CT肺部病灶逐渐吸收好转。其患病危险因素、临床症状、影像学表现及治疗与44例成年患者并无差异。
3.5 预后 肺奴卡菌病的死亡率为14%~40%, 播散型奴卡菌病为64%[8]。本研究中, 4例患者死亡, 死亡率8.9%, 其中, 3例为病史较短、基础疾病较重的老年患者(年龄分别为62、76及75岁, 其中2例又为磺胺类药物耐药), 1例合并脑积水, 提示肺奴卡菌病患者的预后与是否存在致机体免疫功能低下的基础疾病、起病是否急性、诊断及治疗是否及时、细菌耐药程度、是否老年患者以及是否有中枢神经系统受累有关。
综上所述, 肺奴卡菌病是儿童罕见而严重的感染, 临床特征和影像学表现缺乏特异性, 经验性治疗为TMP-SMX的单一或联合其他抗菌素治疗, 初步证实儿童肺奴卡菌病在危险因素、临床表现及影像学改变上与成人无异。

