子宫颈癌外科手术路径进化史
臧荣余
复旦大学附属中山医院妇产科,上海 200032
新近NewEnglandJournalofMedicine杂志刊发了2篇关于子宫颈癌微创手术治疗的文献[1-2],使国内外学者对子宫颈癌手术方式包括手术路径的选择提出了很多疑问。这里,作为纯粹的学术思考,有必要系统温习子宫颈癌根治手术路径的发展历程及不断进步的技术改进。
1 子宫颈癌的创始手术及手术路径
子宫颈癌外科手术是根治性子宫切除(radical hysterectomy)和腹膜后淋巴清扫(retroperitoneal lymphadenectomy)两种手术的组合,虽然腹膜后淋巴清扫有经腹和经腹膜后路径、开腹和微创手术 (minimal invasive surgery, MIS)之分,但经腹淋巴清扫作为主流手术没有争议。存在争议且有所发展的是子宫切除的路径:经腹还是经阴道;主韧带切除的长度是2 cm、3 cm,还是紧贴盆壁;术式是微创(包括经阴道自然腔道内镜手术,transvaginal natural orifice transluminal endoscopic surgery,V-NOTES)还是开腹;保留神经与否;保留子宫与否等。
1889年,维也纳大学Wertheim教授进行了第1例经腹子宫根治术(abdominal radical hysterectomy, ARH)[3],并在1912年报道了500例子宫根治术的结果,描述了输尿管内侧入路法如何切除足够长的主骶韧带(图1A),但术后并发症和手术死亡率均很高。1944年,Meigs手术[4]在Wertheim手术基础上,改进了手术技术,采用输尿管外侧入路法(图1B),增加了盆腔淋巴清扫,加上抗生素的发明使用,并发症显著降低。其间,日本Okabayashi[5]进一步拓宽了主韧带切除范围,介绍了中晚期子宫颈癌自盆壁切除主韧带方法,由于技术要求高、出血多,并没有得到欧美国家医生的广泛采用。虽然没有非常明确,根据输尿管的解剖位置,内侧入路法称为魏氏手术,而外侧入路法称为 Meigs手术[4]。国内妇科肿瘤培训背景的医生多数采用前者;妇产科培训背景的多采用后者。
此外,经阴道子宫颈癌根治手术(vaginal radical hysterectomy, VRH)也颇受欢迎,妇产科培训背景的医生尤其擅长,该手术也称为Schauta手术[5],但肿瘤大、怀疑有宫旁浸润的患者,该术式有局限性;与前两个手术相比,医生的培训周期也更长。该手术在国内只在少数综合性医院或妇产科培训背景的医院开展。
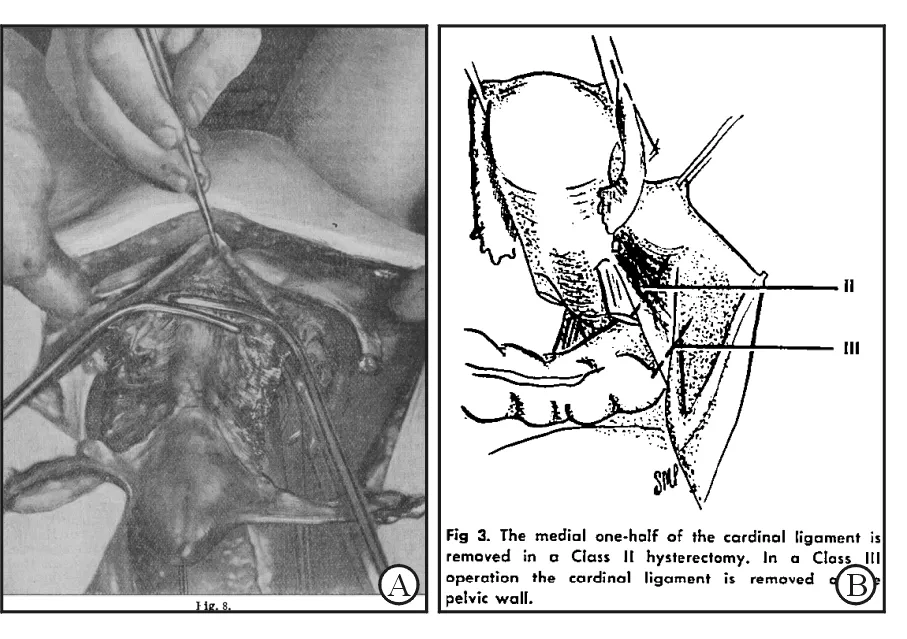
图1 子宫颈癌根治手术的经典手术路径
2 根治性子宫切除手术的完善和发展
1974年,Piver等[6]在前人基础上明确了子宫颈癌根治性手术主骶韧带的切除范围,称为Piver分型(Ⅰ~Ⅳ型)。2008年,Querleu和Morrow[7]提出新的QM分型(A~D型);QM分型的焦点是C1 型,即保留盆腔自主神经的改良型子宫颈根治手术,描述得非常详细,但实践仍较困难。目前这两种分型都被应用于子宫颈癌根治性手术中。
1947年,Bruschwig首创了盆腔脏器清除术(pelvic exenteration)用以治疗盆腔内中央型复发或残留的宫颈癌。中央型复发的子宫颈癌,指的是手术或全量放射治疗一段时间后,复发病灶位于子宫颈或残端阴道,没有盆壁或淋巴结转移的病灶。此后该技术还应用于部分晚期子宫颈癌,即肿瘤累及膀胱或直肠黏膜的中央型Ⅳ期患者的初次治疗。因此,盆腔脏器清除术手术入路不难,如前盆腔脏器清除需要从没有肿瘤累及的耻骨后方,外侧自膀胱侧窝整块(en bloc)切除肿瘤,难的是盆腔的重建,以恢复脏器功能,放疗后的病例需要控制术并发症。此领域中国学者也有一定贡献,报道手术后的5年生存率为50%[8]。
3 微创技术的兴起和经自然腔道手术的改进应用
20世纪80年代,子宫颈癌腹腔镜手术率先兴起,主要包括经腹和经阴道(自然腔道)腔镜或机器人辅助的腔镜子宫颈癌根治术。两者的区别在于切除阴道壁和主骶韧带的手术操作路径上的差别。
Querleu等[9-10]较早采用了腹腔镜下盆腔淋巴结清扫术。而文献报道最早的腹腔镜子宫颈癌根治手术在1992年[11],LRH技术逐渐被推广。2005年,美国食品药品监督管理局(FDA)批准达芬奇机器人技术应用于妇科领域。Sert等[12]于2006年报道了首例早期宫颈癌患者的机器人辅助下广泛性子宫切除术(robotic-assisted radical hysterectomy, RRA)。机器人手术系统操作臂灵活性强,能够在狭小的盆腔内进行操作,这大大推动了达芬奇机器人在早期宫颈癌手术中的应用。
此时,随机对照临床试验在肿瘤研究领域已高度发达[13],但此后的20年间,子宫颈癌微创手术,并没有任何随机对照临床试验比较ARH和LRH/RRH。因此,国内多数肿瘤培训背景的妇科医生仍然采用传统的开腹手术;也没有人质疑过微创手术器械。少量的回顾性研究认为,LRH与传统的ARH相比,手术更安全,且疗效相当。2009年,意大利Malzoni等[14]回顾性比较ⅠA2和ⅠB1期子宫颈癌LRH和ARH的安全性和复发率,其中65例接受LRH,62例接受ARH,ARH组和LRH组的中位失血量分别为145 mL和55 mL(P<0.01),住院时间中位数分别为7 d、4 d(P<0.01),中位手术时间分别为152 min和196 min(P<0.01);两组间复发率差异无统计学意义。
2012年,Nam等[15]对ⅠA2~ⅡA期宫颈癌患者腹腔镜下根治性子宫切除,配对比较LRH(n=263)和ARH(n=263)手术安全性和治疗效果。结果显示,LRH可显著降低估计失血量(379.6 mLvs541.1 mL,P<0.001),缩短术后住院时间(12.5 dvs20.3 d,P<0.001),减少术后并发症发生率(9.2%vs21%,P<0.001)。与ARH 相比,LRH并没有较高的复发风险(HR=1.28,95%CI 0.62~2.64) 或死亡(HR=1.46,95%CI 0.62~3.43)。即使肿瘤直径>2 cm,腹腔镜手术组复发风险(HR=0.82,95% CI 0.31~2.16)或死亡风险(HR=1.01,95% CI 0.35~2.95)均不高于开腹手术组。LRH组和ARH组5年无复发生存率分别为92.8%、94.4% (P=0.499)。因此,研究者认为LRH可以代替ARH。
4 微创理念与争议焦点
微创理念是21世纪手术方法的重要标志。1983年“微创外科”的概念首次被提出,由于微创手术(腹腔镜手术或机器人辅助手术)具有创面小、疼痛轻、术后愈合时间短等优势,逐渐被应用于各个外科领域。来自亚洲和欧洲国家多中心临床研究比较了直肠癌、胃癌和子宫内膜癌腹腔镜手术和开腹手术的手术和生存结局,显示生存率并无差异[16-17]。但研究结果仍然显示在直肠肿瘤并没有达到两者等效的结果[18],还有待于更多的临床研究。令人瞩目的开腹和机器人辅助的腔镜前列腺癌根治术研究,由于2014年患者入组刚刚结束,初步的功能结果和手术结局没有差别,生存结局还有待随访,意味深长的是研究者告诉医生,也可能告诉关心该研究的患者,选择手术医生比选择手术方法更重要[19]。
2018年11月15日第3期NewEnglandJournalofMedicine作为Specialties(专题报道)形式,发表了背靠背的两项早期子宫颈癌微创手术,随机对照3期临床研究和美国国家癌症数据库的回顾性研究。其中M.D.安德森癌症中心的LACC研究[1],比较了早期宫颈癌(ⅠA1、ⅠA2和ⅠB1)患者在分别接受腹腔镜或达芬奇手术(MIS)和开腹手术(ARH)的预后结局。结果显示,MIS组患者的4.5年无瘤生存率(4.5-year DFS)为86%,而ARH组为96.5%;MIS组患者的无疾病生存率(PFS)比ARH组降低了10.6%;患者的3年生存率(3-year rate)也显著低于ARH组(93.8%vs99.0%;HR=6.00,95% CI 1.77~20.30),MIS组患者的3年死亡率高于ARH组(4.4%vs0.6%;HR=6.56,95% CI 1.48~29.00)。
Melamed 等[2]流行病学研究,选取了美国国家癌症数据库(NCDB)和SEER数据库,比较2010至2013年接受过根治性全子宫切除术的ⅠA2和ⅠB1宫颈癌患者。其中1 236例接受开腹手术(ARH),1 225例接受微创手术(RRH 或LRH)。结果显示,在45个月的中位随访中,接受微创手术的患者4年死亡率为9.1%,接受开腹手术的患者死亡率为5.3%(HR=1.65,95% CI 1.22~2.22;P=0.002)。接受微创手术的患者相比开腹手术患者来说,总生存率(OS)下降,死亡风险增加了65%。在随后的亚组分析中,机器人手术(RRH)对比开腹手术(ARH)的HR为1.61;传统腹腔镜手术(LRH)对比开腹手术(ARH)的HR为1.50。回顾之前的数据发现,在微创手术没有被采纳前(2000至2006年),早期子宫颈癌的生存率相对恒定,并且4年生存率以平均每年0.3% (95% CI -0.1~0.6) 的变化缓慢上升,而在2006年采用MIS后,2006至2010年早期子宫颈癌的4年相关生存率每年下降0.8%(95% CI 0.3~1.4), 变化趋势显著 (P=0.01)。而且研究者特别提及白人、商业医保、高经济收入、小病灶、细胞分化好者更接受MIS;而相对诊断晚期的患者接受开放手术。
LACC研究入组病例主要来自美国和亚洲国家(包括中国),PI设计研究的初衷是微创治疗子宫颈癌与开腹手术相比,生存率相当。参与项目的研究机构多数研究者支持微创手术,所以研究结果没有任何疑问。研究者分析了微创手术可能差的几个原因,一是举宫器手术操作过程中,反复挤压肿瘤,甚至子宫穿孔;二是部分医生对宫颈肿瘤的处理,标本暴露于CO2气腹中,违背手术操作无瘤原则。最后研究者也提及,本研究的结论不能推及至“低危肿瘤”:肿瘤<2 cm、间质浸润<10 mm、脉管无累及、淋巴结无转移的患者。同期,另外一项结果显示,肿瘤病灶>2 cm的患者的中位5年生存率在MIS组为81.3% ,而ARH组为90.8%(HR=2.14,P<0.001)。
问题的焦点之一:手术操作的无瘤原则,不是腔镜技术本身,业界多数认同。然而,腔镜技术在子宫颈癌手术中应用,由妇产科医生内窥镜诊断起始,欧美和中国情况类似,但我们无从查证举宫器的发明人。
问题焦点之二:如何看待循证医学证据?根据上述结果,美国医生将会叫停微创治疗子宫颈癌,直至新的循证医学证据出现或开展新的临床研究。我们国家从事微创治疗的医生情感上可能过不去。在情和法理之间平衡,欧美医生和中国医生处理的方法不同。在中国不少,但也不可能是多数,仍然会坚持使用子宫颈癌的微创手术,基于国情,如果不选择微创治疗,患者将流失;相比开腹,微创技术易于学习,国内从事子宫颈癌微创手术的医生群体远大于开腹医生。的确我也相信微创医生手术的患者生存率与他们的开腹手术相当,但肿瘤培训背景的开腹手术医生的患者生存率更高,病源也更集中。虽然循证医学有很多局限性,但高级别的循证医学证据仍然是律师采信的唯一依据,违背证据的实践也会面临伦理问题。
回归本真,微创是一种理念,科学技术进步,人工智能发展,微创技术不仅用于腹腔镜手术,开放手术同样可以借鉴,目的是减少创伤,降低并发症,同时需要兼顾肿瘤患者的生活质量。微创技术的发展,需要体现商业应用价值,但最终需要服从患者临床需求及患者利益。如何选择?我想引用前列腺微创研究结论的一句话,“选择有经验的手术医生比选择手术方法更重要”。
5 微创理念的延伸
1986年,法国医生Dargent 等[20]首创经阴式根治性子宫颈切除术(vaginal radical trachelectomy, VRT),使年轻子宫颈癌患者切除子宫颈可以保留子宫,仍然有生育功能。VRT手术可以使用在肿瘤直径<2 cm的患者,有人提出开腹手术(abdominal radical trachelectomy, ART)手术指征可以放宽至小于或等于4 cm的最大肿瘤直径,但仍然存在争议。
子宫颈癌根治术切除3 cm的主骶韧带,盆腔神经丛受到一定程度的损伤,膀胱的自主排尿功能至少需要2周的恢复过程,于是保护膀胱功能的子宫颈癌根治术(nerve-sparing radical hysterectomy, NRH)在腹腔镜和开腹手术均有尝试,NSRH的C1型手术主韧带的切除范围比常规根治性手术C2型要保守一些[7]。也有人质疑,肿瘤切除的范围不够,影响患者预后,但多数研究显示患者预后不受影响。
无论是开腹手术还是微创手术,多数文献保留神经的手术采用的路径是,先解剖下腹下神经,然后寻找盆神经丛,上述结构解剖清楚后,保留盆神经丛的膀胱支。该方法的优点是直视神经,利于教学,但问题是盆神经丛呈鹰爪型,细小与纤维组织很难区分,且与盆静脉丛纵横交错,一旦静脉出血,手术将无法进行[21]。复旦大学上海医学院张志毅教授[22]20世纪80年代发明了输尿管鞘膜内解剖输尿管方法用于妇科的盆腔手术,使复杂的盆腔手术化繁为简。
我们的团队采用这种隧道内游离输尿管方法,结合经典Wertheim手术的输尿管内侧入路法,找到输尿管入膀胱“输尿管末端”的解剖标志点,切除2 cm的膀胱宫颈韧带,ligasure离断子宫神静脉和膀胱下静脉的阴道支,解剖无血管区的膀胱阴道侧间隙(paravesico vaginal space, PVVS;图2),完整向外推移输尿管伴行,位于输尿管下方的盆神经丛;子宫颈主韧带暴露在直视下,切除3 cm宫旁组织。2011年11月11日上述技术成功后,我们在国际手术同行透明监督下,由探索性研究,延推2期注册登记的标准化临床研究。

图2 膀胱阴道侧间隙的解剖标志[24]
上方外侧远心端为输尿管末端;外侧为盆神经丛;下方头端为子宫颈主韧带;内侧中线端为子宫颈和阴道穹窿
自2011年11月到2016年8月,共177例宫颈癌患者接受了该手术:中位手术时间为76 min(32~340 min),中位术中出血量为200 mL(50~2 200 mL);一期探索研究示,术后7 d拔尿管成功率为85.2% (23/27),残余尿≤50 mL比例为66.7%(18/27);二期验证研究示,4 d拔管率为73.3%(110/150),残余尿≤50 mL比例为35.3%(53/150);术后30 d内无Ⅲ/Ⅳ级手术并发症及死亡病例出现;术后中位随访时间为39.2个月(3.2~68.1个月),失访率6.8%,共13例复发,其中7例为局部复发;5年局部控制率为95.1%,5年总生存率为96.2%[23-25]。该术式简化了手术步骤,促进了膀胱功能恢复,保障了患者安全和生存预后;从解剖层面首次提出“膀胱阴道侧间隙”的概念,并将输尿管末端、子宫深静脉以及膀胱阴道侧间隙概括为其中的3个重要解剖标志,为宫颈癌根治术提供了一种新的手术入路。
综上所述,子宫颈癌外科手术经历了130年的发展历程,手术路径经历了经腹、经阴道,开腹、微创手术,输尿管内侧入路、外侧入路,根治性子宫切除、根治性子宫颈切除,传统根治术、保留神经手术等历史变迁和进化。相信随着材料和技术的不断进步以及临床医生的不断努力,未来微创手术会使得更多的患者从中获益。
致谢:衷心感谢复旦大学附属中山医院妇产科姜怡亭、尹胜和史庭燕医生在资料收集、整理过程中提供的帮助。

