预先离断尿道黏膜的整块剜除法在中小体积前列腺剜除术中的应用
陆 明, 陈建刚, 钱 麟, 潘 彬
南通大学第二附属医院,南通市第一人民医院泌尿外科,南通 226001
前列腺增生症(benign prostatic hyperplasia, BPH)是影响老年男性生活质量最常见的疾病之一[1-2]。近年来,随着激光技术的进步及其在泌尿外科手术中的应用,经尿道钬激光前列腺剜除术(holmium laser enucleation of prostate, HoLEP)因其腺体切除彻底、术中术后出血少、无电切综合征等优点逐渐成为微创治疗BPH的热点技术[3]。然而,与传统的前列腺电切技术相比,HoLEP操作技术学习曲线更长,且术后短暂性尿失禁发生率较高[4-6]。因此,本研究从解剖结构出发,在中小体积BPH患者中,尝试采用预先离断尿道黏膜的整块剜除法进行HoLEP手术,取得初步疗效,现报告如下。
1 资料与方法
1.1 一般资料 收集2016年7月至2018年7月于我院接受HoLEP患者的临床资料,将前列腺体积为40~70 mL(54±13.5) mL(经直肠前列腺B超测定,计算方法为最大左右径×前后径×上下径×0.52)的50例患者纳入本研究。50例患者年龄61~88岁,平均年龄(74±11.5)岁。所有患者均进行全面术前评估,包括病史、国际前列腺症状评分(IPSS)、生活质量评分(QOL)、直肠指检、前列腺特异性抗原(PSA)测定及剩余尿量(PVR)、最大尿流率(Qmax)、血常规等情况。50例患者中,合并高血压12例,糖尿病8例,脑梗死3例,合并膀胱结石4例,既往有前列腺电切手术史2例,PSA升高行前列腺穿刺活检提示为良性病变者3例。
1.2 手术器械与手术方法 采用科医人医疗激光公司的100 W钬激光发生器,配备550 μm激光光纤,配套使用德国Storz公司连续灌洗式前列腺电切镜及直射激光专用操作手件,采用科医人医疗激光公司配套的VersaCut 组织粉碎器械。采用连续硬膜外麻醉或全身麻醉。
手术步骤:(1)直视下进镜至膀胱,观察膀胱、输尿管开口情况,从膀胱颈口缓慢退镜,经过精阜达到前列腺外括约肌远端尿道水平,观察前列腺部尿道的长度,确认精阜与前列腺外括约肌的相对位置关系后,将操作镜头端前进固定于精阜水平。下压操作镜尾部,将镜头视野正对前列腺两侧叶前联合部位,光纤功率设定为75 W(1.5 J/50 Hz),将前联合部位向膀胱颈部方向纵行切开约0.5 cm,深度达到前列腺腺体组织(图1A)。(2)向两侧叶斜向外下方呈“人”字形切开前列腺两侧叶表面黏膜及黏膜肌层(图1B),再于精阜水平两侧“5点” “7点”处呈“八”字形切开尿道黏膜,并向尿道精阜水平延展。(3)于精阜两侧点处呈倒“U”字形切开尿道黏膜,并分别于原先两侧叶表面的“人”字形切口会师(图1C),至此后尿道黏膜及黏膜肌层(包括少量腺体)已经被完整地切断1圈。(4)将激光功率调整为80 W(2.0 J/40 Hz),在“5”点附近位置的黏膜切开处,通过镜鞘钝性推剥和钬激光爆破能找到左侧叶腺体与外科包膜的交界层面,沿此平面逆时针剥离侧叶腺体至“12点”位置。(5)同法将“5点”至“7点”处前列腺中叶组织向膀胱颈部推剥游离,再顺时针剥离右侧叶至与左侧叶剥离平面会师,至此前列腺远端与远端尿道分离(图1D)。(6)继续将远端整圈游离的整块腺瘤向膀胱颈方向推进剥离,直到将前列腺完全从膀胱颈部整块剥离,完成剜除步骤。(7)前列腺窝创面彻底止血后,接入组织粉碎器完成手术。
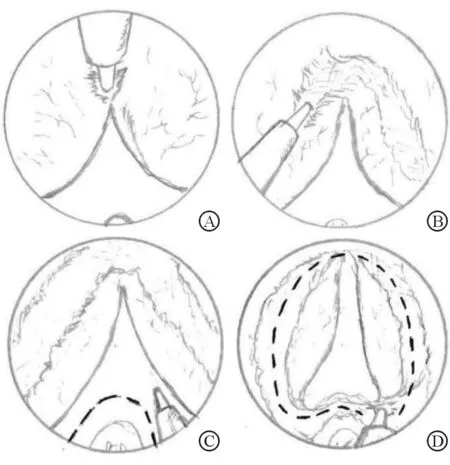
图1 预先离断尿道黏膜的整块剜除法示意图
A:前列腺尖部“12点”处切开前联合; B:前列腺两侧叶表面“人”字形切开; C:倒“U”形切开精阜前方的尿道黏膜; D:左、右侧叶剥离平面会师,前列腺尖部与远端尿道分离
1.3 观察指标 术中记录前列腺剜除时间及术中并发症出现情况。术后记录前列腺剜除体积、膀胱持续冲洗时间、导尿管留置时间、术后住院时间、血常规及相关并发症等情况。术后4周复测IPSS、QOL及Qmax、PVR,并询问尿控等情况,评估手术疗效。术后压力性尿失禁诊断标准:术后拔除尿管24 h后,患者站立位时出现尿液从尿道口滴出现象或日常生活中每日须使用至少1块尿垫。
2 结 果
2.1 手术相关情况 所有患者手术均顺利完成,手术时间为21~55 min,平均(36.5±12.2) min,剜除腺体(29±13.2) g,术后留置导尿管时间(74±11.4) h,术后膀胱持续冲洗时间(15.2±8.2) h,术后住院时间(4±1.5) d。
2.2 手术前后疗效指标的对比 结果(表1)表明:与术前相比,术后4周IPSS、QOL评分、Qmax、PVR均明显改善,差异有统计学意义(P<0.001)。

表1 手术前后相关检测指标的对比
*血红蛋白为术后第1天测得值. IPSS:前列腺症状评分;QOL:生活质量评分;Qmax:最大尿流率;PVR:剩余尿量
2.3 术后并发症及处理 50例手术患者均未输血;4例(8%)患者拔除尿管后主诉出现尿频、尿急症状,予以双氯芬酸钠栓(50 mg,每日2次)纳肛后明显好转;3例(6%)患者术后出现压力性尿失禁,均在术后1周内恢复。
3 讨 论
经尿道前列腺剜除术(transurethal endoscopic enucleation of prostate, EEP)由国内刘春晓教授最先提出,并于2016年写入欧洲泌尿外科学会(EAU)推荐指南[7]。Gilling等[6]在1998年首先报道采用HoLEP术联合组织粉碎器治疗BPH,并于2012年分享了他们7年的随访结果和手术体会,认为该术式具有良好的远期疗效,对增生腺体剜除完整,且7年的复发率低,值得临床推广。尽管HoLEP术优势明显,但其手术难度较大,学习曲线长,其中最困扰初学者的是HoLEP术后压力性尿失禁发生率较高[5-6]。压力性尿失禁使患者围手术期的生活质量下降,也给手术医师带来了很大的压力,阻碍了HoLEP手术的推广。
针对术中尿控保护,近期研究[8-9]对男性尿道的尿控肌性结构提出了新见解:近端尿道括约肌(proximal urethral sphincter, PUS)与远端尿道括约肌(distal urethral sphincter, DUS)构成了尿控的主要组成部分。PUS由膀胱逼尿肌中层环状肌纤维在尿道内口延续形成的膀胱括约肌和逼尿肌内层纵行肌延续至后尿道呈“漏斗”状的平滑肌(smooth muscle sphincter, SMS)组成,受盆丛的自主副交感神经纤维支配,具有辅助控尿功能;DUS包括横纹括约肌和精阜周围的平滑肌结构(前列腺被动括约肌)。李凌等[10]则提出了“两点一线一面”的手术原则,认为手术初始阶段显露包膜面后,用激光沿着界限定位切割线来界定远端切除范围可以保护PUS。谷猛等[11]研究认为,HoLEP术中距离膀胱黏膜约0.5 cm处环形切断包膜组织,使残留组织收缩形成衬垫样结构,可对尿控功能起到一定保护作用。
本研究认为,虽然术中遵循上述操作原则可以明显降低术后尿失禁的发生率,但对于HoLEP手术初学者,由于手术进程中激光烧灼造成尿道黏膜、尿道肌层、前列腺腺体等相关解剖结构辨认困难,加上机械力的推剥造成相关解剖结构的变形移位,贯彻上述手术原则存在一定难度。因此,本课题组对手术操作流程做了一些改进:在剜除腺体之前,首先环形切断前列腺尖部的尿道黏膜与黏膜平滑肌层,将前列腺尖部与其远端的PUS分离开,进而在前列腺尖部和PUS之间形成了一圈沟槽,沟槽远端的横纹外括约肌连同尿道黏膜、平滑肌自然向远端回缩,这样在后面进行剜除操作时,可避免PUS被激光误伤;而且,术中利用机械力量撬剥腺体时,镜鞘也可自然进入沟槽内,由于括约肌不再和前列腺尖部组织相连,可避免过度拉伸括约肌,进而预防因尿道横纹括约肌机械性拉伤造成的术后压力性尿失禁。该操作在手术前尿道黏膜结构完整、无拉伸移位的情况下进行,因此解剖标志清楚易辨,可操作性强。当前列腺尖部与PUS分开后,再于“5点”“7点”精阜附近切开尿道黏膜,寻找到前列腺包膜面后,即可沿着包膜面完整剥离前列腺尖部1圈,随后就可以使光纤环绕着腺体向膀胱颈部方向进行剥离,而避免损伤括约肌,同时使手术时间缩短。当分离到靠近膀胱颈时,保留一段前列腺前括约肌亦有助于术后尿控功能的恢复。本研究50例研究对象中,仅3例出现短暂性压力性尿失禁,且均在1周内恢复,提示该方法效果良好。
然而,该方法仍存在一定的缺陷:对于体积较大的BPH,由于前列腺侧叶表面黏膜切开范围相对较大,而腺体尿道黏膜血供较丰富,切开时容易使出血较多,造成视野不清,进而延长手术时间。本研究用小能量高频率的激光(1.5 J/50 Hz)可在一定程度上改善止血效果。此外,过大的前列腺尖部区域往往超过一个镜野,初学者手术经验欠缺,不易准确判断黏膜切开线的位置,也使该方法的应用范围受到了一定的限制。

