Lp-PLA2基因多态性与急性心肌梗死患者的易感性和临床特征的相关性研究
苗常青,卢群,刘平,白玲,马爱群
急性心肌梗死(AMI)是冠状动脉粥样硬化性心脏病(冠心病,CAD)分型中最严重的一种危急重症,致死率较高,严重威胁人民生命健康,加重社会负担。研究显示,AMI的发生、发展涉及多个方面因素,包括遗传因素、环境因素等[1],动脉粥样硬化易损斑块引起的血管内皮细胞损伤和慢性炎症反应被公认为是CAD重要的病理基础[2]。针对AMI相关遗传易感基因的研究,是目前心血管领域研究的热点,对于高危易感人群早期筛查和及早干预,降低其发病风险具有重要的临床价值。很多实验结果证实炎性细胞因子存在单核苷酸多态性(SNPs),从而造成基因易感性不同,有可能是影响炎症发生、动脉粥样硬化(AS)及血栓形成等的重要因素,导致AMI的发生[3]。脂蛋白相关磷脂酶A2(Lp-PLA2)属于磷脂酶超家族成员之一,与血小板活化密切相关,被认为是CAD发病的独立危险因素[4]。国外有遗传学研究证实Lp-PLA2主要受基因因素的调控,尤其是PLA2G7多个位点的基因突变会明显影响Lp-PLA2的活性,影响CAD的发病风险[5];但由于存在地域和种族差异,关于PLA2G7与CAD之间的关系一直存有争议。通过采用聚合酶链反应-限制性片段长度多态性(PCR-FRLP)的检测方法,对在西安交通大学医学院第一附属医院收治的AMI患者及正常对照组人群的Lp-PLA2 rs1051931、rs1805017、rs16874954位点基因多态性进行检测,以期发现AMI的遗传危险因素以及探讨遗传基因与AMI发病的相关性,为临床治疗提供科学理论依据,现报告如下:
1 资料与方法
1.1 研究对象本项研究选取2017年1月~2018年2月于西安交通大学医学院第一附属医院心血管内科和急诊科就诊的176例AMI住院患者作为AMI组,年龄为37~83岁,平均年龄(58.46±11.72)岁,男性102例,女性74例。纳入标准:①所有患者均行心电图、冠状动脉造影(CAG)、心肌酶谱检查确诊为AMI;②符合中华医学会心血管病学分会关于AMI的诊断标准[6]:根据CAG证实至少1支冠状动脉(冠脉)分支狭窄≥50%;③汉族,在本地居住20年以上者。排除标准:①不符合上述纳入标准者;②合并心肌病、风湿性心脏病、主动脉夹层等心脏疾病者;③合并家族性高胆固醇血症、严重肝肾功能不全、自身免疫性疾病、肿瘤和急性或严重慢性感染性疾病者;④相互间有血缘关系者;⑤精神障碍不能合作者。另外选取同时期在我院健康体检中心进行体格检查的健康受试者191例作为对照组,年龄为26~86岁,平均年龄为(57.30±13.29)岁,包括男性106例,女性85例。对照组受试对象均为汉族,本地居住20年以上。本项研究获得我院伦理委员会的批准以及受试者或家属的知情同意。
1.2 方法
1.2.1 基线数据收集由西安交通大学医学院第一附属医院心内科医护人员以现场调查的方式,发放调查问卷并当场回收,以收集受试者的一般临床资料,包括民族、婚姻状况、文化程度、吸烟、饮酒、居住地、饮食习惯、疾病和用药史等。
1.2.2 标本采集采集患者空腹肘静脉血两份各5 ml,一份置于EDTA抗凝管中,离心,取上清,置于-80℃保存备用,用于DNA提取;一份用于检测生化指标。
1.2.3 血清DNA提取①取300 μl血液样本置于1.5 ml EP管中,加入800 μl TBP缓冲液,混匀后,3000 rpm离心5 min,弃上清;②加入500 μl TBP缓冲液和10 μl蛋白酶K,置于55 ℃水浴锅中孵育1 h;③振荡15 s,充分混匀后,离心,取上清,加入260 μl无水乙醇,充分混匀;④将上述混合液置于含有DNeasy spin column柱的收集管中,离心,弃收集管中的液体;⑤将DNeasy spin column柱置于新的收集管中,加入500 μl AW1缓冲液,离心,弃收集管中的液体;重复该步骤一次;⑥将DNeasy spin column柱置于EP管中,加入200 μl AE缓冲液,离心,弃收集管中的液体;重复该步骤一次;⑦将提取的DNA进行琼脂糖凝胶电泳,测定DNA浓度。
1.2.4 PCR-RFLP参照NCBI中Lp-PLA2位点信息使用Primer 5.0设计引物以包含目的位点,rs1805017位点(上游:5'-GAGCAGAGTAAAGA GAATAGTAA-3';下游:5'-TGGGCTGAGGACT TAGCCTCTTTAAGCCTC-3'),rs16874954位点(上游:5'-CAAGTAACTGGGATTACAGGCACAT G-3';下游:5'-CTTTACCTATATCATCCAGGTG-3');rs1051931(上游:5'-TCAAGATACCAAG CAAGAACAAGA-3';下游:5'-GGATGTAAAGC AGCAAAATTGA-3')。25 μl反应体系:1.5 μl MgCl2+2.5 μl 10×缓冲液+2.5 μl dNTP +1 μl DNA模板+各2 μl上下游引物+0.5 U Taq DNA酶+适量ddH2O 95 ℃预变性5 min,94 ℃ 30 s,58 ℃30 s,72 ℃ 30 s,40个循环;72 ℃延伸10 min。进行琼脂糖凝胶电泳,回收琼脂糖凝胶靶条带。采用ABI3730XL测序检测分析。
1.3 观察指标采用Beckman AU5821全自动生化分析仪(Beckman coulter 公司,美国)检测受试者入院24 h内血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白-胆固醇(HDL-C)、低密度脂蛋白-胆固醇(LDL-C)等部分血脂指标。血脂异常:TC>5.72 mmol/L,TG>1.70 mmol/L,HDL-C<1.0 mmol/L,LDL-C>3.64 mmol/L;或依靠服用降脂药维持正常血脂水平。
1.4 统计学分析本资料采用SPSS 18.0统计学软件进行处理,各组间差异比较采用方差分析。基因型或等位基因在不同分组之间的分布比较采用卡方检验,用单因素二元Logistic回归分析,来分析影响AMI发生的风险因素,筛选P<0.05的变量,以这些因素为自变量,AMI发生为因变量进行非条件多因素二元Logistic回归分析。最后的结果用优势比(OR)及95%置信区间(CI)来表示。OR>1表示该因素为危险因素,OR<1表示该因素为保护因素。P<0.05为差异具有统计学意义。
2 结果
2.1 两组受试者一般临床资料分析AMI组患者TC、TG、LDL-C水平明显高于对照组,而HDL-C水平低于对照组,另外有糖尿病史者、高血压史者的比例明显高于对照组受试者(P<0.05,表1)。
2.2 Hard-weinberg平衡检验Lp-PLA2基因rs1805017、rs16874954、rs1051931位点在对照人群中的基因分型符合Hard-weinberg平衡规律(rs1805017:χ2=0.120,P=0.730;rs16874954:χ2=1.11,P=0.293;rs1051931:χ2=2.79,P=0.095),表明对照人群的基因型分布可反映整体人群基因的分布情况。
2.3 Lp-PLA2基因rs1805017、rs16874954、rs1051931位点SNP分析rs1805017位点位于Lp-PLA2基因的第4外显子,含两个等位基因:92R(野生型)和92H(变异型),从而形成3种基因型:纯合子92RR、92HH和杂合子92RH。rs16874954位点位于Lp-PLA2基因的第9外显子,含两个等位基因:279V(野生型)和279F(变异型),从而形成3种基因型:纯合子279VV、279FF和杂合子279VF。rs1051931位点位于Lp-PLA2基因的第11外显子,含两个等位基因:379A(野生型)和379V(变异型),从而形成3种基因型:纯合子379AA、379VV和杂合子379AV。研究发现,测序结果都为单峰的是纯合基因型,AMI组患者和对照组患者中Lp-PLA2基因rs1805017位点GG、GA、AA基因频率和rs16874954位点CC、AC基因频率存在统计学差异,P<0.05。而两组受试对象rs1051931位点SNP组间比较无明显差异(P>0.05,表2)。

表1 两组受试者一般临床资料比较
2.4 AMI患者Lp-PLA2基因rs1805017、rs16874954位点SNP与血脂指标的关系分析深入分析Lp-PLA2基因rs1805017、rs16874954 SNP与AMI患者血脂水平的相关性,结果显示,rs1805017位点GA+AA基因型患者HDL-C水平明显低于GG基因型患者(P<0.05);而rs16874954位点AC基因型患者TG水平明显高于CC基因型患者(P<0.05);其余血脂水平在不同基因型患者之间并无统计学差异(P>0.05,表3)。
2.5 AMI易感性的单因素二元Logisitic回归分析对AMI患者Lp-PLA2基因rs1805017、rs16874954、rs1051931位点分别进行单因素二元Logisitic回归分析,结果显示,rs1805017、rs16874954位点SNP与AMI发病密切相关(P<0.05,表4)。
2.6 AMI易感性的多因素二元Logisitic回归分析在单因素分析的基础上,进一步进行多因素Logistic分析,以AMI(无=0,有=1)作为因变量,筛选P<0.05的因素作为自变量,结果显示,rs1805017位点突变与AMI易感性密切相关,但是rs16874954位点SNP与AMI发病未见相关性,提示rs1805017位点多态性可能是AMI发病的独立保护因素,而rs16874954位点突变可能与环境因素协调致病,同时,还发现HDL-C是AMI发病的独立危险因素(表5)。
3 讨论
目前大量研究已经证实血管内皮炎症反应和遗传因素都在AMI的发病过程中发挥了重要作用。动脉粥样硬化易损斑块破裂可引发血管内膜损伤和炎性因子大量释放,造成血管管腔狭窄或阻塞,引起心肌供血不足,严重者可致急性心肌梗死[7]。随着分子生物学和分子遗传学的不断进展,人们对AMI的发病机理也有了更深的理解,许多研究表明,大量炎性细胞因子与心血管疾病尤其是动脉粥样硬化的发生与发展密切相关[8],因此,对炎性细胞因子及其基因多态性和AMI发病相关性的研究具有重要的临床价值。
Lp-PLA2是由血管内膜浸润的巨噬细胞和淋巴细胞合成并分泌的一种磷脂酶超家族成员之一,大部分与LDL-C结合,少部分与HDL-C结合,通过水解氧化磷脂生成溶血磷脂胆碱和氧化非酯化脂肪酸,诱发慢性炎症反应的发生[9-11]。近几年新研发的Lp-PLA2抑制剂darapladib,已经被证实具有减少坏死的脂质中心面积以及巨噬细胞和泡沫细胞数量,使血管内易损斑块趋于稳定[12],但目前关于darapladib的三期临床研究结果并未显示出明显的改善主要观察终点作用[13]。有遗传学研究证实,Lp-PLA2的活性与基因因素密切相关,尤其是PLA2G7多个位点的基因突变会明显影响Lp-PLA2的活性,从而影响CAD的发病风险[14];但关于PLA2G7与CAD之间的关系一直存有争议。我们主要探讨西安地区rs1805017、rs16874954、rs1051931这三个位点的基因多态性。

表2 Lp-PLA2基因rs1805017、rs16874954位点SNP分析(n,%)

表3 AMI患者Lp-PLA2基因rs1805017、rs16874954位点SNP与血脂水平相关性分析

表4 Lp-PLA2基因多态性位点与AMI易感性单因素分析
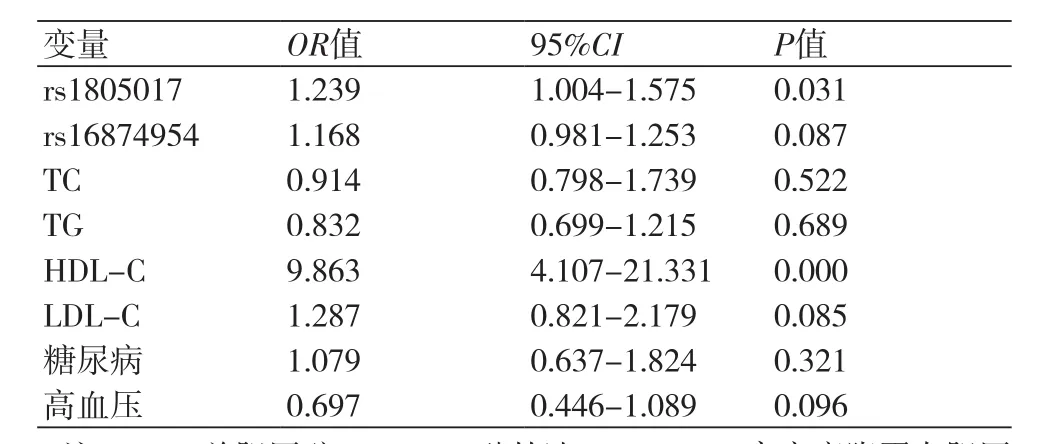
表5 Lp-PLA2基因多态性位点与AMI易感性多因素二元Logistic回归分析
日本学者首先发现Lp-PLA2基因rs16874954位点SNP是亚洲人群CAD发病的重要危险因素,并认为高加索人不具有此位点SNP[15];Iona Y Millwood等[16]学者经研究证实中国汉族人群V279F位点基因突变可显著降低Lp-PLA2的活性,加大冠脉病变风险。杜克大学医学中心通过一项大型研究显示,rs1805017、rs1051931位点的基因属于非同义突变,与CAD的发生有明显的相关性,但是这两个位点基因在CAD患者人群中的分布是降低的[17]。本项研究结果显示,西安地区人群中rs1805017、rs16874954、rs1051931三个位点主要存在92RR、92HH和杂合子92RH基因型、纯合子279VV和杂合子279VF基因型、纯合子379AA、379VV和杂合子379AV基因型。AMI人群中rs1805017位点GG型以及rs16874954位点CC型基因频率较健康对照人群明显降低;而两组受试人群rs1051931位点的基因型分布频率未见统计学差异,P>0.05。在此基础上,笔者又进一步分析了不同基因型AMI患者血脂水平的差异。rs1805017位点GA+AA基因型患者TG水平高于GG基因型患者,而HDL-C水平明显低于GG基因型患者;rs16874954位点AC基因型患者TG水平明显高于CC基因型患者;其余血脂水平在不同基因型患者之间并无统计学差异。这也说明了rs1805017、rs16874954位点的基因多态性影响AMI患者的血脂水平,提示这部分基因分型可作为高胆固醇血症人群AMI发病风险的预测指标。通过单因素分析,rs1805017、rs16874954位点SNP与AMI发病密切相关;调整患者血脂水平、糖尿病史、高血压史等因素后,rs1805017位点SNP仍然与AMI易感性密切相关,但是rs16874954位点SNP与AMI发病未见相关性;提示rs1805017位点多态性可能是AMI发病的独立保护因素,而rs16874954位点突变可能与环境因素协调致病。
综上所述,本项研究首次发现西安地区人群Lp-PLA2基因rs1805017、rs16874954多态性位点与急性心肌梗死的发生有关,而rs1051931位点SNP与AMI的发生可能无直接相关性。虽然结果与国内外部分研究结果不一致,据推测可能是由于样本量偏少、存在种族和地区差异性等因素的影响,但是也从基因水平间接说明Lp-PLA2基因突变可能对AMI患者血脂水平有一定的影响,建议存在Lp-PLA2基因位点突变的人群注意控制血脂水平,以降低急性心肌梗死的发病风险。

