麦冬皂苷介导AMPK/Akt/mTOR通路对糖尿病大鼠心肌细胞自噬的影响
饶小娟,吴毓敏,王彦
糖尿病是人类最常见的慢性疾病之一,预计至2030年全球糖尿病患者数量将达4.39亿,其中2型糖尿病患者超过糖尿病总人数的90%。糖尿病心血管并发症是造成患者死亡的重要原因,占糖尿病相关死亡总人数的70%以上。糖尿病性心肌病(DCM)是糖尿病患者重要的心脏并发症,其病理特征为心肌细胞肥大、变性、坏死以及胞外间质胶原沉积和纤维化,为造成心力衰竭的关键原因[1,2]。研究发现[3-5],氧化应激和自噬相互作用在DCM的发生发展中发挥重要作用。DCM发生的主要原因为氧自由基(ROS)的增多,ROS达到一定水平后即可激活腺苷酸活化蛋白激酶(AMPK)信号通路,导致下游丝氨酸的磷酸化水平增加,影响正常的胰岛素信号通路,进而引起胰岛素抵抗的发生。Akt/mTOR信号通路为调控细胞自噬的重要通路。麦冬为治疗糖尿病的常用中药,而麦冬皂苷为麦冬的主要有效成分之一[6]。故本研究通过建立糖尿病大鼠模型,探究麦冬皂苷对模型大鼠心肌细胞自噬及AMPK/Akt/mTOR通路的影响,以期为麦冬皂苷的临床应用提供指导。
1 材料与方法
1.1 实验动物SPF级8周龄雄性C57BL/6J大鼠58只,体重18~20 g,购自北京维通利华实验动物技术有限公司。本研究经郑州大学第五附属医院实验动物伦理委员会批准。
1.2 主要试剂高脂饲料60% kcal%(D12492)、基础饲料10% kcal%(D12450B)购自美国Research Diets公司;麦冬皂苷(纯度90%)由本室提取;罗格列酮购自太极集团重庆涪陵制药厂;链脲佐菌素(STZ)购自北京索莱宝生物公司;苏木精-伊红(HE)染色液购自北京索莱宝公司;组织蛋白提取试剂购自南京凯基生物公司;一抗羊抗鼠AMPK、p-AMPK、Akt、p-Akt单克隆抗体购自美国Santa Cruz公司;一抗兔抗鼠Beclin1、LC3-Ⅰ/Ⅱ、mTOR、p-mTOR单克隆抗体购自美国Abgent公司;二抗山羊抗兔IgG溶液购自美国Sigma公司。
1.3 动物模型制备2型糖尿病模型建立参考梁海霞等[7]方法。所有大鼠适应性饲养1周,空腹12 h后经尾静脉采血测定血糖,称体后,随机分为对照组(8只)和2型糖尿病模型组(50只)。模型组大鼠给予高脂饮食60% kcal%,对照组大鼠给予基础饮食10% kcal%,饲养3个月,对大鼠进行腹腔葡萄糖耐量实验(IPGTT)和腹腔胰岛素耐量实验(IPITT)。对糖尿病模型组中出现存在胰岛素抵抗的大鼠,空腹6 h后,腹腔注射给予100 mg/kg新配置的STZ(用0.1 mol/L柠檬酸钠缓冲液溶解),STZ注射5 d后,禁食3 h,经尾静脉采血测定随机血糖,血糖浓度≥250 mg/dl定义为糖尿病,纳入后续研究。对照组腹腔注射给予等量柠檬酸钠缓冲液。
1.4 分组与给药处理对照组大鼠继续给予对照饮食10% kcal%;糖尿病模型组随机分为模型组、罗格列酮(阳性药物)组和麦冬皂苷低、中、高剂量组,每组10只。麦冬皂苷给药剂量参考宁萌等[6]方法。阳性药物组灌胃给予2 mg/kg罗格列酮,麦冬皂苷低、中、高剂量组分别灌胃给予50、100、200 mg/kg麦冬皂苷,对照组和模型组灌胃给予等量生理盐水,1/d。连续给药6周后,将大鼠处死,剖胸取出心脏,称重后4 ℃预冷生理盐水冲洗,取左心室心肌组织于正中分成两份,一份于4%多聚甲醛溶液中固定,一份于液氮中冻存。
1.5 生化及检查指标IPGTT和IPITT检测:大鼠高脂饲养3个月时,行IPGTT和IPITT检测。IPGTT:大鼠禁食12 h后,腹腔注射给予1 g/kg葡萄糖,分别在注射后0、15、30、60、120 min经尾静脉采血测定血糖,绘制大鼠IPGTT血糖-时间曲线,利用SPSS 20.0软件计算出曲线下面积(AUC)。IPITT:大鼠禁食4 h后,腹腔注射给予1 U/kg胰岛素,分别在注射后0、15、30、60、120 min经尾静脉采血测定血糖,绘制大鼠IPITT血糖-时间曲线,利用SPSS 20.0软件计算出曲线下面积(AUC)。血清学指标检测:大鼠处死前,过夜禁食12 h后,经颈静脉采血测定血糖、三酰甘油、总胆固醇等血清学指标。采用酶联免疫吸附试验测定空腹胰岛素水平。血压及心率检测:大鼠处死前,采用大鼠尾动脉血压测量仪分别测定每只大鼠尾动脉血压和心率,重复测定3次,间隔2 min测1次,求取平均值。超声心动图检测:大鼠处死前,于腹腔注射10%水合氯醛将大鼠麻醉,仰卧固定,胸前备皮并涂抹超声耦合剂,采用Vevo770高分辨率小动物超声仪测定大鼠左心室收缩末期内径(VESD)、左心室舒张末期内径(LVEDD)、左心室短轴缩短率(FS),并计算出左心室射血分数(LVEF);分别利用脉冲多普勒频谱技术与连续多普勒频谱技术测定二尖瓣舒张早期血流速度峰值(E)、二尖瓣舒张晚期血流速度峰值(A)、E/A比值、E波减速时间(EDT)与等容舒张时间(VRT)。
1.6 HE染色检测心肌病理变化心肌组织在4%多聚甲醛溶液中固定24~48 h后;常规脱水、石蜡包埋;以4 μm厚度切片,65℃烤箱中烤片1 h;用二甲苯脱蜡、梯度乙醇水化;苏木精液染色5 min;水冲洗后,1%盐酸乙醇分化5 s;水冲洗、乙醇处理后,酸化伊红溶液染色2 min;乙醇脱水、二甲苯透明;用中性树胶封片、烘烤过夜。用倒置相差显微镜观察并拍照。
1.7 western blot检测心肌自噬相关蛋白及AMPK、Akt、mTOR蛋白表达取出液氮冻存的心肌组织,充分研磨,加入适量蛋白缓冲液,采用常规方法提取蛋白,BCA法进行蛋白定量,调好蛋白浓度。取蛋白样品50 μg,与上样缓冲液等体积混合;SDS-PAGE电泳;转至NC膜,浸入含5%脱脂奶粉TBST溶液,避光封闭1 h;TBST洗涤后,置于一抗稀释液(AMPK、p-AMPK、Akt、p-Akt稀释比为1:200,Beclin1、LC3-Ⅰ/Ⅱ、mTOR、p-mTOR稀释比为1:300)中,4 ℃孵育过夜;TBST洗涤后,浸入二抗稀释液(1:3000),室温缓慢振荡孵育1 h;TBST洗涤后,滴加ECL发光液,曝光3次,选取重叠值。蛋白条带灰度值用Image J软件进行分析。用β-actin作为内参蛋白。
1.8 统计学分析本研究利用SPSS 20.0统计软件进行数据处理,计量资料采用(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。当P<0.05时,差异有统计学意义。
2 结果
2.1 2型糖尿病大鼠模型建立情况与对照组比较,糖尿病模型组大鼠出现多饮、多食、多尿、消瘦等症状。死亡情况:模型组大鼠死亡2只,麦冬皂苷低、中剂量组各死亡1只,最终共有54只大鼠进行后续实验。高脂饮食3个月后,IPGTT和IPITT检测证实了糖尿病模型组大鼠出现胰岛素抵抗情况。IPGTT结果显示,糖尿病模型组大鼠血糖AUC显著高于对照组(P<0.05)。IPITT结果亦显示,糖尿病模型组大鼠血糖AUC显著高于对照组(P<0.05)(图1、表1)。
2.2 麦冬皂苷对糖尿病大鼠代谢指标及血压的影响各组大鼠的血压、体重之间的差异不具有统计学意义(P>0.05)。与对照组比较,模型组大鼠空腹血糖、空腹胰岛素、心率、三酰甘油、总胆固醇、心脏重量显著提高(P<0.05);与模型组比较,麦冬皂苷干预后大鼠空腹血糖、空腹胰岛素、心率、三酰甘油、总胆固醇、心脏重量显著降低(P<0.05),且具有剂量依赖关系(表2)。
2.3 麦冬皂苷对糖尿病大鼠左心室结构的影响HE染色结果发现,与对照组比较,模型组大鼠左心室室壁增厚,心肌细胞肥大、变形、排列紊乱,细胞间隙增加,细胞核大小不一致;与模型组比较,高剂量麦冬皂苷或罗格列酮干预后,大鼠左心室肥大症状有所改善(图2)。

图1 高脂饮食下大鼠出现胰岛素抵抗情况

表1 大鼠血糖曲线下面积(AUC)(x±s)

表2 各组大鼠代谢指标及血压检测结果(x±s)
2.4 麦冬皂苷对糖尿病大鼠心脏功能的影响超声心动图检测结果显示,与对照组比较,模型组大鼠心脏E/A比值显著降低、EDT和IVRT显著延长(P<0.05);与模型组比较,麦冬皂苷各剂量组大鼠心脏E/A比值显著升高、EDT和IVRT显著缩短(P<0.05),且具有剂量依赖关系(表3)。
2.5 麦冬皂苷对糖尿病大鼠心脏组织自噬相关蛋白表达的影响western blot结果显示,与对照组比较,模型组大鼠心脏组织Beclin1/GAPDH、LC3-Ⅱ/LC3-Ⅰ蛋白表达比值显著降低(P<0.05);与模型组比较,麦冬皂苷各剂量组大鼠心脏组织Beclin1/GAPDH、LC3-Ⅱ/LC3-Ⅰ蛋白表达比值显著升高(P<0.05),且具有剂量依赖关系(图3、表4)。

图2 各组大鼠心脏左心室横切面HE染色结果(×100)
2.6 麦冬皂苷对糖尿病大鼠心脏组织AMPK、Akt、mTOR及其磷酸化水平的影响western blot结果显示,与对照组比较,模型组大鼠心脏组织p-AMPK/AMPK蛋白表达比值显著升高、p-Akt/Akt与p-mTOR/mTOR蛋白表达比值显著降低(P<0.05);与模型组比较,麦冬皂苷各剂量组大鼠心脏组织p-AMPK/AMPK蛋白表达比值显著降低(P<0.05),p-Akt/Akt、p-mTOR/mTOR蛋白表达比值显著升高(P<0.05),且具有剂量依赖关系(图4、表5)。
3 讨论
糖尿病是一种很常见的非传染性疾病,糖尿病性心肌病(DCM)是导致糖尿病患者死亡的重要原因。研究发现[8],引发DCM的主要原因为心肌细胞能量代谢失常,即葡萄糖代谢减少、脂代谢增加,造成心肌脂毒性损伤而引起氧化应激、炎症反应、线粒体功能失调、心肌凋亡坏死等病理学变化,最终引发心肌病理性肥厚和心功能障碍。DCM发病初期难以诊断,治疗常被延误,造成预后不良,因此DCM早期防治极为重要[9]。本研究经高脂饮食联合STZ诱导成功建立2型糖尿病模型,大鼠出现高血糖、高血脂、胰岛素抵抗等典型症状,并在此基础上用麦冬皂苷进行干预治疗。结果发现,模型组大鼠出现左心室肥大、心肌收缩功能下降等明显心肌损伤,而麦冬皂苷干预后可明显改善糖尿病引起的心肌损伤。
自噬是真核生物独特的修复机制,其通过消化受损的蛋白质与细胞器,在应激状态下,消化自身成分为细胞提供养分与能量,进而保证细胞内部稳态与结构完整。自噬是一种精细的生物学过程,主要包括微自噬、巨自噬、分子伴侣介导的自噬三种类型。微自噬指溶酶体直接吞噬并降解胞质成分;巨自噬指内质网包裹待降解物后与溶酶体融合,从而使其内容物降解;分子伴侣介导的自噬指热休克蛋白识别胞质成分后送至溶解体降解。目前有关巨自噬的研究最多,自噬异常可导致多种疾病的发生[10,11]。心肌细胞自噬对维持正常的心脏大小、结构及功能至关重要[12],麦冬皂苷的心脏保护作用是否通过影响心肌细胞自噬而实现,目前尚未研究。自噬过程需要自噬因子的参与。Beclin1是哺乳动物第一个被发现的自噬基因,其与Vps34结合后促进自噬小体的形成,为细胞自噬的正向调节因子[13]。微管相关蛋白1轻链3(LC3)在进化过程中高度保守,为自噬体产生的标志。LC3包括Ⅰ型与Ⅱ型,LC3-Ⅰ位于胞浆内,其与磷脂酰乙醇胺结合后形成LC3-Ⅱ,LC3-Ⅱ定位于自噬体膜,与Beclin1表达相一致,常被用于衡量细胞自噬的程度[14]。本研究发现,模型组大鼠心肌Beclin1、LC3-Ⅱ/LC3-Ⅰ水平显著下调,麦冬皂苷干预后明显上调了心肌Beclin1、LC3-Ⅱ/LC3-Ⅰ的表达,说明2型糖尿病大鼠的心肌自噬程度明显降低,心肌肥厚,而麦冬皂苷干预可促进心肌自噬,改善心脏功能。

表3 各组大鼠超声心动图检测结果(x ±s)
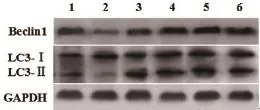
图3 麦冬皂苷对糖尿病大鼠心脏组织Beclin1、LC3表达的影响

表4 大鼠心脏组织Beclin1/GAPDH、LC3-Ⅱ/LC3-Ⅰ比值(x±s)
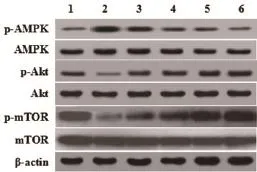
图4 麦冬皂苷对糖尿病大鼠心脏组织AMPK、Akt、mTOR及其磷酸化水平的影响

表5 大鼠心脏组织p-AMPK/AMPK、p-Akt/Akt、p-mTOR/mTOR比值(x±s)
腺苷酸活化蛋白激酶(AMPK)是一种丝/苏氨酸激酶,由α、β、γ三个亚单位组成,其通过感知能量状态进而维持细胞能量稳态,在细胞生长、自噬、凋亡等生物学过程中发挥重要作用。有研究发现[15,16],糖尿病可造成心肌AMPK磷酸化水平下调,而AMPK介导的自噬水平也下调。哺乳动物雷帕霉素靶蛋白(mTOR)也是一种丝/苏氨酸激酶,在正常生理条件下,mTOR下调自噬通路,以维持基础自噬水平。在细胞饥饿状态下,mTOR功能受到抑制,自噬通路AMPK/mTOR被激活[17]。蛋白激酶B(Akt或称PKB)同样也是一种丝/苏氨酸蛋白激酶,它可协同磷脂酰肌醇依赖性蛋白激酶1/2促进三磷酸磷脂酰肌醇与其自身结合,Akt由胞浆转移至质膜并发生磷酸化,Akt活化后可激活下游蛋白mTOR[18]。AMPK/mTOR与Akt/mTOR是两条经典的自噬信号通路[19,20]。本研究发现,糖尿病大鼠心脏组织AMPK的磷酸化水平显著升高、Akt与mTOR的磷酸化水平显著降低,麦冬皂苷干预后心脏组织p-AMPK/AMPK比值显著降低、p-Akt/Akt和p-mTOR/mTOR比值显著升高,说明麦冬皂苷可能通过促进AMPK磷酸化,抑制Akt和mTOR磷酸化,进而增强心肌的自噬程度。
综上所述,本研究结果表明麦冬皂苷可能通过活化AMPK,抑制Akt/mTOR通路,促进心肌组织自噬,同时发现自噬相关蛋白Beclin1、LC3-Ⅱ表达上调,从而改善糖尿病引起的大鼠心脏功能受损,为麦冬皂苷临床治疗糖尿病性心肌病提供一定的参考价值。

