急性ST段抬高型心肌梗死多支病变患者不完全血运重建与完全血运重建治疗策略的对比
许晓明,李超,裘淼涵,文亮,王贺阳,李毅,程康,3
急性ST段抬高型心肌梗死(STEMI)是世界范围内常见的心血管急危重症之一,发病率居高不下,致死、致残率高[1,2]。经皮冠状动脉介入术(PCI)因成功率高、不良反应少、长期主要不良心血管事件(MACE)发生率低,成为STEMI治疗的首选方案[3,4]。冠状动脉(冠脉)多支病变(MVD)指冠脉存在2支或以上主要血管(直径≥2 mm)狭窄≥70%[5,6]。有研究提示约40%~65%的STEMI患者存在MVD。与单支病变相比,STEMI多支病变患者近期及远期MACE不良事件的发生率明显增加。尽管HORIZONSAMI[10]、PRAMI[11]、Cvlprit[12]等研究及2015年美国更新的STEMI指南[13]与2017年欧洲心脏病学会(ESC)STEMI管理指南[14]均推荐对STEMI多支病变患者,在血流动力学稳定的情况下可考虑同台或择期干预非梗死相关血管(Ⅱb B,Ⅱa A)(完全血运重建),但由于上述研究均未包含中国人群数据,前述指南推荐是否可以完全适用于中国STEMI多支病变患者证据仍不充分。本研究旨在探讨对比不完全血运重建及完全血运重建策略对中国STEMI多支病变患者预后的影响。
1 资料与方法
1.1 研究对象本研究为回顾性队列研究,收集录入2009年1月1日~2014年6月30日间于空军军医大学附属西京医院心血管内科监护室住院并诊断为STEMI多支病变的患者。
1.2 纳入标准及排除标准纳入标准:①年龄≥18岁;②胸痛症状发作≤12 h;③心电图提示2个或2个以上连续导联ST段抬高≥0.1 mV或新出现左束支传导阻滞;④冠脉存在2支或以上主要血管(直径≥2 mm)明显狭窄≥70%;⑤发病12 h以内行急诊PCI开通梗死相关血管。排除标准:①心源性休克;②冠脉造影提示左主干狭窄≥50%;③既往行冠脉旁路移植术(CABG);④6个月内卒中病史(包括出血性和缺血性卒中);⑤PCI术前给予溶栓或抗凝治疗;⑥严重多脏器功能衰竭,肾功能、肝功能衰竭,慢性阻塞性肺疾病等。经筛选,最终纳入分析326例STEMI并多支病变患者,根据其治疗策略分为不完全血运重建组(195例)和完全血运重建组(131例)。
1.3 临床资料收集记录符合纳入及排除标准患者的年龄、性别、既往病史(包括心肌梗死病史、高血压病史、糖尿病病史和高脂血症史)、吸烟史、入院Killip分级、血压、血红蛋白、估算的肾小球滤过率、左室射血分数、心肌梗死起病时间、多支病变类型、多支病变血管分布、梗死部位、梗死相关血管、每例患者植入支架个数、支架总长度、支架平均直径等信息。
1.4 研究终点及相关定义本研究主要研究终点为首次(或二次)PCI术后36个月内出现的MACE(为包括心源性死亡、再发心肌梗死、缺血驱动血运重建、心力衰竭的复合终点)。次要研究终点为主要终点各独立组份及全因死亡、顽固性心绞痛、全部出血事件(BARC 1~5型)等。冠状动脉多支病变指冠状动脉造影提示冠状动脉存在2支或以上主要血管(直径≥2 mm)狭窄≥70%。缺血驱动血运重建指包括因再发或持续性缺血症状和/或缺血影像学证据而导致的靶血管血运重建和非靶血管血运重建,血运重建方法包括PCI和CABG等。全部出血事件采用出血学术研究协会(BARC)定义,包括符合BARC 1~5型标准的任何出血事件。估算肾小球滤过率采用MDRD简化计算公式计算:eGFR(ml/min·1.73 m2)= 175×[ Scr(μmol/L)]-1.154×年龄-0.203(女性×0.742)。
1.5 随访方法随访时间为首次或二次PCI术后1、2和3年,包括门诊随访、电话随访、书信随访及调阅患者门诊与住院资料。主要记录患者终点事件信息。
1.6 统计学方法符合正态分布的计量资料以均数±标准差(±s)表示,两组比较采用成组t检验,不符合正态分布者则以中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,两组比较采用Mann-Whitney U检验;计数资料以频数和百分率(n,%)表示,两组比较采用Pearson χ2检验或者Fisher确切概率法。应用Kaplan-Meier分析比较两组MACE发生率,以Log-rank检验评价其差异显著性。本研究根据年龄、性别、是否合并糖尿病、是否合并高血压、eGFR水平、吸烟与否、梗死部位、多支病变类型、GRACE评分等,对STEMI多支病变患者进行亚组分层分析。所有假设检验均采用双侧检验,P≤0.05为差异有统计学意义。本研究数据采用SPSS 24.0及R 3.4.3软件进行统计学分析。
2 结果
2.1 一般临床资料不完全血运重建组与完全血运重建组的年龄、性别、既往病史、是否吸烟、入院Killip分级、血压、入院主要实验室检查、左室射血分数、起病时间、GRACE评分、梗死部位以及梗死相关血管分布均无统计学差异(P>0.05)。多支病变类型中,不完全血运重建组两支病变占该组总患者数60.5%,高于完全血运重建组的42.7%(P=0.002)。病变血管分布中,右冠状动脉及前降支受累在两组的分布无明显差异,但完全血运重建组左旋支病变比例高于不完全血运重建组(81.7%vs. 69.7%,P=0.015)。此外,完全血运重建组人均植入支架个数 [(3.17±1.10)个vs.(1.41±0.61)个,P<0.001] 及人均总支架长度[(84.13±31.56)mmvs.(38.15±18.80)mm,P<0.001)]显著高于不完全血运重建组,但两组支架平均直径无明显统计学差异(P=0.855)(表1~2)。
2.2 终点事件经过3年随访观察,不完全血运重建组MACE累计发生60例,占该组患者数的30.8%,完全血运重建组MACE累计发生23例,占该组患者数的17.6%,两组比较具有显著统计学差异(HR=0.51,95%CI:0.31~0.82,P=0.005)(图1)。且从终点事件表可以看出两组间差异主要是由于不完全血运重建组有更多的心源性死亡和心力衰竭事件而造成。次要终点事件中,完全血运重建组心源性死亡(1.5%vs. 7.7%,P=0.029)、心力衰竭(1.5%vs.7.2%,P=0.031)以及全因死亡(2.3%vs. 9.2%,P=0.022)发生率显著低于不完全血运重建组,而两组再发心肌梗死、缺血驱动血运重建、顽固性心绞痛以及全部出血事件(BARC 1~5)发生率则无显著差异(P>0.05)(表3)。

表1 不完全血运重建组与完全血运重建组患者临床基线资料比较
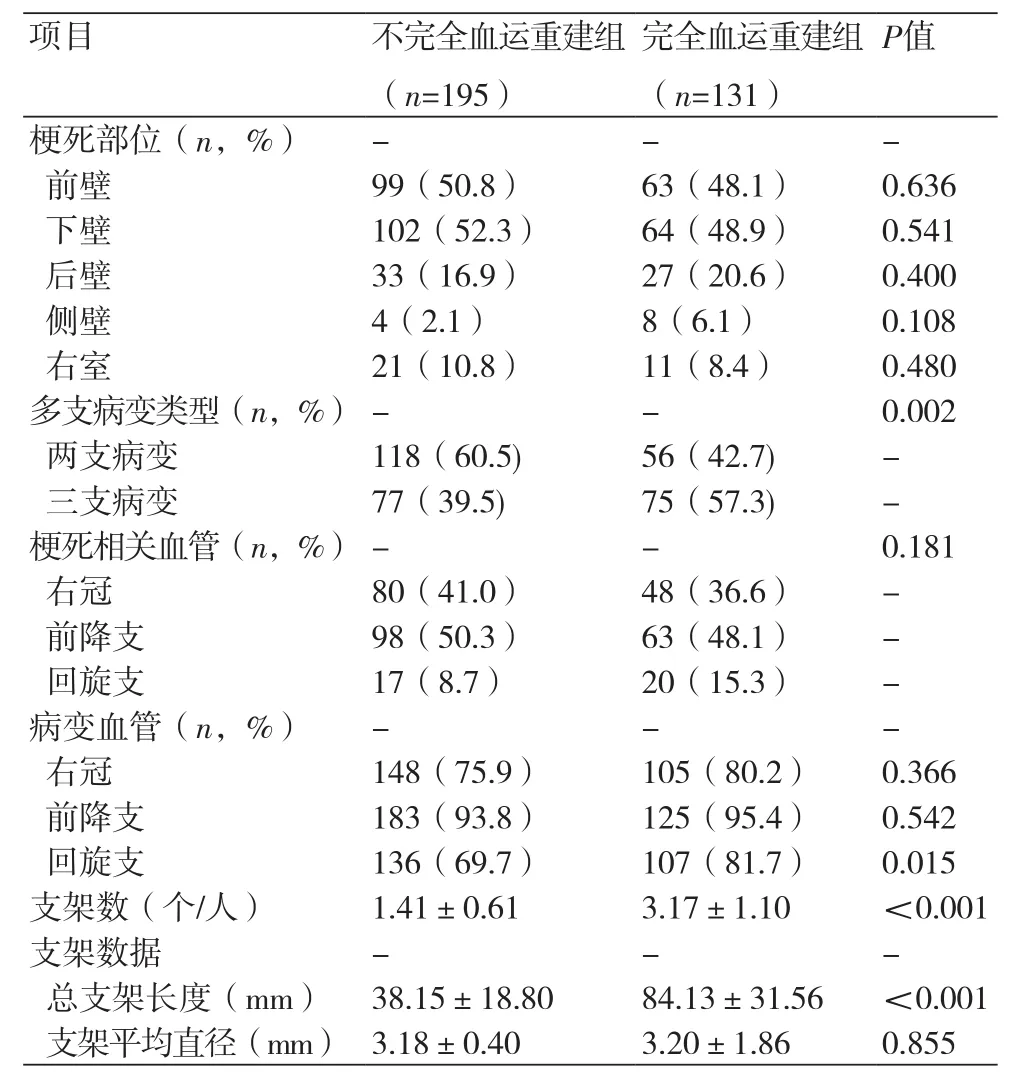
表2 不完全血运重建组与完全血运重建组患者病变特征比较

图1 不完全血运重建组与完全血运重建组MACE的Kaplan-Meier曲线
2.3 亚组分析亚组分层分析结果显示,所有亚组MACE发生率的对比均与总研究人群一致(HR<1.0,P>0.05或P<0.05)。同时,治疗策略与不同层间的交互作用检验的P值均>0.05,尚不能认为不完全血运重建与完全血运重建的治疗策略的MACE发生率在不同亚组层间存在差异(图2)。
3 讨论
本研究为单中心回顾性队列研究。结果显示,对于STEMI多支病变患者,相比不完全血运重建策略,完全血运重建的策略能够显著降低PCI术后3年MACE发生风险。且在各亚组分层分析中,该趋势亦持续存在。
本研究结论与PRAMI[11]、Cvlprit[12]等多中心随机对照研究及2015年美国STEMI指南更新[13]与2017年ESC STEMI管理指南[14]对STEMI多支病变患者血运重建策略的推荐一致,证实了中国STEMI多支病变人群行急诊PCI干预梗死相关血管,同台或择期干预非梗死相关血管的完全血运重建策略的适用性。
需指出DANAMI-3-PRIMULTI研究[15]中完全血运重建组与不完全血运重建组缺血驱动血运重建事件发生率分别为5%与17%(P<0.0001),而两组全因死亡和非致死性心肌梗死发生率无显著差异,考虑其MACE发生风险的降低[HR=0.56,95%CI:(0.38~0.83),P=0.004]主要是由不完全血运重建组在首次PCI术后3年内有更多的缺血驱动血运重建事件造成。Compare-Acute研究同样有这样的情况[16],此种情况的出现一定程度降低了STEMI多支病变患者行完全血运重建策略的临床获益。本研究将冠状动脉多支病变定义为冠状动脉造影发现冠状动脉存在2支或2支以上主要血管(直径≥2 mm)狭窄≥70%。而PRAMI、DANAMI-3-PRIMULTI和Compare-Acute等研究将冠状动脉多支病变血管狭窄程度界值定义为50%。如此,本研究不完全血运重建组中未干预的、狭窄程度≥70%的病变,未来可能有更高的缺血事件发生风险。本研究结果尽管提示两组不完全血运重建组缺血驱动血运重建事件发生率略高于完全血运重建组,但两者并无统计学差异。同时,不完全血运重建组心源性死亡和心力衰竭事件发生率显著高于完全血运重建组,提示完全血运重建组患者临床获益可能由更少的心源性死亡和心力衰竭驱动而非缺血驱动血运重建。因此,更加确证中国STEMI多支病变人群行完全血运重建的临床获益。

表3 不完全血运重建组与完全血运重建组3年临床结局的比较

图2 完全血运重建与不完全血运重建3年MACE亚组分析
Sorajja等[17]的研究提示急性心肌梗死并三支病变患者PCI术后1年死亡率及MACE(包括死亡、再发心肌梗死、卒中、靶血管血运重建)发生率显著高于单支或两支病变,三支病变是PCI术后1年死亡及MACE的强预测因子。本研究基线资料中完全血运重建组患者三支病变比例显著高于不完全血运重建组(57.3%vs. 39.5%,P=0.002),而对该组患者采用完全血运重建的策略3年MACE发生风险更低,进一步说明完全血运重建策略在我国STEMI多支病变患者中的临床获益。
既往有研究提示STEMI所致的部分心肌休眠/顿抑可促进心力衰竭的发生[18],而本研究提示完全血运重建的策略可使STEMI多支病变患者心力衰竭的发生风险降低约80%。推测可能原因为完全血运重建的策略(同台或择期对非梗死相关血管进行血运重建)可最大限度减少休眠/顿抑心肌的数量,同时改善心肌梗死“分水岭”区域心肌血供,减少STEMI后心力衰竭的发生,改善患者临床结局[19]。
本研究为单中心回顾性研究,选择偏倚及信息偏倚难以避免。为减少偏倚,在本研究评价终点事件过程中,要求在缺血驱动血运重建发生前必须有明确相关病史资料,如急性冠脉综合征发作的症状及体征或影像学检查发现有明确缺血证据,心力衰竭事件则需存在心衰住院史或影像学证据。针对部分基线资料有不同程度缺失,为最大限度保留原始数据的精度,并且使研究不偏离“真实世界”的属性,在进行数据分析之前,剔除了缺失较多的变量,且未对保留的含缺失值的变量进行填补。
尽管如此,本研究未能有效记录患者PCI术中数据、出院及院外用药情况等。随访过程中,部分患者不能准确提供终点事件相关信息,这些问题的存在一定程度上会对研究结果产生影响。此外,2017年ESC STEMI管理指南建议对延迟就诊的STEMI患者(胸痛症状发作后12~48 h),可考虑常规行直接PCI(Ⅱa B)。而本研究仅纳入了起病12 h内行首次PCI的STEMI多支病变患者,致使纳入分析的患者数量(总体样本量)减少。最后,本研究中完全血运重建策略实际包括了三种,即急诊PCI干预梗死相关血管后同台干预非梗死相关血管组(MV-PCI)、7 d内择期干预非梗死相关血管组(7 d staged-PCI)及8~60 d间择期干预非梗死相关血管组(60 d staged-PCI),但本研究并未明确主要研究获益具体由哪种治疗策略所驱动。
在本单中心回顾性研究中,相比不完全血运重建策略,采用完全性血运重建策略可显著降低中国STEMI多支病变患者MACE发生风险。因此,对STEMI多支病变患者,可积极行急诊PCI干预梗死相关血管后同台或择期干预非梗死相关血管的完全血运重建策略,以最大限度改善患者预后,但该结果仍需国内多中心、大样本的随机对照研究进一步证实。

