两种仪器定量检测HIV-1病毒载量比较研究*
李丽华,余婷婷,丁彩梅,张润武,杨冬梅 ,王红英, 白 经 ,普 冬
(云南省昆明市第三人民医院检验科 650041)
随着艾滋病(AIDS)防治工作的不断强化,AIDS实验室检测技术也在不断发展,根据《艾滋病资料手册》规定[1],接受治疗的AIDS患者必须定期检测病毒载量,人类免疫缺陷病毒(HIV)载量检测被认为是目前预示疾病演变、提示开始临床治疗和评估疗效的有效指征[2]。同时HIV病毒载量检测还可作为灵敏的HIV早期感染的诊断方法[3-4],特别是对HIV阳性产妇的婴儿和处于HIV抗体窗口期的感染者等特殊免疫性个体具有较好的提示作用[5-6]。核酸高精度定量检测仪是获得准确临床实验室结果的关键因素,减少了核酸手工提取中容易出现的操作失误,增加了核酸提取的一致性和重复性[7]。当前常用的核酸高精度定量检测技术包括雅培m2000全自动分析系统、罗氏AmpliPrep/TaqMan全自动分析仪、梅里埃Nuclisens EasyQ HIV-1及西门子公司的Versant HIV-1。国内已有关于几种检测技术的相关研究[8],但同时对雅培m2000全自动分析系统和罗氏AmpliPrep/TaqMan全自动分析仪进行HIV-1病毒载量定量检测的研究鲜见报道。本研究通过采用雅培m2000全自动分析系统和罗氏AmpliPrep/TaqMan全自动分析仪高精度定量检测方法,对30例HIV-1病毒载量结果不同患者标本进行检测比较,现报道如下。
1 资料与方法
1.1一般资料 本研究涉及的标本为2017年1-6月到本院就诊的,免疫印迹法HIV-1确证试验结果为阳性的AIDS患者标本30例。所选取患者的HIV-1病毒载量从0~105copy/mL均有覆盖。
1.2标本采集 采集患者血液后立即放入有乙二胺四乙酸三钾试管中,充分混匀。然后将全血在4 h内离心并分离血浆,存放于-70 ℃冰箱内,以备检测HIV-1病毒载量使用。
1.3仪器与试剂 采用雅培m2000全自动分析系统、Abbott RealTime HIV-1 Kit检测试剂盒及罗氏AmpliPrep/TaqMan全自动分析系统、罗氏AmpliPrep/TaqMan HIV-1 Test V2.0试剂盒同时进行检测。所有检测试剂盒均在有效期内,操作严格按照试剂盒和仪器说明书进行。
1.4方法
1.4.1雅培m2000全自动分析系统检测方法 Abbott m2000sp系统采用多种操作方法从血浆标本中纯化核酸,采用Abbott内部研发的化学试剂,以未包被的氧化铁磁珠作为捕获介质从0.6 min血浆或血清标本中提取RNA,m2000sp将磁珠、细胞裂解缓冲液和患者标本混合,将标本在50 ℃细胞裂解缓冲液中孵育20 min,细胞裂解缓冲液裂解细胞并释放出RNA,RNA被吸附到磁珠上,通过优化磁铁吸附过程在单管中进行磁珠捕获,清洗磁珠以便除去未结合的血浆或血清标本组分,重复捕获和清洗过程,从而除去其他多余的标本组分、污染物和抑制剂,然后在75 ℃低水平磷酸盐缓冲液中孵育20 min,从磁珠上洗脱获得RNA,加水孵育,将缓冲液稀释至极低水平,磁珠被磁铁吸附,核酸被转移到96深孔板中,获得聚合酶链反应(PCR)反应板,密封并装入Abbott m2000rt进行实时PCR检测。
1.4.2罗氏AmpliPrep/TaqMan全自动分析仪检测方法 AmpliPrep/TaqMan仪器可自动制备标本。该程序可以处理850 μL血浆标本。在稍高的温度下,蛋白酶和裂解液/结合缓冲液与标本孵育,裂解HIV-1病毒颗粒,释放出核酸,并保护HIV-1 RNA免受血浆中RNA酶的破坏。蛋白酶和已知拷贝数的HIV-1定量标准物QS带盔甲RNA与裂解试剂和磁性玻璃珠一起加入到每一份标本中。混合物经孵育后,HIV-1 RNA和HIV-1 QS RNA结合于磁性玻璃珠表面。未结合的一些物质,如盐、蛋白质及其他细胞杂质经洗涤磁性玻璃珠后被除去。经磁性玻璃珠分离和完全洗涤步骤,吸附的核酸在较高温度下洗脱下来。样品处理后释放出来的HIV-1 RNA及HIV-1 QS RNA被加入至扩增混合物中,并被转移至COBAS TaqMan分析仪,HIV-1靶RNA及HIV-1 QS RNA随之进行反转录、扩增,并经切除靶特异的和QS特异的双标记寡核苷酸探针完成实时定量检测。
1.5统计学处理 采用SPSS20.0软件包进行数据处理,并进行绘图和比较分析,两组间计量资料采用配对t检验,相关分析采用Pearson分析,以P<0.05为差异有统计学意义。
2 结 果
2.1两种仪器检测HIV-1病毒载量与外周血CD4+T细胞数及CD4+/CD8+结果 见表1。30例患者HIV-1病毒载量检测结果显示,雅培m2000全自动分析系统阳性检出率为100%,检测结果均值为(2.990±0.284)log copy/mL;罗氏AmpliPrep/TaqMan全自动分析仪阳性检出率也为100%,检测结果均值为(3.100±0.244)log copy/mL,差异均无统计学意义(t=1.466,P>0.05)。

表1 两种仪器检测HIV-1病毒载量与外周血CD4+T细胞数及CD4+/CD8+结果
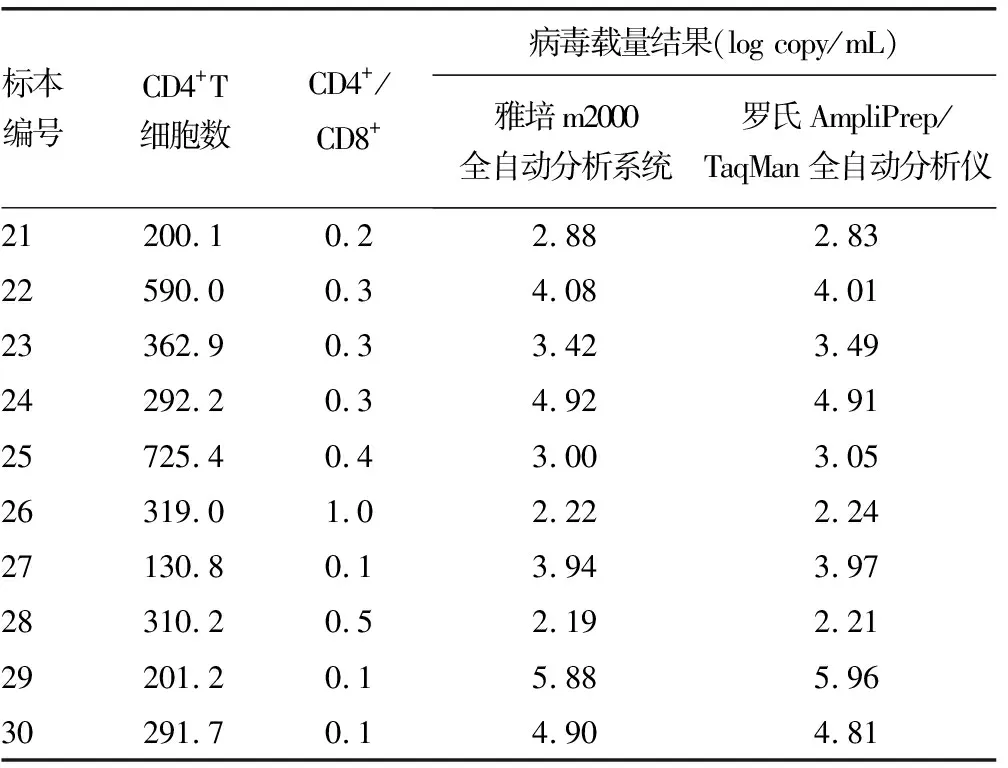
续表1 两种仪器检测HIV-1病毒载量与外周血CD4+T细胞数及CD4+/CD8+结果
2.2两种仪器检测HIV-1病毒载量与外周血CD4+T细胞数及CD4+/CD8+的相关性 见表2。相关性分析结果显示,雅培m2000全自动分析系统、罗氏AmpliPrep/TaqMan全自动分析仪HIV-1病毒载量检测结果均与CD4+T细胞数及CD4+/CD8+呈明显直线负相关。

表2 两种仪器检测HIV-1病毒载量与外周血CD4+T细胞数及CD4+/CD8+的相关性
2.3两种仪器测得病毒载量之间的相关性分析 见图1。雅培m2000和罗氏AmpliPrep/TaqMan两种全自动分析系统检测的病毒载量呈线性关系(r=0.968,P<0.001)。

图1 两种仪器测得HIV病毒载量相关性分析
3 讨 论
雅培m2000全自动分析系统和罗氏AmpliPrep/TaqMan全自动分析仪均能够检测所有M组和O组的HIV-1毒株及非B亚型HIV-1的病毒载量,这些检测系统提供了一种既快速又高度准确的检测方法,有助于患者接受最有效的治疗[8]。
雅培m2000和罗氏AmpliPrep/TaqMan两种检测系统在检测原理、方法上都基本相似,均是对HIV-1病毒载量进行定量高精度检测,其检测结果在AIDS抗病毒治疗过程中可作为临床医生制订用药方案的参考指标,确定药物耐受水平,也可为更换治疗方案或对现有方案进行改进做准备。本研究对30例AIDS患者血浆采用雅培m2000全自动分析系统和罗氏AmpliPrep/TaqMan全自动分析仪同时测定病毒载量,所选患者的HIV-1病毒载量从0~105copy/mL均有覆盖,所有标本两种方法阳性检出率均为100%,特异度和重复性、阳性检出率一致,两种方法检测结果差异无统计学意义(P>0.05),提示两种检测系统均有较高的灵敏度。
HIV载量反映的是HIV在体内复制的数量,CD4+T细胞数指HIV感染靶细胞的数量,预示着人体不同的免疫水平[9],CD4+T细胞数低下或降低提示患者病情恶化。因此,可通过分析病毒载量和CD4+T细胞数变化来了解抗病毒疗效。本研究结果显示,雅培m2000全自动分析系统和罗氏AmpliPrep/TaqMan全自动分析仪检测的HIV-1病毒载量均与CD4+T细胞数及CD4+/CD8+呈明显负相关,当病毒载量检测值较低时,CD4+T细胞数及CD4+/CD8+一般较高,反之,当病毒载量值升高时,CD4+T细胞数及CD4+/CD8+呈下降趋势,这与路新利等[10]和李玲等[11]的研究结果相一致。
雅培m2000和罗氏AmpliPrep/TaqMan两种检测系统也存在一定的差异。主要表现在:雅培m2000全自动分析系统在操作时可用标本采集原始管直接上机,避免手工混合操作,相对于罗氏AmpliPrep/TaqMan全自动分析仪手工操作标本加载和卸载,消除了交叉污染,同时降低了操作时工作人员易造成的误差。雅培m2000全自动分析系统可开放模式,一次提取,多次应用,便于实时复查,可用于其他如耐药性分析及分型等,大大节约了试验成本。罗氏AmpliPrep/TaqMan全自动分析仪提供了整合的自动化标本制备系统,使整个标本检测过程自动化,提高了操作流程的效率。雅培m2000系统的m2000sp和m2000rt 2个部分是分开的,在安装上就可遵循分子生物实验室的分区理念,而罗氏AmpliPrep和TaqMan两种分析系统是连在一起的,对实验室场地、环境要求相对较高,但操作过程相对易于掌握。
当然,两种全自动分析系统也有各自的不足之处,由于是高精度的定量分析系统,两种分析系统均需使用原装配套试剂及耗材,在带来稳定可靠结果的同时检测成本也相对较高,耗材消耗量较大。但是,随着联合国艾滋病规划署提出“2030年终结艾滋病”愿景的提出,以及2020年实现“3个90%”防治目标,即:90%的感染者通过检测知道自己的感染状况,90%已经诊断的感染者接受抗病毒治疗,90%接受抗病毒治疗的感染者病毒得到抑制,HIV RNA载量的高精度检测将具有重要意义。两种精准的定量分析系统对病情的准确判断,特别是对HIV阳性产妇的婴儿和处于HIV抗体窗口期的感染者等特殊免疫个体[5-6],在其感染的早期诊断中发挥了重要作用。此外,两种精准的定量分析系统还能指导AIDS抗病毒治疗的疗效监控,以尽量清除病毒或抑制病毒复制[12]。AIDS患者在很大程度上依赖HIV RNA载量的精确测定,因此,只有采用高精度的检测方法才能为临床医生提供更准确可靠的AIDS治疗依据。

