利拉鲁肽对胰岛素抵抗大鼠肝脏GRP78-JNK-GLUT2通路的影响
郭晓宇 高 宇 宋 娜 山秀杰 葛晓春 冯增斌 刘晓燕
(承德医学院附属医院内分泌科,河北 承德 067000)
胰岛素抵抗(IR)是2型糖尿病(T2DM)及代谢综合征发病共同病理生理基础,肝脏是胰岛素作用主要靶器官之一,更是胰岛素调节机体糖、脂代谢的重要效应器官。胰高血糖素样肽(GLP)-1类似物利拉鲁肽是目前治疗T2DM的新型降糖药物,最新研究发现利拉鲁肽还可显著减轻T2DM大鼠肝脏IR〔1〕。持续的内质网应激(ERS)发生在胰岛素作用的主要靶组织(肝脏、脂肪、肌肉等)可引起IR,但具体机制不明〔2〕。本实验通过观察高脂喂养大鼠肝脏ERS相关分子葡萄糖调节蛋白(GRP)78、c-jun氨基末端激酶(JNK)及胰岛素受体相关因子蛋白激酶B(AKT)、葡萄糖转运子(GLUT)2表达的影响,探讨不同浓度利拉鲁肽利拉鲁肽对肝脏ERS及IR的干预效应。
1 材料与方法
1.1实验材料 游离脂肪酸测定盒及三酰甘油(TG)测定试剂盒均购自南京建成生物工程研究所。TRIzol 购自美国Invitrogen公司,引物合成于Invitrogen上海贸易有限公司,cDNA反转录试剂盒及荧光定量试剂盒均购自天根生化科技有限公司,AKT抗体购自SANTA CRUZ公司,其余抗体均购自武汉博士德生物工程有限公司。利拉鲁肽购自丹麦诺和诺德公司。
1.2实验动物 4月龄健康Wistar雄性大鼠54只,体重250 g左右,购自北京维通利〔合格证号:SCXK(京)2012-0001〕,实验期间室内温度(22±2)℃,相对湿度(50±5)%,每 12 h光照/黑暗循环 (光照时间7∶00~19∶00),自由饮水、进食。
1.3方法
1.3.1动物分组及模型制备 大鼠适应性喂养3 d后,随机分为对照(NC)组16只与高脂喂养组38只,普通饲料及高脂饲料购自北京科奥协力有限公司。普通饲料热量组成:碳水化合物64.19%,脂肪12.04%,蛋白质23.77%,总热量为337 kCal/100 g。高脂饲料热量组成:碳水化合物30.01%,脂肪53.75%,蛋白质16.24%,总热量为486 kCal/100 g。喂养8 w末行清醒状态下高胰岛素-正葡萄糖钳夹实验〔2〕,计算葡萄糖输注率(GIR),确定高脂喂养大鼠IR状态是否造模成功。
1.3.2给药方案 成膜后将高脂饲养组随机分为高脂组(HFD组,高脂饮食+生理盐水皮下注射);利拉鲁肽低剂量组(LL组,高脂饮食+100 μg·kg-1·d-1利拉鲁肽皮下注射);利拉鲁肽高剂量组(HL组,高脂饮食+200 μg·kg-1·d-1利拉鲁肽皮下注射);NC组给予0.5 ml生理盐水皮下注射。药物干预2 w后,各组取5只大鼠再行高胰岛素-正葡萄糖钳夹试验。
1.3.3血清生化指标检测及肝组织苏木素-伊红(HE)染色 采用全自动生化仪测定TG、丙氨酸转移酶(ALT)、天冬氨酸转移酶(AST)。取肝组织,行HE染色观察其病理学改变。
1.3.4血清游离脂肪酸(FFA)及肝脏内TG(LTG)检测 按照相应酶联免疫吸附法(ELASIA)试剂盒说明书方法(购自南京建成生物工程研究所)。
1.3.5口服葡萄糖耐量试验(OGTT)实验 药物干预2 w后,4组大鼠随机各取5只进行实验。取尾部一滴血,测空腹血糖。大鼠灌糖后,测30、60、120 min血糖。计算大鼠葡萄糖曲线下面积(AUC),公式为AUC= (0′+30′)/4+(30′+60′)/4+(60′+120′)/2。
1.3.6Western印迹检测肝脏组织相关蛋白表达量 取适量肝组织液氮下研磨成粉末,加入组织裂解液,冰上匀浆后4℃ 14 000 r/min离心30 min,二喹啉甲酸(BCA)法测定蛋白浓度。配备12%分离胶和4%浓缩胶。转膜后用5%脱脂奶粉封闭膜1 h,分别加入一抗兔抗鼠GRP78、JNK、JNK磷酸化(P-JNK)、AKT、AKT磷酸化(P-AKT)、GLUT2,按4℃孵育过夜,次日室温用辣根过氧化物酶标记二抗羊抗兔孵育2 h,TBST洗膜后进行曝光显影。利用图像分析软件Image J对显影条带进行灰度值进行定量分析。用“目的蛋白灰度值/内参灰度值”代表目的蛋白的相对表达量情况。
1.3.7总RNA提取和荧光定量PCR检测肝脏相关基因的表达 应用Trizol试剂提取各组大鼠肝脏总 RNA。以β-actin作为内参。每个循环 94℃,变性15 s,55℃退火15 s,72℃延伸 15 s。利用检测到的荧光信号,得到每份标本的扩增曲线及熔点曲线,检测反应的特异性,得到各自的Ct值,每组均重复3次。GRP78引物序列:上游引物5′-AACCCAGATGAGGCTGTAGCA-3′,下游引物5′-ACATCAAGCAGAACCAGGTCAC-3′,产物长度约158 bp。GLUT-2引物序列:上游产物5′-GGCCTCTGTGGAAAATGTCTC-3′,下游产物5′-AGGGTACATGGTGGTGCC GCCGAGA-3′,产物长度约176 bp。β-actin引物序列:上游产物5′-TGACGTTGACATCCGTAAAGACC-3′,下游产物5′-TGCTAGGAGCCAGGGCAGTAA-3′,产物长度约138 bp。
1.4统计学分析 采用SPSS19.0软件进行LSD-t检验、方差分析及直线相关分析。
2 结 果
2.1一般项目结果 与NC组相比,HFD、LL、HL组的体重、血FFA(除HL组)、TG、LTG、AST、ALT均显著升高(P<0.05);与HFD组相比,HL组的体重、血FFA、TG、LTG、AST、ALT均明显下降(P<0.05)。与HFD组相比,LL组仅FFA、AST、ALT明显下降(P<0.05)。与LL组相比,HL组体重、FFA、LTG、TG、AST、ALT均明显减少(P<0.05)。见表1。
表1 四组大鼠一般资料的比较
与NC组相比:1)P<0.05;与HFD组相比:2)P<0.05;与LL组相比:3)P<0.05,下表同
2.2光镜观察大鼠肝细胞形态学变化 NC组肝组织结构完整、清晰,肝小叶结构正常,中央静脉大而壁薄,肝细胞索在中央静脉周围呈放射状分布,HFD组肝细胞体积明显增大,胞质内可见大小不一的脂滴空泡,胞核被推向周边,LL组肝细胞体积有所减小,胞质内脂滴空泡明显减少,HL组肝小叶和肝窦结构清晰,细胞排列整齐,细胞仅可见少许脂滴空泡。见图1。
2.3OGTT结果 与NC组比较,HFD组大鼠各时间点血糖均明显升高、AUC明显增加(P<0.05);与HFD组比较,HL组各点血糖和AUC均明显下降(P<0.05),LL组各时间点血糖与AUC下降,但仅120 min血糖差异有统计学意义(P<0.05);与LL组比较,HL组0 min、120 min血糖和AUC明显下降(P<0.05),见表2。
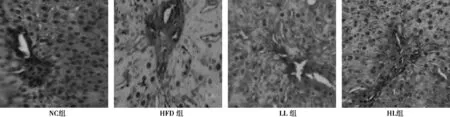
图1 各组大鼠肝脏形态学变化情况(HE,×200)

组别血糖(mmol/L)0 min30 min60 min120 minAUCNC组5.26±0.316.14±0.817.48±1.005.51±0.2813.44±1.06HFD组7.04±0.511)10.38±1.681)10.84±1.201)7.84±0.341)18.95±1.391)LL组6.36±0.369.14±0.748.84±0.826.63±0.802)16.21±0.65HL组5.73±0.762)3)8.91±0.872)8.66±0.752)6.23±0.682)3)14.77±0.552)3)
2.4Western印迹法检测大鼠肝脏相关蛋白表达情况 与NC组相比,HFD组GRP78、P-JNK/JNK蛋白表达显著升高,GLUT2、P-AKT/AKT蛋白表达显著减少(P<0.05)。与HFD组相比,HL组、LL组 GRP78、P-JNK/JNK蛋白表达均下降(P<0.05),GLUT2、P-AKT/AKT蛋白表达均增加(P<0.05)。与LL组相比,HL组GRP78、p-JNK/JNK蛋白表达下降(P<0.05),GLUT2、P-AKT/AKT蛋白表达增加(P<0.05)。如图2、图3,表3。

图2 GRP78、GLUT2蛋白表达情况
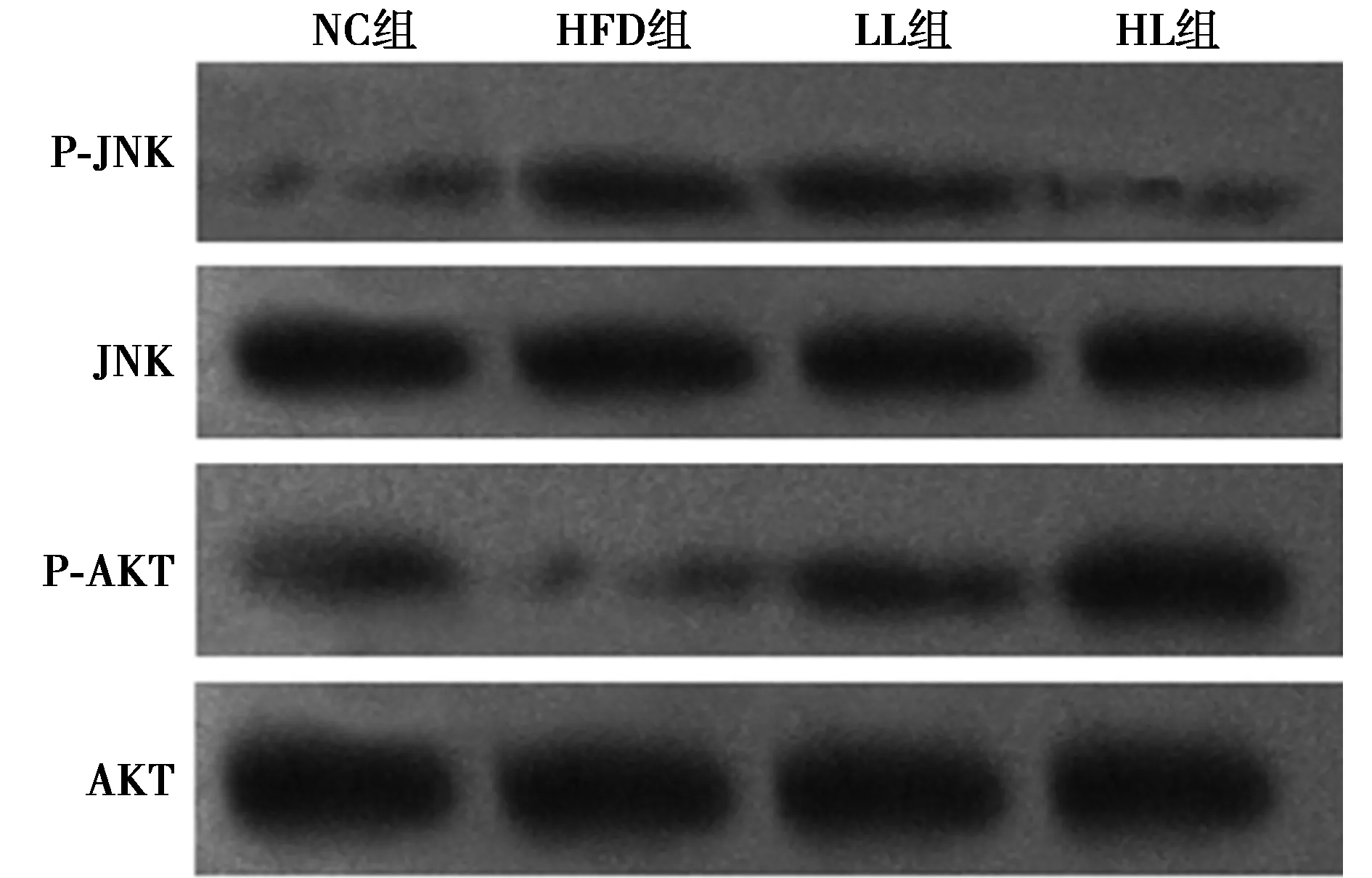
图3 JNK、AKT磷酸化情况
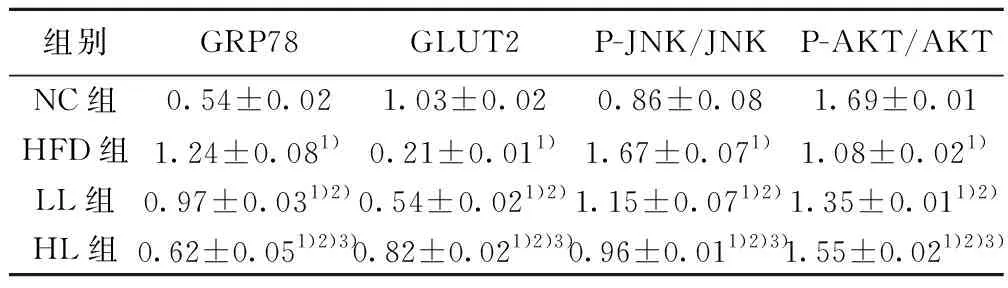
组别GRP78GLUT2P-JNK/JNKP-AKT/AKTNC组0.54±0.021.03±0.020.86±0.081.69±0.01HFD组1.24±0.081)0.21±0.011)1.67±0.071)1.08±0.021)LL组0.97±0.031)2)0.54±0.021)2)1.15±0.071)2)1.35±0.011)2)HL组0.62±0.051)2)3)0.82±0.021)2)3)0.96±0.011)2)3)1.55±0.021)2)3)
2.5Real-Time RCR 法检测大鼠肝脏GRP78、GLUT2 mRNA表达情况 与NC组大鼠相比,HFD组大鼠的GRP78 mRNA的表达显著增高,GLUT2 mRNA表达显著减低(P<0.05);与HFD组大鼠相比,LL组及HL组大鼠GRP78 mRNA的表达均显著降低(P<0.05),与LL组大鼠相比,HL组减低更为明显(P<0.05);与HFD组大鼠相比,LL组及HL组GLUT2 mRNA的表达均显著上调(P<0.05),但HL组上调程度显著高于LL组(P<0.05)。见表4。
2.6单因素相关分析 GIR与体重、FFA、LTG、TG呈负相关(P<0.05,P<0.01)。GRP78蛋白表达量与FFA、LTG、TG呈正相关,与GIR呈负相关(P<0.05,P<0.01)。GLUT2蛋白表达量与FFA、LTG、TG呈负相关,与GIR呈正相关(P<0.01),见表5。
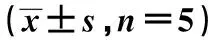
表4 4组大鼠肝脏GRP78、GLUT2 mRNA表达情况

表5 大鼠GIR及肝脏GRP78、P-JNK、P-AKT、GLUT2蛋白相关分析
3 讨 论
ERS与肥胖、IR和T2DM等的发病环节密切相关〔3〕。GRP78是ERS反应标志性分子伴侣,蛋白激酶样内质网激酶(PEPK),转录激活因子(ATF)6,和肌醇激酶(IRE)1α与GRP78在内质网膜上相结合,以保持其非活动状态,当错误折叠的蛋白质在ER腔中积聚时,分子伴侣GRP78与以上三个受体解离,以促进未折叠或错误折叠的蛋白进行正确折叠。本研究证实高脂喂养大鼠肝脏发生了ERS,伴有GIR下降,出现IR,与既往研究结果肝脏发生ERS时促进机体IR的加剧相符合〔4〕。ERS激活IRE-1α,继而引起JNK信号通路活化〔5〕,活化后JNK使胰岛素刺激的P-AKT和胰岛素受体底物(IRS)-1酪氨酸磷酸化受到抑制阻止了胰岛素信号的传导,降低了胰岛素在外周组织的敏感性,导致IR的发生〔6,7〕。利拉鲁肽是目前研发的GLP-1类似物,不仅可以改善胰岛B细胞功能促进胰岛素分泌发挥降糖作用,还可显著减轻T2DM大鼠IR〔8〕。本研究说明利拉鲁肽有改善IR发挥降糖作用,与既往Díaz-Soto等〔9〕研究一致。本实验提示IR减轻与ERS缓解相关。利拉鲁肽呈浓度依赖性改善大鼠ERS,减轻IR。有研究发现,GLP-1类似物可刺激糖尿病大鼠肝脏、肌肉及脂肪组织GLUT2、GLUT4蛋白及mRNA的表达,从而增加机体对胰岛素的敏感性〔10〕。利拉鲁肽是否通过降低FFA和肝内脂质沉积,影响内质网GRP78-JNK-AKT-GLUT2通路,改善ERS,减轻肝脏IR,目前尚未报道。综上,高脂饮食可导致FFA及肝内脂质蓄积,发生ERS,导致IR,利拉鲁肽可呈依赖性缓解高脂喂养大鼠肝脏内质网应激,减轻IR,其机制可能与利拉鲁肽使肝细胞内质网应激分子伴侣GRP78蛋白表达水平下降及JNK-AKT-GLUT2通路有关,然而其具体的分子机制还待进一步研究。
——疾病防治的新靶标

