黄酒多酚减轻阿霉素心脏毒性的初步研究*
林 辉, 倪婷娟, 张 杰, 池菊芳, 项美香, 郭航远, △
(1温州医科大学第一临床医学院, 浙江 温州 325000; 2浙江大学医学院, 浙江 杭州 310000; 3浙江大学绍兴医院, 绍兴市人民医院心内科, 浙江 绍兴 312000)
蒽环类药物,如阿霉素(即多柔比星,doxorubicin,DOX)是各种血液、软组织肿瘤和实体瘤治疗的基石类药物,具有超过50 年的临床使用历史。心脏毒性与阿霉素治疗呈剂量依赖性关系,这也成为临床限制其应用的主要原因[1]。阿霉素诱导心肌毒性的机制复杂,可能涉及氧化应激、脂质过氧化、凋亡和自噬等多条途径[2]。但是,目前尚无一种可以有效减轻阿霉素所致心脏毒性的理想药物。多酚类(polyphenols)物质是一类具有抗肿瘤、抗氧化、清除氧自由基和保护心血管作用的天然化学物。本团队先前一直致力于黄酒及其主要成分黄酒多酚化合物(yellow wine polyphenol compounds,YWPC)对心血管系统的保护作用的研究,发现黄酒多酚具有保护内皮细胞损伤,抑制平滑肌细胞增殖和表型转化,减轻动脉粥样硬化形成的作用[3-6]。但是黄酒多酚是否能减轻阿霉素所致心脏毒性仍未知。因此,本研究拟通过动物实验模拟阿霉素所致心脏毒性,观察黄酒多酚对阿霉素所致心脏毒性的作用,并从氧化应激和细胞凋亡角度探讨其可能的作用机制。
材 料 和 方 法
1 实验材料
40只健康无特定病原体(specific-pathogen-free, SPF)级 Sprague-Dawley (SD)雄性大鼠购自浙江省医学科学院实验动物中心,许可证号为SYXK(浙) 2016-0022,8周龄左右,体重(250±20) g。阿霉素(Cat. HY-15142A)购自MedChemExpress;黄酒多酚由上海中药制药技术有限公司分离提取,纯度>60%;苏木素-伊红(HE)染色液(Cat. DH0006-2)和Mallory磷钨酸苏木素染色(PTAH自然氧化法)试剂盒(Cat. DC0002-3)购自北京雷根生物技术有限公司;TUNEL细胞凋亡检测试剂盒(Cat. 11684817910)购自瑞士罗氏公司;抗Bax抗体(Cat. ab32503)和抗Bcl-2抗体(Cat. ab32124)购自Abcam;抗cleaved caspase-3抗体(#9664)、抗β-actin抗体(#4970)和HRP标记兔 II 抗(#7074)购自CST;心肌肌钙蛋白I(cardiac troponin I,cTnI)酶联免疫分析试剂盒(Cat. ml003202)购于上海酶联公司;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒(Cat. BC0680)、肌酸激酶(creatine kinase,CK)活性检测试剂盒(Cat. BC1140)和天冬氨酸转氨酶(aspartate aminotransferase,AST)活性检测试剂盒(Cat. BC1560)购自北京索莱宝科技有限公司;DAPI(Cat. D9542)购自Sigma;超氧化物阴离子荧光探针二氢乙啶(dihydroethidium,DHE; Cat. S0063)、过氧化氢酶(catalase,CAT)检测试剂盒(Cat. S0051)、 总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(Cat. S0101)、丙二醛(malondialdehyde,MDA)检测试剂盒(Cat. S0131)、 谷胱甘肽(glutathione, GSH)检测试剂盒(Cat. S0053)以及Western blot相关试剂均购自江苏碧云天生物技术研究所。
2 方法
2.1实验分组 实验共分4组:DOX组大鼠腹腔注射2 mg/kg的DOX(浓度0.2 g/L,避光保存),定于每周一、三、五上午9时给药,连续给药4周,累计剂量24 mg/kg;对照(control)组大鼠腹腔注射等量的生理盐水; YWPC组大鼠定于每日中午12点通过灌胃给予30 mg/kg剂量(总体积2 mL),每次灌胃后观察30 min; DOX+YWPC组大鼠在腹腔注射阿霉素的同时,给予YWPC灌胃处理。所有实验大鼠在4周后结束实验。
2.2大鼠心功能测定 4周后,通过小动物麻醉机(R510IP,购于深圳市瑞沃德生命科技有限公司)使用异氟烷麻醉大鼠,胸前备皮,在飞利浦IE33系统下,使用s5-1探头(12~14 MHz)检测大鼠心功能。应用系统自带的飞利浦QLab 9软件测量所有大鼠的左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短分数(left ventricular fractional shortening,LVFS)、 收缩期左室内径(left ventricular internal dimension at systole,LVIDs)和舒张期左室内径(left ventricular internal dimension at diastole,LVIDd)。
2.3外周血心肌酶谱检测 测量心功能结束后继续饲养1 d,脊髓脱臼法处死大鼠,迅速打开腹腔,下腔静脉取血,储存于促凝管中,静置30 min后,3 500 r/min离心5 min,取上清即血清置于-80 ℃超低温冰箱中保存待用。按试剂盒方法,检测血清LDH、CK、AST和cTnI的水平。
2.4心脏组织氧化和抗氧化成分检测 下腔静脉取血后,开胸取出心脏,从左心室处予预冷生理盐水冲洗心脏,在室间隔处切开心脏,将左半部分心脏组织置于液氮中保存待用,剩余部分用10%中性福尔马林固定。随后,取液氮中各组大鼠心脏组织于冷PBS(pH 8.6)中匀浆,制备10%匀浆液,按试剂盒方法进行操作,检测心肌组织中CAT、SOD、MDA和GSH水平。
2.5心脏组织学观察 取福尔马林固定的各组心脏组织,常规脱水、浸蜡、包埋和切片。切片进行HE染色:常规烤片、脱蜡后,伊红染色45 s,PBS冲洗,随后苏木素染色30 s,PBS冲洗后温水返蓝,干燥后二甲苯封片。使用莱卡DM3000生物显微镜拍照。切片PTAH染色:切片脱蜡至水后入草酸溶液漂白2 min,随后浸入Mallory PTAH染色液浸染48 h,取出切片,直接用95%乙醇迅速洗去多余染液,封片后拍照观察。
2.6心脏组织DHE染色 取液氮中冻存的心脏组织进行冰冻切片,配置10 μmol/L的DHE探针浓度,每个样本滴加100 μL,避光37 ℃孵育50 min;PBS洗3遍,随后滴加100 μL的浓度为2 mg/L的DAPI孵育5 min,PBS清洗后使用甘油封片,荧光显微镜下观察和摄片。使用ImageJ软件进行荧光强度分析,并与对照组的荧光强度进行比较。
2.7心脏组织心肌细胞凋亡的检测 使用TUNEL法检测心脏组织切片中心肌细胞凋亡。常规脱蜡至水后,按照试剂盒说明对上述各组心肌组织切片进行染色。用Proteinase K工作液处理组织15 min,PBS漂洗2次后滴加TUNEL反应液(50 μL TdT+450 μL荧光素标记的dUTP)反应60 min。漂洗后加50 μL converter-POD继续反应30 min,DAB显色,苏木素复染30 s,梯度乙醇脱水、二甲苯透明、中性树胶封片,显微镜拍照。
2.8Western blot检测凋亡相关因子的蛋白表达 取心脏组织约0.1 g,加入RIPA裂解液和PMSF混合液300 μL,在4 ℃条件下进行匀浆提取蛋白,BCA试剂定量,取30 μg蛋白进行SDS-PAGE分离。随后,使用PVDF膜进行转膜,5%脱脂奶粉封闭1 h。分别使用抗Bcl-2、Bax、cleaved caspase-3和β-actin抗体4 ℃孵育过夜;TBST洗膜后滴加 II 抗室温孵育1 h,ECL发光液暗室进行显影。使用Bio-Rad凝胶成像系统进行胶片拍摄并使用Quantity One软件对蛋白灰度值进行定量分析。实验重复3次。
3 统计学处理
应用SPSS 19.0软件和GraphPad Prism 6.0软件进行统计分析。所有定量资料以均数±标准差(mean±SD)表示,各组之间比较采用单因素方差分析(one-way ANOVA)和SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 黄酒多酚对阿霉素处理的大鼠心脏功能的影响
与对照组和YWPC组相比,DOX组大鼠左心室功能相关指标LVEF和LVES明显减少,而LVIDs和LVIDd明显增加(P<0.05);DOX+YWPC组大鼠以上指标明显得到改善(P<0.05),见表1。

表1 黄酒多酚对阿霉素处理大鼠心功能的影响
*P<0.05vscontrol group;#P<0.05vsDOX group.
2 黄酒多酚对阿霉素处理的大鼠外周血心肌酶谱的影响
DOX处理可明显增加心脏细胞损伤相关血清指标,与对照组相比,DOX组的LDH、CK、AST和cTnI水平均明显增加(P<0.05);而使用30 mg·kg-1·d-1的YWPC干预后,与DOX组相比,血清的LDH、CK、AST和cTnI水平均下降(P<0.05);但是,与对照组相比,单独使用YWPC并不影响以上这些指标的水平,见表2。
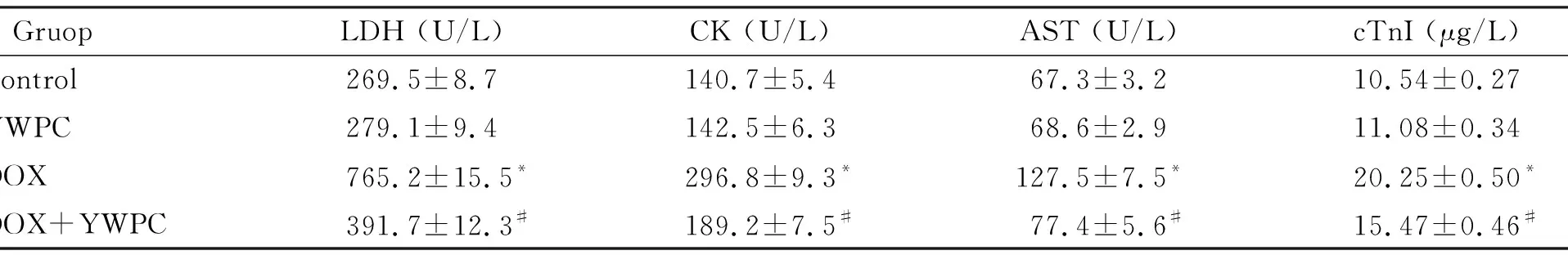
表2 黄酒多酚对阿霉素处理的大鼠血清LDH、CK、AST和cTnI的影响
*P<0.05vscontrol group;#P<0.05vsDOX group.
3 黄酒多酚对阿霉素处理的大鼠心脏组织形态的影响
随后,我们对大鼠组织学进行评估,HE染色发现,对照组和YWPC组大鼠心肌纤维束排列整齐,无明显组织病理学改变;而阿霉素组大鼠的心肌纤维排列明显紊乱,出现大量损伤的心肌细胞,细胞核溶解;使用黄酒多酚干预后,上述阿霉素所致的心肌损伤得到明显改善,见图1。PTAH染色进一步发现,与对照组和黄酒多酚组相比,阿霉素组大鼠出现明显的肌纤维解体;而阿霉素+黄酒多酚组肌纤维解体的表现明显减轻,见图2。
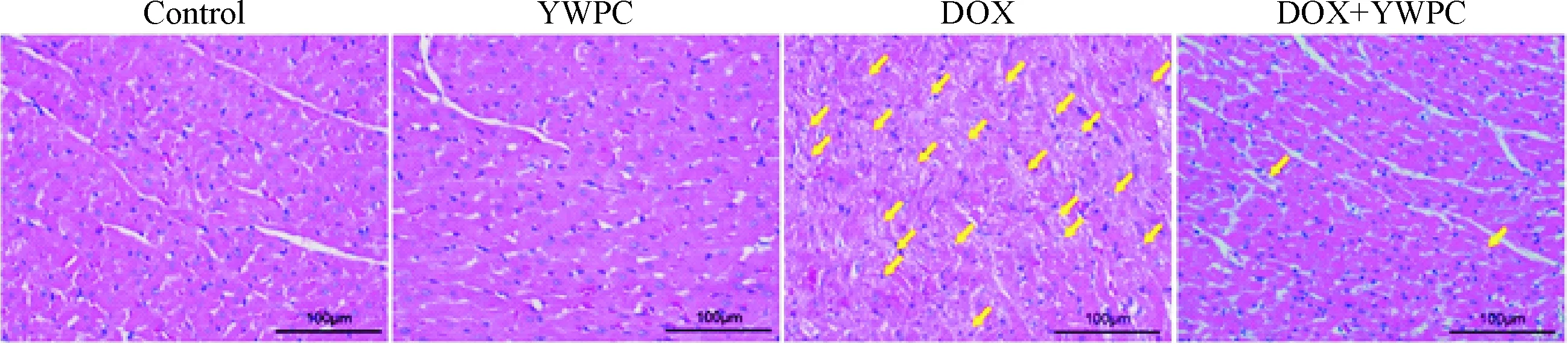
Figure 1.HE staining showed the representative photomicrographs of the heart tissue sections from the rats treated with DOX and YWPC. The yellow arrows indicated the injured myocardial cells, including karyolysis and derangement of the muscle fibers. The scale bar=100 μm.
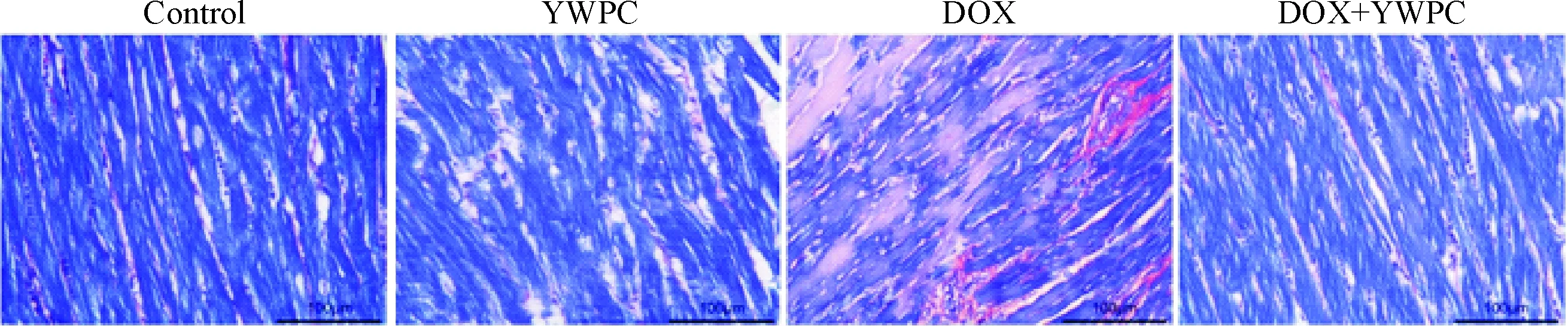
Figure 2.PTAH staining demonstrated the effects of DOX and YWPC on the muscle fibers in heart tissues from the rats in different groups. Blue indicated muscle fibers (the parts that not displayed blue suggested the disorganization of the muscle fibers), and red brown indicated collagen fibers. The scale bar=100 μm.
4 黄酒多酚对阿霉素处理的大鼠氧化应激和抗氧化相关成分的影响
鉴于YWPC能减轻阿霉素的心脏毒性,我们进一步探讨其可能作用机制。DHE染色结果表明,DOX处理明显增加心肌组织活性氧簇(reactive oxygen species,ROS)的水平,而YWPC处理可明显降低ROS的水平(P<0.05),见图3。同时,我们检测心脏组织中氧化应激和抗氧化应激相关指标的改变,结果发现,与对照组比较,DOX处理减少SOD、CAT和GSH等抗氧化酶的活性和水平,增加脂质过氧化指标MDA的水平(P<0.05);而YWPC处理可明显逆转上述改变。单独使用YWPC对心肌组织内SOD、CAT、MDA和GSH水平无影响,见表3。
5 黄酒多酚对阿霉素处理的大鼠心肌细胞凋亡的影响
TUNEL染色结果表明,DOX处理明显增加心肌细胞凋亡数目(P<0.05),而加用YWPC干预后心肌细胞凋亡数目明显减少(P<0.05),见图4A。同时,Western blot实验表明,DOX处理明显增加凋亡相关因子Bax/Bcl-2的比值和cleaved caspase-3蛋白的水平;而YWPC干预后上述指标明显下降(P<0.05),见图4B。
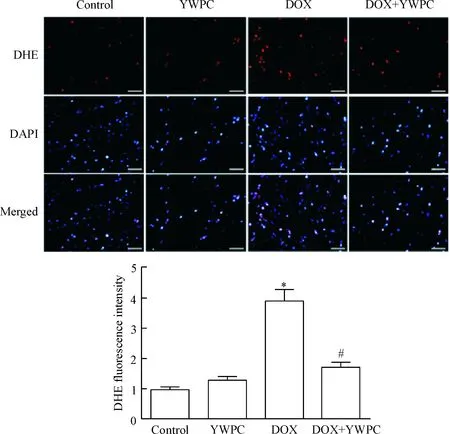
Figure 3.DHE staining showed the effects of YWPC on the levels of oxidative stress in heart tissues of DOX-treated rats. Staining cells with red indicated DHE-positive cells; DAPI staining (blue) indicated nucleus. The scale bar=50 μm. Mean±SD. n=3. * P<0.05 vs control group; #P<0.05 vs DOX group.

表3 黄酒多酚对阿霉素处理的大鼠氧化应激和抗氧化相关分子水平的影响
*P<0.05vscontrol group;#P<0.05vsDOX group.
讨 论
阿霉素因抗瘤谱广,临床疗效高,目前仍是临床上治疗多种癌症的一线药物,但阿霉素所致的心脏毒性越来越受到关注。阿霉素与心肌有较高的亲和力,大剂量阿霉素可导致严重急性扩张性心肌病和心肌损伤导致心脏功能衰竭,威胁到患者生命[7]。因此,如何有效防治阿霉素诱导的心脏毒性是许多研究的探索方向。
本研究采用多次注射阿霉素来构建慢性心脏毒性模型,心脏超声检查发现大鼠心脏收缩功能明显下降。血清心肌酶,如CK、LDH以及cTnI等,可作为评估心肌损伤严重程度的生物标志物。阿霉素处理明显增加上述指标水平,提示心肌严重损伤。我们进一步发现阿霉素处理引起心肌纤维排列紊乱和肌纤维解体,出现大量损伤的心肌细胞,这与先前的报道一致[8]。
近年来,鉴于多酚类物质的抗氧化活性,学者们开始研究使用多酚类物质来抑制阿霉素诱导的心肌的氧化应激反应。例如,姜黄素对阿霉素所致心脏毒性具有保护作用,其机制可能是通过抗炎、抗氧化和抗心肌细胞凋亡[9];此外,报道发现白藜芦醇可显著减轻阿霉素诱导的氧化应激和细胞凋亡,从而保护阿霉素所致的心肌损伤[10];类似的,近期研究发现绿茶提取物通过调节NF-κB和P53通路发挥抗炎、抗氧化和抗凋亡作用,减轻阿霉素诱导的心脏毒性[11]。由此可见,鉴于多酚类化合物的强抗氧化活性,其用于治疗阿霉素所致的心脏毒性具有可行性。黄酒多酚是从绍兴黄酒中提取的多酚类混合物。本团队对黄酒多酚在心血管系统中的保护作用有丰富的研究经验,发现黄酒多酚可改善动脉粥样硬化小鼠血脂水平[6],抑制同型半胱氨酸诱导的血管平滑肌细胞的增殖和迁移[12]。本研究首次发现,使用黄酒多酚干预后,阿霉素处理大鼠的心功能得到明显改善,心肌损伤标志物明显下降,心脏损伤显著减轻。在发现黄酒多酚对阿霉素所致的心脏毒性具有保护作用的基础上,我们进一步探讨其可能机制。
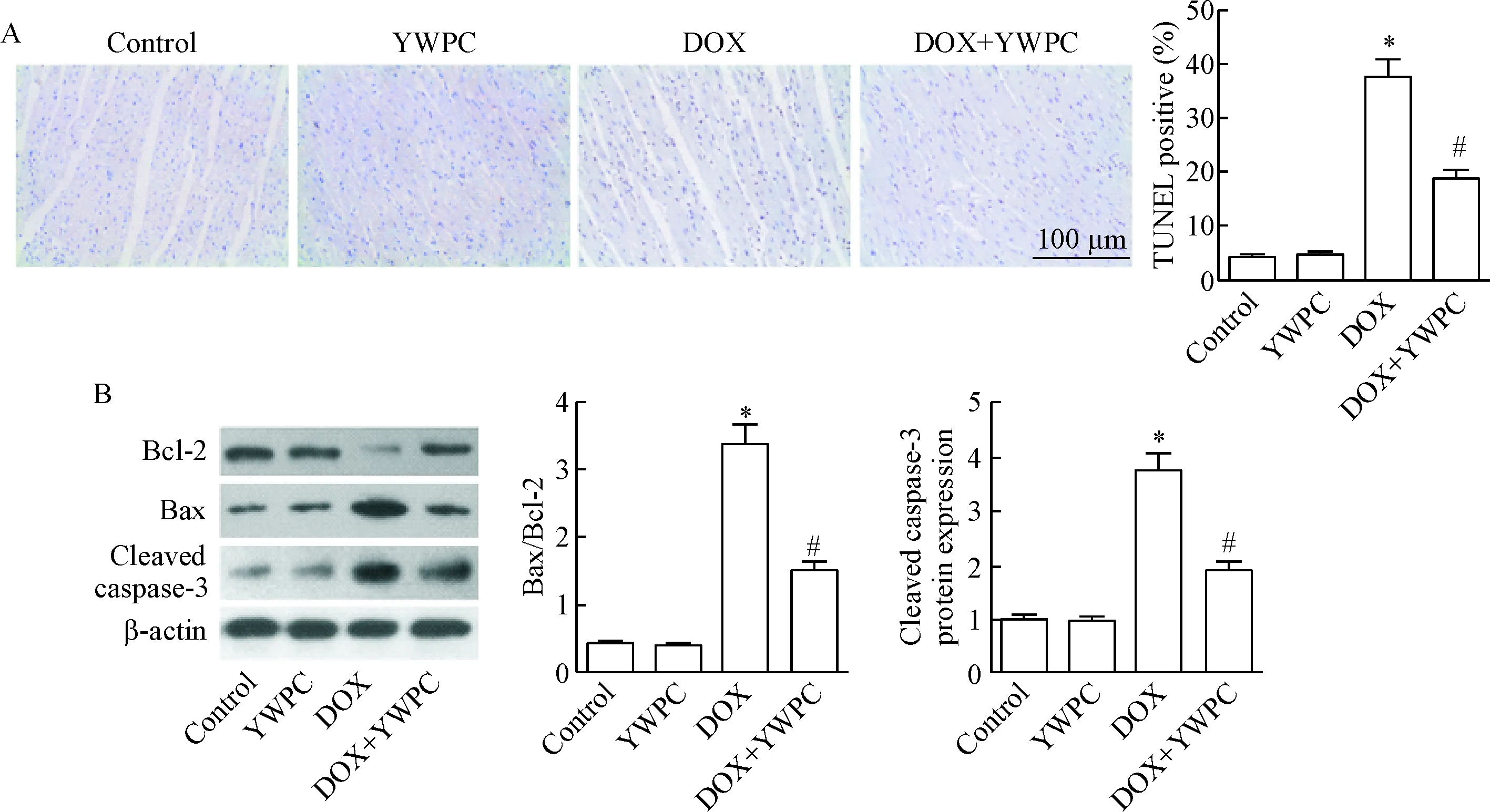
Figure 4.The effects of YWPC on DOX-induced myocardial apoptosis. A: TUNEL staining showed the apoptotic cells in the heart tissues from different groups. Brown nuclei indicated TUNEL positive cells. B: Western blott analysis showed the levels of apoptosis-related proteins, including Bcl-2, Bax and cleaved caspase-3. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs DOX group.
目前,阿霉素所致的心脏毒性的机制仍不明确。但普遍认为氧化应激是阿霉素心脏毒性的中间环节[13]。低浓度的氧化应激是细胞代谢所需,而过量持续的氧化应激可导致细胞内DNA、蛋白质和脂质等损伤[14]。氧化应激介导的心脏损伤的第一道细胞防御包括几种内源性抗氧化酶,如SOD和CAT。若这些抗氧化酶不足以清除过量生成的自由基,则可导致心肌细胞脂质过氧化和线粒体功能紊乱[15]。与先前的研究结果一致[16],我们发现阿霉素可增加ROS的水平和MDA的水平,降低SOD和CAT活性,而黄酒多酚干预可逆转上述改变,提示黄酒多酚可减少阿霉素诱导产生的ROS,有效抑制阿霉素诱导的心脏组织氧化应激反应。
通常认为,阿霉素诱发的氧化应激激活凋亡信号导致心肌细胞凋亡。氧化应激导致细胞色素C释放,并且线粒体中caspase-3的激活导致心肌细胞凋亡[17]。促凋亡蛋白Bax和抗凋亡蛋白Bcl-2在细胞凋亡的调节中起重要作用[18]。因此,我们检测阿霉素处理后上述指标的改变,发现阿霉素明显增加Bax/Bcl-2比例和cleaved caspase-3的水平,结合TUNEL实验的结果,证实了阿霉素诱导心肌细胞凋亡。而黄酒多酚处理可有效抑制阿霉素引起的细胞凋亡,提示其可通过抑制凋亡来保护阿霉素所致的心脏损伤。
综上所述,本研究发现黄酒多酚可有效拮抗阿霉素所致的心脏毒性,其机制可能是通过减轻心脏氧化应激水平和抑制心肌细胞凋亡。但本研究中的黄酒多酚是由不同单体成分组成,具体何种酚类成分发挥心脏保护作用尚不清楚,有待今后进一步研究。

