小檗碱对溃疡性结肠炎模型小鼠肠上皮细胞凋亡的影响
沈 雁 王章流 郑华君 钟继红 倪思忆 李 思
作者单位:1 浙江中医药大学附属第二医院消化内科(杭州310005);2 浙江省立同德医院儿科(杭州310012)
溃疡性结肠炎(ulcerative Colitis,UC)是一种慢性非特异性结肠炎性疾病,其主要病理特征为黏膜炎症和溃疡形成,临床呈现出反复发作和迁延不愈的特点,使其成为消化系统难治性疾病之一[1]。该病在西方国家相当常见,欧洲和北美的患病率达(100~200)/10 万,但我国近年报道的病例亦明显增多,且患者多为青壮年,给社会生产力和个人生活质量带来极大影响[2]。最新研究发现,肠黏膜屏障稳态破坏是引起UC 发病和病情进展的核心事件,而肠上皮细胞(intestinal Epithelial Cells,IECs)的异常凋亡可能在该事件中起重要的中介作用[3-4],这一观点已受到国内外学者的广泛关注,并日益成为研究焦点。小檗碱(berberine hydrochloride,BBR)是中药黄连中的主要活性成分之一。研究表明,BBR 能保护多种原因引起的肠黏膜屏障损伤[5-7],且临床用于治疗UC 的效果确切[8]。本研究采用右旋葡聚糖硫酸钠(dextran sul-phate sodium,DSS)诱导的UC 模型小鼠,通过观察BBR 对UC 模型小鼠肠上皮细胞(intestinal epithelial cells,IECs)凋亡的影响,探讨BBR 治疗UC 的部分作用机制。
1 实验材料
1.1 动 物 健康雄性SPF 级BALB/c 小鼠60 只,8 周龄,体质量(20±2)g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005,合格证号:0345203。小鼠饮用水为灭菌二级超纯水,质量符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-2006)的规定。实验动物房使用许可证号:SYXK(浙)2015-0008,饲养环境:温度范围20~25℃,相对湿度范围40~70%。
1.2 主要药品与试剂 葡聚糖硫酸酯钠盐(DSS,MP Biomedicals,LLC,批号BJ14745,Fluka:5000MW);盐酸小檗碱(BBR,上海源叶生物,批号Y18D8C50814,分 子 量:371.81);Caspase-12 和Cas-pase-3 一 抗(Abcam 公司,批号分别为:ab62484 和ab13847);抗兔和抗鼠二抗(北京中杉金桥生物技术有限公司,批号分别为:K167722B 和K175212C);DAB 显色试剂盒(北京中杉金桥生物技术有限公司,批号K167722A);TUNEL 细胞凋亡原位检测试剂盒(ROCHE 公司,批号11906800);蛋白酶K(Tiangen公司,批号M2011)。
1.3 主要仪器 RM2235 型轮转式切片机(德国LEICA 公司),Tec 2500 型病理组织漂烘仪(常州市郝思琳仪器设备有限公司),BX43 型显微镜(日本OLYMPUS 公司),PYX-DHS500BS-Ⅱ型隔水式恒温培养箱(上海跃进医疗器械有限公司),BCD-211KD3型冰箱(TCL 公司),C21-SDHC15K 型电磁炉(浙江绍兴苏泊尔生活电器有限公司),101-3 型电热恒温鼓风干燥箱(上海锦屏仪器有限公司)。
2 实验方法
2.1 药物混悬液配制 按人—小鼠体表面积换算,分别用蒸馏水配制成低、中、高剂量(100、150、200mg/kg)的BBR 混悬液。
2.2 分组及处理 小鼠适应性养殖1 周后按照随机数字表法分为空白对照组、模型对照组、BBR 低、中、高剂量组五组,每组12 只。参照文献[9]采用DSS 诱导法建立UC 模型:小鼠自由饮用5%DSS 溶液100mL(5g DSS 溶于100mL 蒸馏水中),连续7d;空白对照组每天自由饮用蒸馏水(100mL)。BBR 低、中、高剂量组小鼠在造模第1 天起同时予BBR 混悬液灌胃(给药容量为10mL/kg),模型对照组给予等体积蒸馏水,每天1 次,共7d。
2.3 一般情况观察 造模之日起,每天观察并记录小鼠的精神活动状态、摄食量和饮水量等一般情况,每天定时称量体质量,观察粪便性状并行隐血试验,参照文献[10]进行疾病活动度指数(disease activity index,DAI),DAI=(体质量减轻率分数+大便性状分数+隐血程度分数)/3。
2.4 结肠组织病理学检测 药物治疗结束后,全部小鼠以颈部脱臼法处死,严格无菌条件下取出结肠组织,修整大小为1.0cm×1.0cm×0.2cm,4%多聚甲醛固定4 天,石蜡包埋,4μm 厚连续切片,HE 染色后光镜下观察组织病理学变化,并参照文献[11]进行组织损伤指数(tissue damage index,TDI)评分:正常结肠黏膜为0 分,隐窝腺体丢失1/3 为1 分,隐窝腺体丢失2/3 为2 分,隐窝腺体全部丢失,黏膜上皮完整伴有轻度炎细胞浸润为3 分,黏膜上皮糜烂、破坏、伴有明显炎细胞浸润为4 分。每个样本于200 倍镜下随机选取10 个视野观察,记录并评分统计。
2.5 结肠组织IECs 凋亡情况检测 结肠组织切块后用4%多聚甲醛固定,包埋切片,按照TUNEL 试剂盒说明书进行操作。主要步骤如下:切片脱蜡入水,蛋白酶K 工作液37℃消化组织20min,PBS 冲洗,加TUNEL 反应混合液(含5μL TdT 和45μL 荧光素标记的dUTP 标记液),加封闭液于暗湿盒中37℃反应30min,漂洗,加DAB 底物,显微镜下控制显色,苏木素复染,梯度酒精脱水,二甲苯透明中性树胶封片。每张切片于400 倍镜下随机选取5 个视野观察,记录并统计TUNEL 阳性细胞数。
2.6 结肠组织Caspase-12 和Caspase-3 蛋白表达测定 结肠组织切块后用4%多聚甲醛固定,包埋切片,按照免疫组织化学染色法进行操作。主要步骤如下:切片二甲苯脱蜡,梯度酒精复水,3%H2O237℃孵育15min,PBS 冲洗,滴加一抗4℃冰箱孵育过夜,滴加二抗37℃孵育30min,DAB 反应染色,显微镜下观察反应进度,冲洗、复染,干燥,封片。每张切片于200 倍镜下随机选取3 个视野观察,判读阳性表达强度和阳性率。参照Fromowitz 法进行评分,具体评分标准参照文献[12]:(1)染色强度(以多数细胞呈现的染色强度并减去背景着色计分):无着色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分;(2)阳性范围:<5%为0 分,5%~25%为1 分,26%~50%为2分,51%~75%为3 分,>75%为4 分。计算两项结果之和,<2 分为阴性(-),2~3 分为弱阳性(+),4~5 分为中度阳性(++),6~7 分为强阳性(+++)。
2.7 统计学方法 应用SPSS20.0 统计软件进行分析,计量资料以平均值±标准差() 表示,各组间比较采用单因素方差分析,两两比较采用LSD-t 检验及Dunnett-t 检验,以P<0.05 为差异有统计学意义。
3 实验结果
3.1 小鼠一般情况和疾病活动度变化 造模成功后,模型对照组和BBR 治疗组小鼠均出现不同程度的精神呆滞、行动缓慢、进食少,伴有大便稀溏、便血、体质量下降,而空白对照组小鼠的精神、活动、饮食、大便、体质量等一般情况均正常。与模型对照组比较,BBR 高剂量组的DAI 明显降低(P<0.01);而BBR 低、中剂量组的DAI 虽有所降低,但差异无统计学意义(均P>0.05)。见表1。
3.2 小鼠结肠组织病理改变 镜下可见,空白对照组结肠组织结构正常,黏膜上皮未见病变;模型对照组结肠可见黏膜下隐窝腺体全部丢失,炎性细胞浸润黏膜至上皮结构破坏;BBR 低、中、高剂量组中,以BBR 高剂量组小鼠结肠组织结构与正常对照组最为接近,BBR 低剂量组可见隐窝腺体大片丢失,黏膜下炎细胞浸润,部分黏膜上皮可见水肿,BBR 中剂量组与低剂量组比较病变程度有所减轻。与模型对照组比较,BBR 高剂量组TDI 明显降低(P<0.01);BBR低、中剂量组TDI 虽有所降低,但差异无统计学意义(P 均>0.05)。见表1、封二图1。
表1 各组小鼠治疗7 天后DAI 和TDI 评分比较()

表1 各组小鼠治疗7 天后DAI 和TDI 评分比较()
注:与空白对照组比较,*P<0.01;与模型对照组比较,△△P<0.01;DAI:疾病活动指数;TDI:组织损伤指数;空白对照组、模型对照组给予蒸馏水;BBR 低剂量组给予BBR 混悬液100mg/kg;BBR 中剂量组给予BBR 混悬液150mg/kg;BBR 高剂量组给予BBR 混悬液200mg/kg;BBR:小檗碱
组别 鼠数 剂量(mg/kg)DAITDI空白对照组12-0.06±0.040.00±0.00模型对照组12-1.50±0.65*3.88±0.04*BBR 低剂量组121001.12±0.53*3.58±0.11*BBR 中剂量组121501.00±0.47*2.98±0.53*BBR 高剂量组122000.48±0.36*△△1.62±0.64*△△
3.3 小鼠结肠组织IECs 凋亡情况 TUNEL 阳性细胞呈褐色或深褐色,正常结肠上皮细胞呈蓝色。空白对照组小鼠结肠组织偶见凋亡细胞,模型对照组小鼠结肠上皮凋亡细胞显著增多,与空白对照组比较,差异有统计学意义(P<0.01),表明IECs 的过度凋亡加重了肠黏膜屏障的损伤;与模型对照组比较,BBR低、中、高剂量组小鼠结肠组织IECs 凋亡水平均明显降低(P<0.05 或P<0.01),表明BBR 能有效抑制UC 模型小鼠结肠组织IECs 的过度凋亡。见表2、封二图2。
表2 各组小鼠结肠组织IECs 凋亡水平比较()

表2 各组小鼠结肠组织IECs 凋亡水平比较()
注:与空白对照组比较,*P<0.01;与模型对照组比较,△P<0.05,△△P<0.01;IECs:肠上皮细胞;空白对照组、模型对照组给予蒸馏水;BBR 低剂量组给予BBR 混悬液100mg/kg;BBR 中剂量组给予BBR 混悬液150mg/kg;BBR 高剂量组给予BBR 混悬液200mg/kg;BBR:小檗碱
组别 鼠数 剂量(mg/kg)TUNEL 染色凋亡细胞计数(个)空白对照组12-0.67±0.12模型对照组12-19.27±2.01*BBR 低剂量组121009.67±4.27*△BBR 中剂量组121504.00±1.64*△BBR 高剂量组122002.07±0.92*△△
3.4 小鼠结肠组织Caspase-12 和Caspase-3 蛋白表达水平 Caspase-12 和Caspase-3 阳性呈褐色或黄褐色,主要表达于胞浆。二者均表现为空白对照组表达最低,模型对照组表达最高,模型对照组与空白对照组比较,差异有统计学意义(P<0.01);与模型对照组比较,BBR 高剂量组Caspase-12 表达水平明显下调(P<0.01),BBR 中、高剂量组Caspase-3 表达水平明显下调(P<0.01)。见表3、封二图3。
表3 各组小鼠结肠组织Caspase-12 和Caspase-3 蛋白表达水平比较()
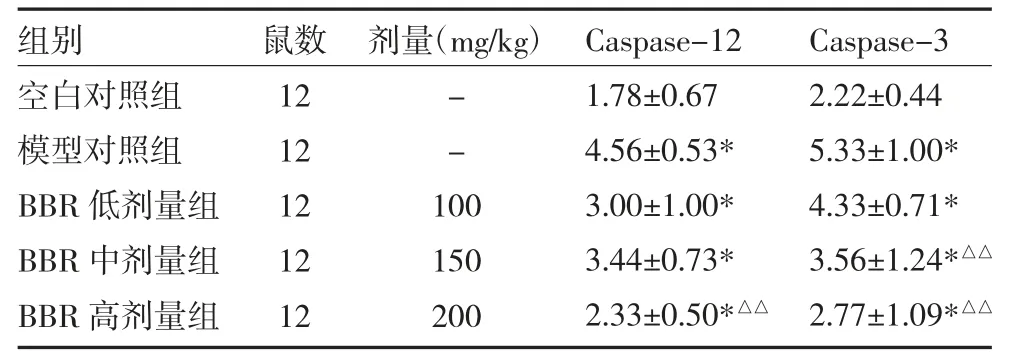
表3 各组小鼠结肠组织Caspase-12 和Caspase-3 蛋白表达水平比较()
注:与空白对照组比较,*P<0.01;与模型对照组比较,△△P<0.01;空白对照组、模型对照组给予蒸馏水;BBR 低剂量组给予BBR 混悬液100mg/kg;BBR 中剂量组给予BBR 混悬液150mg/kg;BBR 高剂量组给予BBR 混悬液200mg/kg;BBR:小檗碱
组别 鼠数 剂量(mg/kg)Caspase-12Caspase-3空白对照组12-1.78±0.672.22±0.44模型对照组12-4.56±0.53*5.33±1.00*BBR 低剂量组121003.00±1.00*4.33±0.71*BBR 中剂量组121503.44±0.73*3.56±1.24*△△BBR 高剂量组122002.33±0.50*△△2.77±1.09*△△
4 讨 论
UC 的病因病机尚不十分明确,既往认为可能是包括遗传、环境、肠道菌群、免疫等在内的多因素共同作用的结果[13]。目前临床上UC 的治疗药物主要包括氨基水杨酸类制剂、糖皮质激素、免疫抑制剂和生物制剂等,但存在远期疗效差、价格高昂、毒副作用大等问题。因此,深入研究UC 的确切发病机制并从发病根源着手,探寻有效的治疗药物或措施进行及时干预,是防治UC 发病和慢性化、重症化的关键,对改善患者生命质量和有效节约社会卫生资源具有重要意义。
生理情况下,IECs 的适度凋亡与隐窝基底部肠道干细胞的分化更新间维持动态平衡,协同细胞旁途径形成稳固的防御体系,可有效防止包括病原微生物在内的外源性抗原物质自由通过。若IECs 异常过度凋亡,将导致肠黏膜屏障结构损伤,肠上皮通透性增高[14-15],肠腔内的各种抗原异常暴露于固有层黏膜相关淋巴组织,刺激后者释放大量的致炎细胞因子,继而借助细胞因子间网络化通讯使免疫炎症反应持续或呈瀑布样级联放大,最终引起持续和/或严重的组织损伤。内质网应激(endoplasmic reticulum stress,ERS)是真核细胞中普遍存在且高度保守的应激反应机制,严重或持续的ERS 状态将启动凋亡信号转导,诱导应激细胞程序性死亡[16]。Caspase-12(casteintl aspartates pecific protease-12)是ERS 独有的凋亡信号转导通路的起始因子,它仅在ERS 状态下激活并进一步磷酸化活化下游的凋亡执行因子Caspase-3,从而独立地介导细胞凋亡[17]。IECs 属于ERS 活跃细胞,易处于ERS 过度状态。研究发现,不同应激原刺激IECs 所构建的体外ERS 模型中普遍存在细胞异常凋亡现象,使细胞通透性明显升高[18-19];同时有证据表明,UC 患者和动物模型的的结肠组织中亦存在大量凋亡的IECs[19-20]。综上可知,IECs 的凋亡加速是导致肠黏膜屏障稳态破坏、造成UC 结肠炎症持续或加重的重要原因,通过抑制Caspase-12/Caspase-3 凋亡信号通路的激活而抑制IECs 的过度凋亡可能是治疗UC 的有效手段之一。
长期的临床实践证明,中医药治疗UC 具有较好的临床效果和安全性。BBR 又名黄连素,其药理作用多样,毒副作用小,价格低廉,临床应用广泛。研究证实,BBR 能减轻慢性应激、严重腹腔感染或脓毒血症等多种病因引起的肠黏膜损伤,保护肠黏膜屏障稳态[5-7]。BBR 作为辅助药物治疗UC 能促进肠黏膜再生,加速溃疡愈合,明显降低UC 的复发率[8],目前已知的作用机制包括调整肠道菌群结构[22]、保护肠屏障功能[23]、调节免疫应答反应[24]等,但BBR 是否能通过抑制IECs 的异常凋亡而发挥治疗UC 的作用,目前国内外罕见报道,值得深入探索和阐释。
本研究结果表明,经BBR 治疗后UC 模型小鼠的临床症状明显好转,DAI 评分明显降低,小鼠结肠黏膜炎细胞浸润、上皮水肿、上皮结构破坏及隐窝腺体丢失等组织病理损伤得到了很好的控制,显示出BBR 良好的临床疗效。UC 模型小鼠结肠组织IECs凋亡较正常小鼠显著增多,说明IECs 凋亡过度参与了UC 的病理过程;BBR 能不同程度地减轻肠细胞的凋亡水平,提示BBR 能有效抑制UC 时IECs 的过度凋亡行为。正常小鼠结肠组织Caspase-12 和Caspase-3 均呈现低表达,而UC 小鼠的表达显著升高,BBR 高剂量治疗后Caspase-12 和Caspase-3 的表达水平均明显下调,提示BBR 抑制IECs 过度凋亡的主要机制可能与抑制Caspase-12/Caspase-3 凋亡信号通路有关。因此,BBR 治疗UC 具有一定的应用前景,但应在此基础上进一步深入研究BBR 对IECs内质网应激和细胞凋亡,以及其影响UC 肠黏膜屏障稳态的具体作用机制,挖掘信号转导通路中的关键分子,为临床治疗UC 提供新的治疗靶标和更为有效的药物。

