机器人辅助腹腔镜前列腺单纯切除术治疗大体积(>80 ml)良性前列腺增生的安全性与疗效分析
滕竞飞 贾卓敏 关亚伟 高峰 李志辉 艾星
1中国人民解放军总医院第七医学中心 100700 北京
BPH是引起中老年男性排尿障碍常见疾病,其发病率随年龄的增加而升高。在60~69岁的男性中,BPH的发病率约为70%,而在70岁以上的男性中,其发病率高达80%[1]。2015年EAU指南推荐对于前列腺体积30~80 ml伴有中重度LUTS的BPH患者,首选TURP;而对于80 ml以上的前列腺,推荐行内镜下前列腺剜除术(endoscopic enucleation of the prostate, EEP)或开放前列腺单纯切除术(open simple prostatectomy, OSP)[2]。
EEP具有并发症发生率低、术后效果好等优势,但无法处理膀胱憩室,对于合并膀胱结石的患者手术时间较长。OSP曾是治疗大体积前列腺增生的“金标准”,但因其创伤大、并发症发生率高、住院时间长等原因,近年来已很少开展[3, 4]。随着微创技术的发展,越来越多的泌尿外科手术可通过腹腔镜或机器人完成。2002年Mariano等[5]首先报道了腹腔镜前列腺单纯切除术(laparoscopic simple prostatectomy, LSP),然而由于该术式技术要求高,未能广泛开展。2008年Sotelo等[6]报道了机器人辅助前列腺单纯切除术(robot assisted simple prostatectomy, RASP),并取得了满意的手术效果。
我们于2017年4月开展机器人辅助腹腔镜经膀胱前列腺剜除术治疗大体积(>80 ml)BPH,目前已完成12例,本研究通过回顾性分析12例患者临床资料,评估该术式的安全性及疗效。
1 资料与方法
1.1 临床资料
纳入2017年4月~2018年4月于我科接受机器人辅助腹腔镜经膀胱前列腺剜除术治疗且术后病理证实为BPH的患者共12例,年龄64~78岁,平均(71.1±4.8)岁。BMI为18.3~26.2 kg/m2,平均(22.7±2.5)kg/m2。术前超声测量前列腺体积82~186 ml,平均(129.4±38.9)ml;PVR为50~400 ml,平均(184.5±111.9)ml,其中1例患者因急性尿潴留留置导尿管未测PVR;Qmax为4.2~12.6 ml/s,平均(8.9±3.0)ml/s,其中1例患者因留置导尿管未行尿流率检查;IPSS为12~32分,平均(23.0±5.3)分;QOL为3~6分,平均(4.8±0.9)分;术前PSA 0.72~14.37 μg/L,平均(4.25±4.33)μg/L,其中1例因留置导尿管,未检查PSA水平,4例患者PSA>4 μg/L,行盆腔增强MRI检查,1例可疑前列腺癌患者行前列腺穿刺活检,结果证实为BPH。12例患者中5例合并膀胱结石,1例合并膀胱憩室,1例合并膀胱憩室及膀胱结石。
1.2 手术方法
全麻成功后,患者取截石位,头低脚高30°。Trocar位置如图1。连接da Vinci机器人各机械臂及手术器械。于膀胱顶部纵行切开膀胱约3~4 cm(图2A)。膀胱切口两侧缘用缝线牵开,缝线另一端穿出腹壁固定。仔细辨认双侧输尿管开口。于前列腺中叶与膀胱颈交界处用电剪刀打开膀胱黏膜及前列腺外科包膜,找到外科包膜与增生腺体之间的层面,沿此层面向前列腺尖部及两侧叶方向推进(图2B~D)。于前列腺尖部用剪刀剪断前列腺及尿道(图2E)。检查前列腺窝有无腺体残留,彻底止血(图2F)。将切除的前列腺装入标本袋。3-0可吸收线连续缝合膀胱颈部黏膜与前列腺尖部尿道黏膜(图2G~H)。留置导尿管,球囊注水30 ml。3-0倒刺线连续缝合膀胱切口。留置盆腔引流管,撤除机器人各机械臂及手术器械,取出标本,关闭切口。
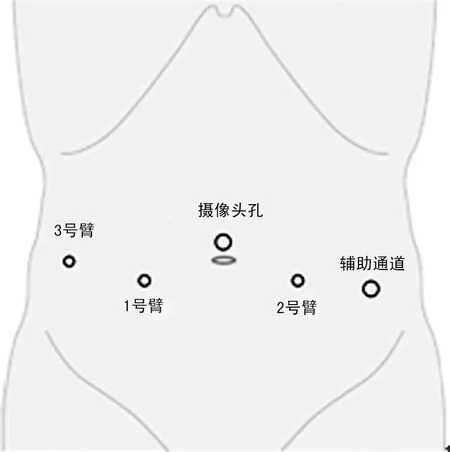
摄像头应用12 mm Trocar,辅助通道应用12 mm Trocar,1号臂应用8 mm Trocar,2号臂应用8 mm Trocar,3号臂应用8 mm Trocar。
图1Trocar布局示意图
1.3 统计学方法

2 结果
12例手术均获成功,无中转开放。手术时间118~210 min,平均(158.5±28.2)min,术中出血量100~400 ml,平均(147.5±57.5)ml,1例患者术中输血治疗。术后未进行膀胱冲洗,导尿管留置时间5~7 d,平均(5.6±0.9)d,术后引流管留置时间3~6 d,平均(4.3±1.0)d,术后住院时间5~7 d,平均(6.3±0.6)d。拔除导尿管后所有患者均无即刻尿失禁发生。术后3个月随访,患者无尿道狭窄发生,Qmax、PVR、IPSS、QOL较术前均显著改善(表1)。
表1术前及术后3个月Qmax、PVR、IPSS、QOL比较
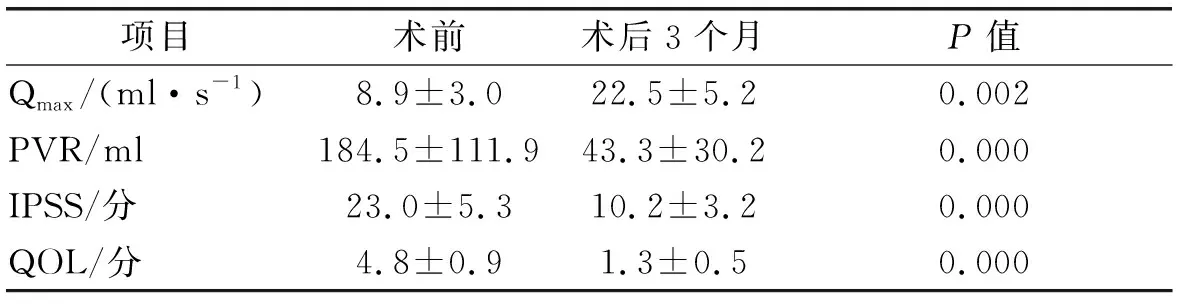
项目术前术后3个月P值Qmax/(ml·s-1)8.9±3.022.5±5.20.002PVR/ml184.5±111.943.3±30.20.000IPSS/分23.0±5.310.2±3.20.000QOL/分4.8±0.91.3±0.50.000
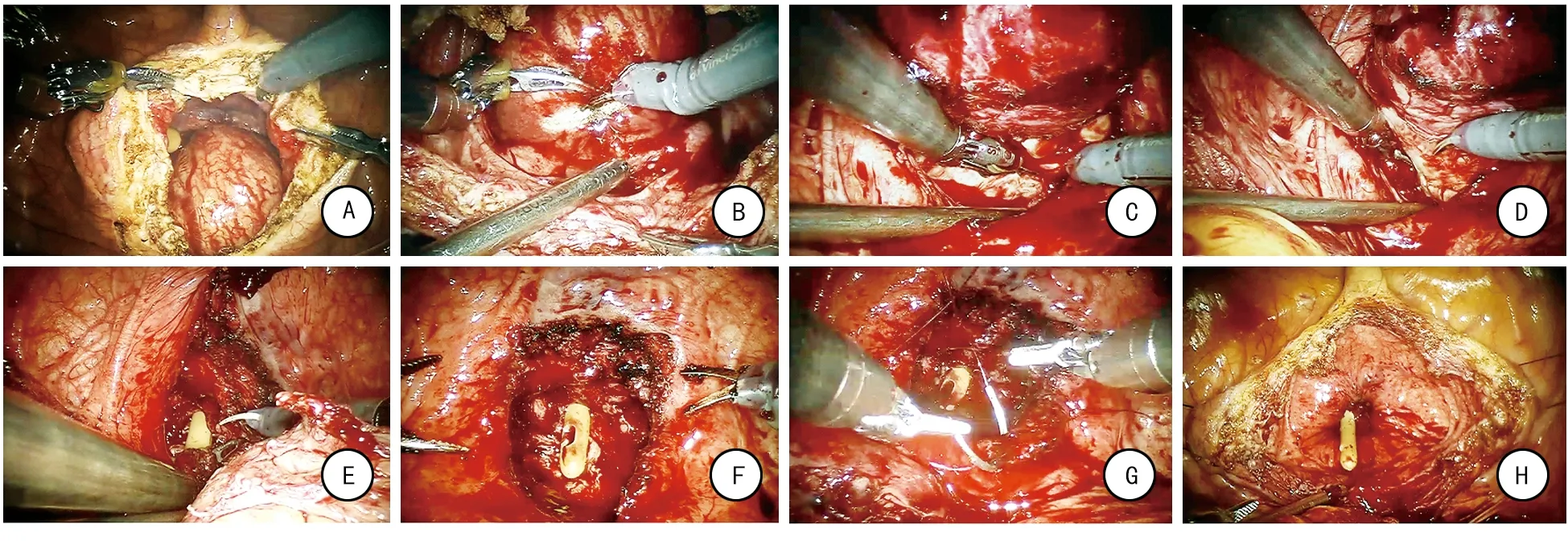
A:于膀胱顶部纵行切开膀胱约3~4 cm;B:于前列腺中叶与膀胱颈交界处用电剪刀打开膀胱黏膜及前列腺外科包膜;C:找到前列腺外科包膜与增生腺体之间的层面,沿此层面向前列腺尖部推进;D:沿正确层面向前列腺两侧叶方向推进;E:于前列腺尖部剪断腺体及尿道;F:检查前列腺窝有无腺体残留,并彻底止血;G:3-0可吸收线连续缝合膀胱颈部黏膜与前列腺尖部尿道黏膜;H:缝合完毕后前列腺窝创面平整光滑。
图2机器人辅助腹腔镜经膀胱前列腺单纯切除术手术步骤
3 讨论
BPH的手术方式包括TURP、经尿道钬激光前列腺剜除术(holmium laser enucleation of the prostate, HoLEP)、经尿道绿激光前列腺汽化术(photoselective vaporization of the prostate, PVP)、OSP、LSP、RASP等。前列腺体积是影响手术方式选择的最重要因素[7]。对于80 ml以上的BPH,EAU指南推荐首选HoLEP和OSP[2]。
OSP已有百余年的历史,虽然能获得良好的手术效果,包括症状缓解及尿动力学指标改善等,但该术式也与较高的并发症发生风险相关[8~10]。Pariser等[4]研究发现OSP的总体并发症的发生率为28%,其中出血是最重要的并发症。欧洲一项纳入1 804例OSP的多中心研究发现,严重出血的发生率为11.6%,输血率为8.2%,脓毒症的发生率为8.6%,3.6%的患者2年内因膀胱颈狭窄需再次手术[11]。近年来,随着激光技术在BPH手术中的广泛应用,OSP实施例数呈逐年下降趋势[4, 12],而HoLEP被许多术者认可,并作为治疗大体积BPH的“金标准”[13]。一项比较HoLEP与OSP治疗100 g以上BPH的Meta分析发现,虽然HoLEP组手术时间更长,但输血风险显著低于OSP组,导尿管留置时间与住院时间较OSP组显著缩短,而功能性结果两组间差异无统计学意义[14]。然而,在许多中心HoLEP并没有取代TURP和OSP,一个重要的原因就是HoLEP技术难度高、学习曲线长。Robert等[15]开展了一项关于HoLEP学习曲线的多中心前瞻性研究,在起始阶段4个中心放弃了HoLEP,5个中心完成实验,最终结果显示,对于有丰富TURP和OSP手术经验的医生,至少需要完成20例HoLEP才能达到满意的剜除和组织粉碎效率。Shah等[16]评估了一位有丰富经验的腔内泌尿外科医生的学习曲线,在研究了最初160例HoLEP的资料后得出结论,至少需要完成50例HoLEP,剜除和组织粉碎效率才能得到显著提高。
自Mariano等[5]首次报道LSP后,许多中心相继开展LSP,根据手术入路的不同,主要分为经前列腺包膜技术和经膀胱技术[17]。Asimakopoulos等[18]一项纳入14项研究626例患者的系统综述发现,与OSP相比,LSP具有出血少、膀胱冲洗率低、导尿管留置时间及住院时间短等优势,而手术时间较长。Demir等[19]研究发现,LSP组手术时间、切除的前列腺质量、并发症发生率与OSP组比较无差异,而术中出血量、术后镇痛药物用量、导尿管留置时间、拔除导尿管后尿失禁发生率、住院时间显著优于OSP组;术后3个月LSP组Qmax显著高于OSP组,而IPSS、QOL、PVR两组差异无统计学意义。单孔腹腔镜前列腺单纯切除术虽也有报道,但由于难度更高,只有少数中心开展[20]。近年来,国内许多医院也开展了LSP技术并取得了良好的效果,进一步证实了LSP治疗大体积BPH的安全性与有效性[21~23]。
由于腹腔镜前列腺癌根治术及全膀胱切除术等手术的普遍开展,泌尿外科医生对于前列腺及膀胱周围的解剖已经非常熟悉。此外,机器人手术系统清晰的3D视野、高度灵活的机械臂等优势使OSP在机器人手术中的移植成为可能。2008年Sotelo等[6]首次报道了RASP技术后,RASP在全球多个中心得到推广。根据OSP手术路径的不同,RASP可分为经前列腺包膜和经膀胱技术,两种方式均可通过腹膜外途径和经腹腔途径完成,这与前述的LSP相同[17]。本中心在国内较早开展RASP治疗大体积BPH,手术采用经腹经膀胱途径,选择此手术路径,主要由于本中心下尿路及大部分上尿路机器人手术均采用经腹腔途径完成,术者对于经腹腔手术具有丰富的经验。此外,我们发现经腹腔途径手术空间更大、术野更清晰,经膀胱手术更便于观察输尿管开口、处理膀胱结石及进行膀胱颈-尿道环形吻合。
腺体剜除和膀胱颈重建是RASP的两个关键步骤。在腺体剜除中,打开膀胱前壁后可用2~4根缝线牵拉以获得满意的术野显露。首先辨认双侧输尿管开口位置,在后续手术过程中避免损伤输尿管开口。腺体剜除一般从中叶开始,这样可以避免从其他位置开始导致的出血干扰包膜层面的辨认。于膀胱颈后壁与前列腺交界处打开膀胱黏膜,找到相对光滑且无血管的平面即前列腺外科包膜层面,沿此层面向两侧叶及前列腺尖部钝性推进。对于慢性前列腺炎或前列腺穿刺等所致的包膜粘连或不光滑的部位可锐性游离,应避免层面丢失而进入腺体内部。如出现层面丢失,可完全游离周围层面确实的部位后再锐性切断粘连部位。应尽可能多的保留前列腺尖部尿道并用剪刀剪断尿道,从而最大限度地保护外括约肌。膀胱颈重建有多种方式:Sotelo等[6]采用与OSP相同的方式进行重建,即将膀胱颈后壁黏膜与前列腺尖部尿道后壁或前列腺窝后壁吻合;Coelho等[24]对重建方式进行了改进,包括前列腺包膜后壁折叠、改进的van Velthoven式膀胱尿道吻合、前列腺包膜前壁与膀胱前壁吻合等;Cacciamani等[25]采用360°环形吻合法重建膀胱颈部,据报道,这种方式可以减少RASP术后出血及持续膀胱冲洗时间。因缺乏比较研究,各种重建技术的优劣尚无定论。本中心采用环形吻合法重建膀胱颈部,完全恢复膀胱尿道黏膜的连续性及平整性,尿路刺激症状轻,术后无需膀胱冲洗,拔除导尿管后未见尿失禁发生。
许多研究报道RASP较OSP、HoLEP或LSP的手术时间长,这可能与机器人手术穿刺鞘放置及机械臂连接需要额外时间有关,此外,RASP初期学习曲线的影响也可能是导致手术时间延长的原因[17, 20, 26, 27]。本组RASP平均手术时间158.5 min,与文献报道的相近。然而,延长的手术时间并没有导致术中并发症的增加。Pavan等[27]研究发现,RASP术中并发症发生率较LSP低,但差异无统计学意义,而总体并发症发生率RASP显著高于LSP,进一步分析发现,RASP大部分术后并发症为Clavien 1~2级,这些并发症对于术后康复影响较小,而Clavien 3~4级并发症发生率两组差异无统计学意义。Martín Garzón等[28]研究发现,RASP与LSP相比,术中及术后并发症发生率差异无统计学意义。在一项纳入35 000例接受单纯前列腺切除术的研究中,Pariser等[4]发现微创前列腺单纯切除术的并发症发生率较低。本研究中1例患者因前列腺体积过大(186 ml),且术前1周行前列腺穿刺活检排除前列腺癌,术中见增生的腺体与包膜粘连,分离过程中出血较多而进行输血治疗,其余患者无并发症发生。Autorino等[17]报道RASP的平均住院时间为2 d,而本组术后平均住院时间为6.3 d,这主要由于国内外医疗体系差异造成,欧美国家健全的康复机构使得患者术后1 d即可出院休养,而本单位绝大多数患者需要待拔除导尿管甚至拆线后出院。本组术后3个月随访数据显示,患者Qmax、PVR、IPSS、QOL等较术前显著改善,这与国外文献报道的数据基本一致[17, 29]。
本研究初步结果证实,RASP弥补了OSP及HoLEP的不足,具有创伤小、并发症少、效果确切等优势,是治疗大体积前列腺增生安全、有效的手术方式。目前机器人手术系统在国内尚未普及,RASP费用较高,这在一定程度上限制了该技术的推广。随着微创技术的发展,机器人手术系统将逐渐普及,RASP也将会有更广阔的应用前景。由于本研究样本量少、随访时间短、未设置对照等不足,RASP的临床疗效及安全性仍需大规模前瞻性随机对照研究进一步证实。

