3.0T MRI与MSCT对胃癌术前T分期的诊断价值
秦书敏,刘亚良,黄光建,王 萌
近年来,胃癌稳居恶性肿瘤发病率与病死率前列,尤其中晚期患者预后极差,现已成为全世界瞩目的公共卫生问题[1-3]。目前,对胃癌最有效的根治方法仍以手术切除为主,因而术前早期明确诊断及辨明原发灶侵犯(T)程度分期至关重要[4]。随着影像学技术的飞速发展,3.0T核磁共振成像(MRI)及多层螺旋CT(MSCT)的临床应用越发广泛。基于此,本研究旨在探究3.0T MRI及MSCT对胃癌T分期的诊断效果,取得成果报告如下。
1 资料与方法
1.1一般资料 回顾性分析2016年1月—2017年12月于我院接受治疗的68例胃癌患者的临床资料。①纳入标准:临床症状及胃镜下病理学活检结果均符合胃癌相关诊断标准[5];年龄40~80岁;术前接受3.0T MRI及MSCT检查者。②排除标准:诊断为非原发性胃癌;体内有植入金属物或伴有高热者;影像学检查前已接受放化疗或手术干预者;有胃部或其他消化系统外科手术史者;伴有肾功能异常、甲状腺功能亢进或对比剂过敏者。其中男41例,女27例;年龄41~77(57.8±11.3)岁;肿瘤位置:胃窦32例,胃底贲门20例,胃体部小弯侧11例,胃体部大弯侧5例;病理类型:乳头状腺癌20例,管状腺癌17例,低分化腺癌16例,黏液腺癌13例,腺鳞癌2例。
1.2设备与检查方法 所有患者低渣饮食1 d并严格禁饮禁食8 h,于检查前10 min肌注胃肠蠕动抑制药物,并至少饮用800 ml温开水充盈胃腔,予以拍背排出胃腔内空气。
1.2.13.0T MRI检查:采用美国GE公司提供的Signa Excited 3.0T MRI系统,患者取仰卧位并高举双臂,应用8通道腹部相控阵表面线圈,平扫T2加权成像(T2WI)矩阵288×224,扫描野为40×40,层间距1.5 mm,层厚6 mm,以快速自旋回波序列(FSE),TR=7500 ms,TE=100 ms,切换快速翻转FSE与单次激发FSE并实施脂肪抑制;T1WI矩阵288×192,以扰相梯度回波序列,TR=220 ms,TE=2.5~5.5 ms;弥散加权成像(DWI)采用单激发自旋回波-回波平面成像(SE-EPI)技术,矩阵为128×128,TR=1500 ms,TE=56 ms,扩散系数b=0、800 s/mm2;增强扫描应用肝脏快速容积成像技术(LAVA),TR=2.6 ms,TE=1.2 ms,矩阵277×160,层厚5 mm,对比剂则采用钆喷酸葡胺0.2 mmol/kg,高压静脉推注后于20 s、50 s、3 min时进行屏气三期增强扫描。
1.2.2MSCT检查:采用德国SIEMENS公司提供的SOMATOM Sentation 64层螺旋CT扫描仪,患者取仰卧位行常规平扫,扫描范围自膈顶至脐下,设置工作电压120 kV,工作电流100 mA,矩阵512×512,螺距1.0,层间距0.5 mm,层厚5 mm;增强扫描对比剂采用300 mg/ml的碘海醇100 ml,注射速率为3.5ml/s,于开始注射后25 s、60 s、3 min时予以动态扫描。
1.3图像分析 主要观察病灶部位、胃壁厚度、肿瘤形态及各序列下信号变化特点,MRI影像着重分析胃壁浸润及邻近器官受累程度,辨明病灶与周围血管的关系,MSCT则着重观测三期增强扫描CT值变化。
1.4评估标准 参照国际抗癌联盟发布的第8版胃癌分期手册进行T分期判定[6],T1期:肿瘤局限于黏膜或黏膜下层;T2期:肿瘤浸润超过黏膜下层,但局限于固有肌层;T3期:肿瘤浸润超过固有肌层但局限于浆膜下组织;T4期:肿瘤侵犯浆膜、脏层腹膜或临近组织。
2 结果
2.1影像特征分析 3.0T MRI检查的影像可见明显胃壁增厚,尤以胃窦与胃底贲门区域增厚程度较大,肿瘤呈T1WI等信号或稍高,T2WI则呈明显高信号,部分患者有胃黏膜皱襞征象,病灶在DWI中显示为低表观弥散系数值,在LAVA中观察到延迟期胃壁病变层信号强化明显。典型病例影像见图1和2。MSCT检查的影像可明确分辨胃壁3层构造,动脉期及门静脉期可表现出不同层面增强效果,如脂肪层覆盖则稍有不清晰影像。典型病例影像见图3和4。
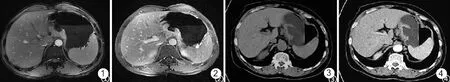
图1 3.0T MRI T2WI单次激发FSE影像,可见胃周脂肪低信号带稍显紊乱,癌肿难以辨析图2 3.0T MRI LAVA门静脉期增强扫描影像,可见癌肿有明显不规则强化征象,与浆膜外表面界限清晰图3 MSCT平扫影像,可见贲门区不规则增厚,脂肪间隙较为清晰但浆膜层毛糙难辨图4 MSCT门静脉期增强扫描影像,可见胃壁增厚全层强化,有显著侵袭固有肌层征象,但未见癌肿进犯浆膜层
MRI为核磁共振成像,MSCT为多层螺旋CT,FSE为快速自旋回波序列,LAVA为肝脏快速容积成像技术,T2WI为T2加权成像
2.2诊断符合率比较 68例患者经手术病理组织学检测确诊,T1期8例(11.8%),T2期14例(20.6%),T3期30例(44.1%),T4期16例(23.5%)。3.0T MRI诊断总体符合率为91.2%(62/68),MSCT诊断符合率为75.0%(51/68),3.0T MRI对胃癌术前T分期诊断总体符合率高于MSCT(χ2=6.332,P=0.012)。见表1和2。

表1 3.0T MRI与组织学检测对胃癌术前T分期诊断结果(例)
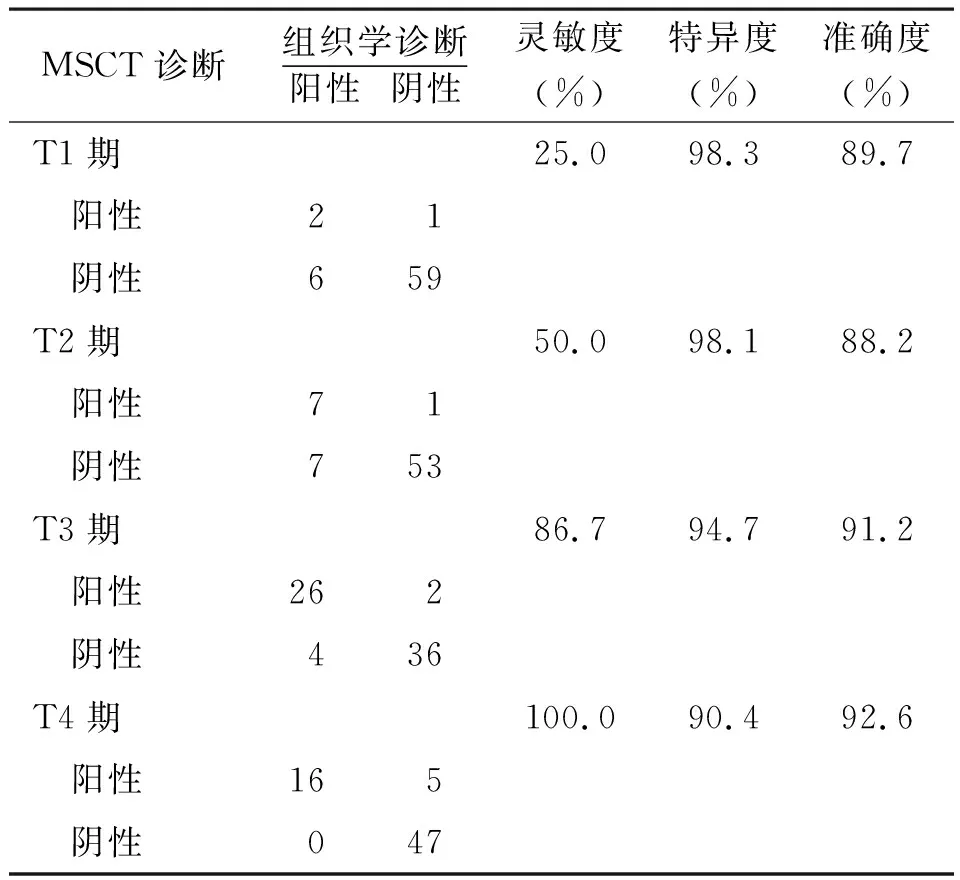
表2 MSCT与组织学检测对胃癌术前T分期诊断结果(例)
3 讨论
目前,我国癌症的防治形势严峻,早预防、早发现、早治疗成为临床研究的重点[7]。临床公认的肿瘤分期标准为原发灶侵犯-淋巴结转移-血道远处转移(TNM)分期[8-9]。T分期越高则代表原发灶侵犯程度越深,故不同T分期胃癌患者往往具有迥异的治疗方法与预后,因此术前进行准确的分期评估尤为关键。
既往上消化道肿瘤进展情况观察多应用胃镜、超声和X线下气钡双重造影[10]。但仅能识别黏膜表面病理改变,即使予以肿瘤表面组织病理活检,仍难以确认肿瘤浸润深度及胃肌-浆膜层和相邻脏器受累情况。据相关文献报道,胃浆膜层是否受累是决定手术切除范围及5年生存率的主要因素[11]。T1与T2期胃癌属于早期局灶性病变,进行根治性手术治疗可获得相对较长的存活率[12-13];而T3与T4期胃癌则属于局部进展期病变,通常先予以辅助化疗缩小病灶,以期达到可切除条件进行手术治疗,但预后生存率仍较差[14-15]。本研究采用的3.0T MRI及MSCT辨别肿瘤病灶与胃壁病变层相对位置关系明确,且增强扫描时影像变化特征显著,其中MSCT或可受到脂肪层干扰,这表明两种检查方法对胃癌肿瘤病灶均具备较高敏感性,但由于成像原理不同,亦受到不同类型因素的影响。有学者指出,MSCT下胃壁外表面轮廓可出现不规则强化与毛糙,周围脂肪层间隙模糊不清,可出现不规则条索状影[16]。而MRI的LAVA动态增强扫描中,信号采集时间短,可减少呼吸伪影及容积效应故图像更为清晰,胃壁外层表面信号规整[17]。
普通CT层厚较大,扫描时间过长而图像质量欠佳,尤其对胃癌分期评估灵敏度极低[18]。MSCT则能通过提高图像分辨率保持清晰度,并结合多项重建技术使得诊断阅片更为直观[19-20]。而不同于超声内镜的侵入性检查手段及CT的电离辐射危害,MRI检查安全性及耐受性良好,能有效观察胃底贲门等胃镜盲区[21];加之较高的分辨率,充分保障胃癌分期诊断的准确性。相关研究表明,增强扫描是3.0T MRI诊断胃癌的核心技术,如肿瘤侵袭周围组织,相交处延迟期强化明显,故其特异性相对较强[22]。本研究结果发现,3.0T MRI对胃癌T分期诊断符合率明显高于MSCT,这说明3.0T MRI可凭借脂肪抑制序列提高软组织分辨率,在诊断胃癌分期中较MSCT具有更大优势。周衍锋和张景峰[23]研究认为,3.0T MRI在胃癌T分期诊断准确率较高,而MSCT则在N分期评估方面不可替代,二者联合运用能弥补各自不足,以获得更准确的分期结果。
综上所述,3.0T MRI与MSCT在胃癌诊断中均有一定应用价值,其中3.0T MRI对T分期的诊断符合率较高,更有利于术前获取肿瘤病灶累及区域的准确信息。

