丹参多酚酸盐对肝硬化门静脉高压抑制作用的研究
武向鹏,崔 薇
(1.邯郸市中心医院普外六科,邯郸 056001;2.邯郸市中心医院,邯郸 056001)
肝硬化是一种慢性肝脏组织纤维化疾病,随着病情进展将诱发肝血管结构、血液循环紊乱进而导致门静脉高压,是最终导致肝硬化患者死亡的主要原因。丹参是传统中药丹参的主要活性成分之一,具有抗炎、抗氧化、改善血液流变学等多种生物学活性[1-3],王玲等[4]研究发现丹参多酚酸能够通过降低肾小管间质激活素A表达而对糖尿病肾脏组织纤维化具有一定的抑制作用。本实验通过腹腔注射二甲基亚胺(DMN)诱导制备肝硬化门静脉高压大鼠模型,以秋水仙碱为阳性对照药物,研究丹参多酚酸盐对肝硬化门静脉高压的抑制作用。
1 材料与方法
1.1 实验动物 清洁级雄性SD大鼠(8周龄,210~250 g)购自河北省实验动物中心[SCXK(冀)2008-1-003]。饲养环境:恒温23~25℃、相对湿度65%~70%、光照周期 12 h∶12 h。
1.2 药物与试剂 丹参多酚酸盐购自上海绿谷制药有限公司(批号:170109);秋水仙碱购自美国Sigma公司(批号:2016348);谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、MDA 试剂盒购自北京博奥森生物工程有限公司(批号分别为:170108、161124、17 0325、170116、161219、170105);IV 型 胶原(C-IV)、III型前胶原(PC-III)、透明质酸酶(HA)、层粘连蛋白(LN)、羟脯氨酸(HYP)、酶联免疫试剂盒(ELISA)购自上海碧云天生物技术有限公司 (批号分别为:20170112、20170308、20161130、20161019、20170115、;二甲基亚硝胺(DMN)购自天津化学试剂研究所(批号:20151230)。
1.3 实验方法
1.3.1 模型制备与分组 参照Ala-Kokko L等[5]报道的实验方法制备肝硬化门静脉高压大鼠模型:腹腔注射DMN(10 mg/kg),每周3 d连续注射,每日1次,持续4周;正常对照大鼠同步给予等剂量的生理盐水。取100只模型大鼠按照随机数字表法随机分为模型组(生理盐水)、丹参多酚酸盐[12、24、48 mg/(kg·d)]治疗组和秋水仙碱0.1 mg/(kg·d)治疗组[6],每组20只,另取20只同龄大鼠设为正常对照组,疗程6周。
1.3.2 血清中指标检测 完成第6周给药后,腹腔注射水合氯醛(2%,5 mL/kg)实施麻醉,开腹、游离腹主动脉后取血、肝素抗凝、1 500 rpm离心10 min,取血清,严格按照各试剂盒操作方法步骤,通过全自动生化分析仪测定血清中ALT、AST、TBIL含量,通过酶标仪测定血清中C-IV、PC-III、LN、HA含量。1.3.3 肝脏组织生化指标检测 待取血完成后,取肝脏组织、置于适量冷裂解液中,匀浆处理后行3 000 rpm离心10 min,取上清液,按照试剂盒方法步骤处理后,通过酶标仪测定HYP水平,通过紫外分光光度计测定SOD、CAT活性和MDA含量。
1.3.4 肝脏组织病变观察 待取血完成后,取肝脏组织、置于4%多聚甲醛溶液固定、石蜡包埋、切片处理后,行常规苏木精-伊红(HE)染色,通过倒置光学显微镜观察肝脏组织形态结构变化。
1.3.5 门静脉高压指标测定 各指标通过八道生理记录仪测量并记录:腹腔注射水合氯醛实施麻醉、仰位固定、开腹并游离肝门静脉,放置合适口径的电磁头后连接电磁流量计测定PVF;静脉穿刺针作门静脉主干穿刺并固定以测定PVP;右颈动脉插管用于测定MAP和HR。
1.4 统计学方法 采用SPSS19.0软件分析,实验数据采用均数±标准差(±s)表示,多组间均数比较使用单因素方差分析,组间两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清中ALT、AST、TBIL含量测定结果 与正常对照组相比,模型组大鼠血清ALT、AST、TBIL含量显著升高(P<0.01);与模型组相比,丹参多酚酸盐24、48 mg/(kg·d)组ALT、AST、TBIL含量显著降低(P<0.05或P<0.01),秋水仙碱0.1 mg/(kg·d)组ALT、AST含量显著降低(P<0.05)。结果见表1。
2.2 各组大鼠肝脏组织病变 正常对照组大鼠肝脏组织形态结构未见异常;模型组呈现组织纤维化、增生、炎细胞侵润等病理性形态结构改变;与模型组相比,丹参多酚酸盐各剂量组和秋水仙碱组肝脏组织病变明显改善,以丹参多酚酸盐48 mg/(kg·d)组效果最为显著。
2.3 各组大鼠血清中C-IV、PC-III、LN、HA含量和肝脏组织中HYP水平测定结果 与正常对照组比较,模型组血清C-IV、PC-III、LN、HA含量和肝脏HYP水平显著升高(P<0.01);与模型组相比,丹参多酚酸盐24、48 mg/(kg·d)组和秋水仙碱0.1 mg/kg组血清中C-IV、PC-III、HA含量显著降低(P<0.05或P<0.01),丹参多酚酸盐24、48 mg/(kg·d)组肝脏组织中HYP水平显著降低(P<0.05)。结果见表2。
表1 各组大鼠血清中ALT、AST、TBIL含量(±s)Tab.1 Contentsof ALT,AST,TBIL in serum of each group rats(±s)
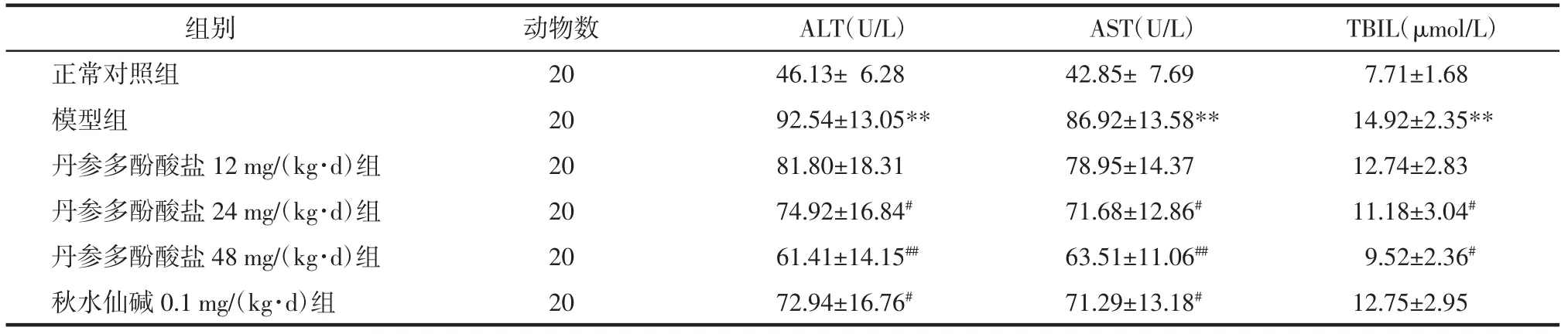
表1 各组大鼠血清中ALT、AST、TBIL含量(±s)Tab.1 Contentsof ALT,AST,TBIL in serum of each group rats(±s)
注:与正常对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
AST(U/L) TBIL(μmol/L)正常对照组 42.85± 7.69 7.71±1.68模型组 86.92±13.58** 14.92±2.35**丹参多酚酸盐12 mg/(kg·d)组78.95±14.37 12.74±2.83丹参多酚酸盐24 mg/(kg·d)组71.68±12.86#11.18±3.04#丹参多酚酸盐48 mg/(kg·d)组63.51±11.06##9.52±2.36#秋水仙碱0.1 mg/(kg·d)组71.29±13.18#12.75±2.95动物数20 20 20 20 20 20组别ALT(U/L)46.13±6.28 92.54±13.05**81.80±18.31 74.92±16.84#61.41±14.15##72.94±16.76#
表2 各组大鼠血清中C-IV、PC-III、LN、HA含量和肝脏组织中HYP水平(±s)Tab.2 Content of C-IV,PC-III,LN,HA in serum and thelevel of HYPin each group rats(±s)
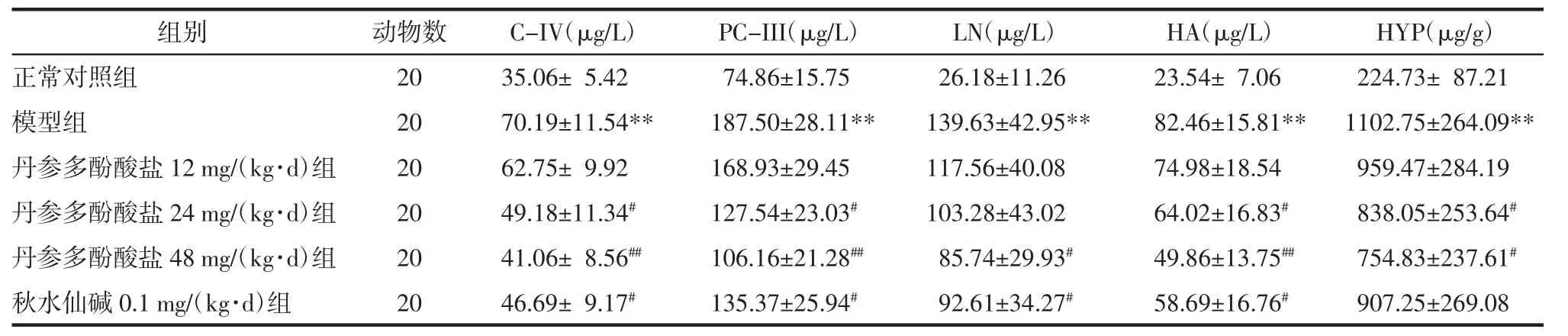
表2 各组大鼠血清中C-IV、PC-III、LN、HA含量和肝脏组织中HYP水平(±s)Tab.2 Content of C-IV,PC-III,LN,HA in serum and thelevel of HYPin each group rats(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别PC-III(μg/L)LN(μg/L)HA(μg/L)HYP(μg/g)正常对照组 74.86±15.75 26.18±11.26 23.54± 7.06 224.73± 87.21模型组 187.50±28.11** 139.63±42.95** 82.46±15.81** 1102.75±264.09**丹参多酚酸盐12 mg/(kg·d)组168.93±29.45 117.56±40.08 74.98±18.54 959.47±284.19丹参多酚酸盐24 mg/(kg·d)组127.54±23.03#103.28±43.02 64.02±16.83#838.05±253.64#丹参多酚酸盐48 mg/(kg·d)组106.16±21.28##85.74±29.93#49.86±13.75##754.83±237.61#秋水仙碱0.1 mg/(kg·d)组135.37±25.94#92.61±34.27#58.69±16.76#907.25±269.08动物数20 20 20 20 20 20 C-IV(μg/L)35.06±5.42 70.19±11.54**62.75±9.92 49.18±11.34#41.06±8.56##46.69±9.17#
2.4 各组大鼠PVP、PVF、MAP、HR测定结果 与正常对照组相比,模型组大鼠PVP、PVF、HR明显升高且 MAP 明显降低(P<0.05 或 P<0.01);与模型组相比,丹参多酚酸盐24、48 mg/(kg·d)组PVP、PVF明显降低(P<0.05),其中48 mg/(kg·d)组MAP明显升高、HR 明显降低(P<0.05),秋水仙碱 0.1mg/kg 组PVP 明显降低(P<0.05),PVF、MAP、HR 与模型组比较,差异无统计学意义(P>0.05)。结果见表 3。
2.5 各组大鼠肝脏中SOD、CAT活性和MDA含量测定结果 与正常对照组相比,模型组大鼠肝脏中SOD、CAT活性明显降低且MDA含量明显升高(P<0.01);与模型组相比,丹参多酚酸盐24、48 mg/(kg·d)组SOD、CAT活性明显升高且MDA 含量明显降低(P<0.05 或 P<0.01),秋水仙碱0.1mg/kg组 MDA 含量明显降低(P<0.05),SOD、CAT活性与模型组比较,差异无统计学意义(P>0.05)。结果见表4。
3 讨论
二甲基亚硝胺(DMN)诱导法和CCl4诱导法[7]是制备肝硬化门静脉高压大鼠模型的常用方法,其中DMN诱导法制备的模型在组织形态学和病理生理学等方面均与人类肝硬化相似,因此本实验采用DMN诱导法制备肝硬化门静脉高压大鼠模型。血清中IV 型胶原(C-IV)、PC-III、HA、LN 含量是肝硬化常用监测指标,胶原纤维大量增生是肝硬化发展的重要病理机制,其主要成分为胶原蛋白,所以主要存在与胶原蛋白中的羟脯氨酸(HYP)含量能够间接反映肝硬化发展程度[8]。本实验研究发现,经丹参多酚酸盐24~48 mg/(kg·d)治疗6周能够有效降低肝硬化门静脉高压大鼠血清C-IV、PC-III、LN、HA含量及肝脏中HYP水平,PVP、PVF、HR并提高MAP,ALT、AST、TBIL含量,改善肝脏组织病变,提示丹参多酚酸盐对大鼠肝硬化门静脉高压具有一定的抑制作用。
Coulon等[9]和Lee等[10]研究发现,肝硬化门静脉高压时将诱发体内氧自由基(ROS)过剩而导致机体氧化应激损伤;而降低氧化应激水平则能够显著提高肝组织一氧化氮(NO)水平并降低门静脉压力,恢复门静脉血流[11]。正常生理状态下,体内氧自由基(ROS)能够在SOD、CAT的逐步催化作用下被还原[12-13],从而维持体内ROS动态平衡;若ROS生成与清除动态失衡,将攻击细胞膜而生成MDA[14];因此,SOD、CAT活性和MDA含量分别能够直接和间接反应机体氧化应激损伤程度。本实验研究发现,经丹参多酚酸盐24~48 mg/(kg·d)治疗6周能够有效提高SOD、CAT活性并降低MDA含量,提示丹参多酚酸盐降低肝硬化门静脉高压大鼠肝内血管阻力和门静脉压的作用机制可能与降低肝脏组织氧化应激损伤可能与提高抗氧化酶活性有关。
表 3 各组大鼠 PVP、PVF、MAP、HR(±s)Tab.3 PVP,PVF,MAP,HR in each group rats(±s)
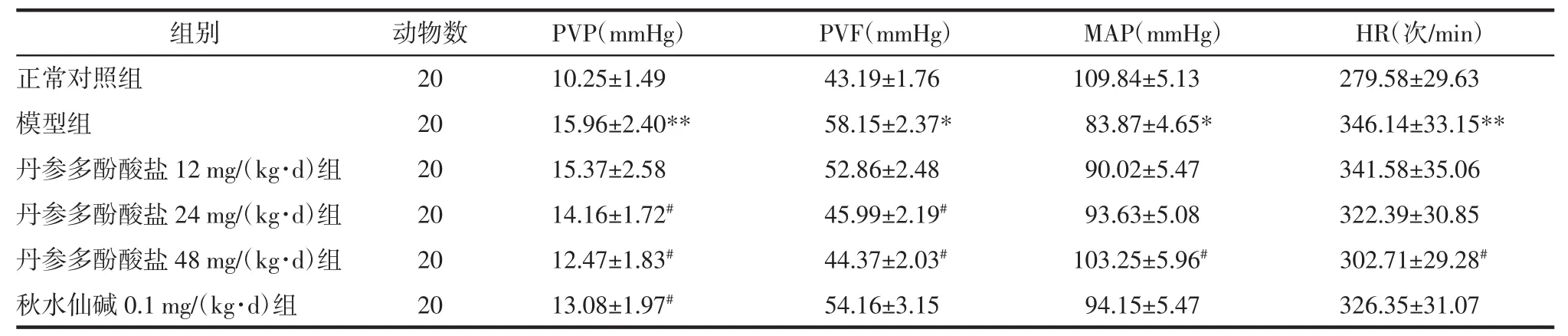
表 3 各组大鼠 PVP、PVF、MAP、HR(±s)Tab.3 PVP,PVF,MAP,HR in each group rats(±s)
注:与正常对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01。
丹参多酚酸盐48 mg/(kg·d)组秋水仙碱0.1 mg/(kg·d)组20 20 HR(次/min)279.58±29.63 346.14±33.15**341.58±35.06 322.39±30.85 12.47±1.83# 44.37±2.03# 103.25±5.96# 302.71±29.28#13.08±1.97# 54.16±3.15 94.15±5.47 326.35±31.07
表4 各组大鼠肝脏中SOD、CAT活性和MDA含量(±s)Tab.4 Activity of SOD,CAT and the content of MDA ineach group rats(±s)U/mg prot

表4 各组大鼠肝脏中SOD、CAT活性和MDA含量(±s)Tab.4 Activity of SOD,CAT and the content of MDA ineach group rats(±s)U/mg prot
注:与正常对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
CAT MDA正常对照组 4.37±0.76 5.36±1.21模型组 2.60±0.68** 12.74±3.58**丹参多酚酸盐12 mg/(kg·d)组2.70±0.92 11.02±3.19丹参多酚酸盐24 mg/(kg·d)组3.36±0.87#8.48±2.65##丹参多酚酸盐48 mg/(kg·d)组3.79±0.75##6.54±2.42##秋水仙碱0.1 mg/(kg·d)组2.98±0.58 9.37±3.01#组别 动物数20 20 20 20 20 20 SOD 12.68±1.43 8.96±1.75**9.47±1.62 10.79±2.19#11.47±2.34##9.36±1.52
综上所述,丹参多酚酸盐对大鼠肝硬化及门静脉高压具有一定的抑制作用;其机制可能与丹参多酚酸盐能够降低氧化应激损伤。

