甲基强的松龙通过下调ERK1/2-NF-κB信号通路减轻实验性自身免疫性脑脊髓炎小鼠脊髓炎症
张 健, 曾育琦, 沈 辉, 康德勇, 张 静, 陈晓春
多发性硬化(multiple sclerosis,MS)是中枢神经系统慢性炎性脱髓鞘疾病,是引起中青年人致残的主要原因,其发病机制尚未完全阐明。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)具有与人类MS相似的临床病理及免疫学特征,是模拟MS较好的动物模型。目前认为,致炎性T淋巴细胞介导的免疫反应是MS及EAE的主要发病机制。1型辅助性T细胞(helper T cells,Th1)和Th17细胞及其分泌的细胞因子通过血脑屏障进入中枢神经系统,引起炎症细胞浸润、髓鞘脱失及轴索损害。这一过程涉及多条信号通路。Agrawal等发现,细胞外信号调节激酶(extracellular signal-regulated kinase,ERK1)敲除小鼠较野生型小鼠对EAE更易感,临床症状更严重[1]。在MS患者的脑组织及EAE小鼠的脊髓中检测到活化的核因子-κB(nuclear factor-κB,NF-κB)[2-3]。这些研究提示ERK-NF-κB信号通路在EAE的发生和发展中起重要作用。
本研究应用髓鞘少突胶质细胞糖蛋白35-55多肽(MOG35-55)免疫诱导雌性C57BL/6小鼠,建立EAE模型,待小鼠发病后给予甲基强的松龙(methylprednisol,MP)治疗,在体观察EAE小鼠的临床症状、脊髓病理及炎症介质变化,进一步探索其可能机制,为MP的临床使用提供理论依据。
1 材料与方法
1.1材料 8~10周龄雌性C57BL/6小鼠,购于上海斯莱克实验有限公司[许可证号SCXK(沪)2007-0005,合格证号200700506479]。鼠源MOG35-55多肽(MEVGWYRSPFSRVVHLYRNGK)由上海生物工程有限公司合成,采用高效液相色谱仪纯化,HPLC纯度>98%;福氏完全佐剂(complete freund’s adjuvant,CFA)、百日咳毒素(pertussis toxin,PT)、罗克沙尔坚牢蓝染料(luxol fast blue,LFB)(美国Sigma公司);灭活结核杆菌(mycobacterium tuberculosis H37Ra)(美国Difco公司);MP(大连辉瑞制药公司);一抗磷酸化ERK1/2,ERK1/2及磷酸化NF-κB,NF-κB(美国Cell Signaling公司),T-bet和RoRγt(美国Abcam公司)。
1.2方法
1.2.1模型建立及动物分组 每只小鼠配制200 μL乳化剂(MOG35-55300 μg,结核杆菌500 μg),于双侧胁部皮下分4点注射免疫小鼠,每侧2点,每点50 μL乳化液[4]。于免疫当日(0天)及48 h(2 d)腹腔内注射400 ng PT。免疫后每天同一时间点测量小鼠的体质量并进行神经功能评分[5]:无症状为0分;尾部瘫痪为1分;共济失调、后肢轻瘫为2分;双后肢瘫痪为3分;四肢瘫痪为4分;死亡为5分。
将MOG35-55诱导的10~14 d发病且神经功能评分为1~4分的EAE小鼠随机分为溶媒组(腹腔注射PBS 0.1 mL)和MP组(腹腔注射MP 40 mg/kg),每组9~12只,于每日同一时间(10:30 am)腹腔注射给药,每天1次,共给药7 d;另取9只同龄小鼠作为对照组(Control组),每日腹腔注射0.1 mL PBS,连续注射7 d。所有小鼠于免疫后第29天处死。
1.2.2组织病理学染色 每组取3只小鼠,经3 mL/kg 10%水合氯醛腹腔注射麻醉,将预冷的4%多聚甲醛-0.1 mmol/L PBS(pH=7.2)由左心室内灌注,冰面上快速取小鼠腰膨大,置于预冷的4%多聚甲醛-0.1 mmol/L PBS,4 ℃固定24 h后石蜡包埋,沿脊髓横切面连续切片,行H-E及LFB染色。根据以下评分标准定量炎症情况[6]:无细胞浸润为0分;脊膜细胞浸润为1分;软脊膜少许炎症细胞浸润(1~10个/视野)为2分;软脊膜中等量炎症细胞浸润(11~100个/视野)为3分;大量炎症细胞浸润(>100个/视野)为4分。髓鞘脱失定量采用以下标准[7]:无髓鞘脱失为0分;软脊膜下轻度髓鞘脱失为1分;显著软膜下血管周围脱髓鞘为2分;融合血管周围及血管下脱髓鞘为3分;累及一半以上脊髓范围髓鞘脱失为4分;大片髓鞘脱失延及整个脊髓为5分。每组剩余小鼠经0.1 mmol/L的PBS灌注后,冰上快速分离脊髓,液氮速冻后保存于-80 ℃冰箱。
1.2.3透射电镜检查 电镜标本取材后经3%戊二醛-1.5%多聚甲醛前固定2 d(4 ℃),1%锇酸-1.5%亚铁氰化钾后固定1.5 h,PBS漂洗;70%酒精饱和醋酸铀染液块染,酒精-丙酮梯度脱水,环氧树脂618包埋剂包埋。超薄切片80 nm,醋酸铀、柠檬酸铅各染色5 min,透射电镜(EM 208型,荷兰飞利浦公司)下观察、摄影。
1.2.4实时荧光定量PCR 抽提小鼠脊髓总RNA,逆转录为cDNA,由荧光定量PCR仪(ABI 7500,美国ABI公司)进行定量检测。引物序列由上海生物工程有限公司合成。
IFN-γ:
F1:5′-ATGGCTGTTTCTGGCTGTTACT-3′
R1:5′-GGATTTTCATGTCACCATCCTT-3′
IL-17:
F1:5′- GCAATGAAGACCCTGATAGA-3′
R1:5′- TCTTCTCGACCCTGAAAGTGA-3′
IL-4:
F1:5′-GTCCTCACAGCAACGAAGAAC-3′
R1:5′-TGATGCTCTTTAGGCTTTCCA-3′
IL-5:
F1:5′-ACAAGCAATGAGACGATGAGG-3′
R1:5′-CCACGGACAGTTTGATTCTTC-3′
IL-21:
F1:5′-CCATCAAACCCTGGAAACAATA-3′
R1:5′-TCTTTGGGTGTCCTTTTCT CAT-3′
IL-23:
F1:5′-ATCCAGTGTGAAGATGGTTGTG-3′
R1:5′-AGTAGGGAGGTGTGAAGTTGCT-3′
IL-10:
F1:5′-ACAGCCGGGAAGACAATAACT-3′
R1:5′-GCATTAAGGAGTCGGTTAGCA-3′
T-bet:
F1:5′-CAACCAGCACCAGACAGAGAT-3′
R1:5′-CAAGACCACATCCACAAACATC-3′
RoRγt:
F1:5′-ATGCCAACAACCACACAGTCT-3′
R1:5′-TGAGGAAGTGGGAAAAGTCAA-3′
GAPDH:
F1:5′-CAGTGGCAAAGTGGAGTTGTTG-3′
R1:5′-CTCGCTCCTGGAAGATGGTGAT-3′
实时PCR反应体系:2×ROX 10 μL,上下游引物各0.6 μL,cDNA模板1 μL,无RNA酶水7.8 μL。反应条件:50 ℃预变性2 min;95 ℃变性10 min;95 ℃变性15 s,60 ℃退火延伸60 s,进行40个循环。反应结束后进行熔解曲线分析引物的特异性。用相对定量2-△△Ct法比较各组间炎症因子及转录因子mRNA的相对表达差异。每份标本均重复检测3管,取均值作为目的基因的表达水平。
1.2.5Western-blot测定 脊髓组织经超声裂解后,采用BCA法进行蛋白定量后取50 μg样品,10% SDS-聚丙烯酰胺凝胶电泳分离,湿电转移法将蛋白转移到PVDF膜上,室温下封闭液封闭1 h,将膜移入用封闭液稀释的一抗(pERK1/2,ERK1/2,T-bet,RoRγt,pNF-κB及NF-κB均为1∶1 000稀释)。4 ℃孵育过夜,洗液洗涤,辣根过氧化物酶耦联的IgG二抗(1∶1 000~1∶2 000稀释)反应60~90 min,洗液洗涤,化学发光法显色,X射线底片曝光,actin作为内参照(1∶2 000稀释,英国Abcam公司)。

2 结 果
2.1MP改善EAE小鼠的临床神经功能 重复性方差分析显示,各组间总体主效应——时间(P<0.001)和组别(P<0.01)均有统计学意义,并且存在交互作用(P<0.001,图1)。与溶媒组比较,MP组的临床神经功能评分明显降低,停止腹腔注射MP后,临床症状无复发。
2.2MP减轻EAE小鼠脊髓炎症细胞浸润和髓鞘脱失 对照组小鼠H-E染色显示,脊髓未见炎性细胞;LFB染色显示,蓝色髓鞘排列规则,着色均匀;电镜显示,小鼠脊髓髓鞘板状结构清晰,细胞器结构致密完整。溶媒组小鼠H-E染色见脊髓大量炎症细胞浸润,小血管周围可见血管套形成,动物炎症
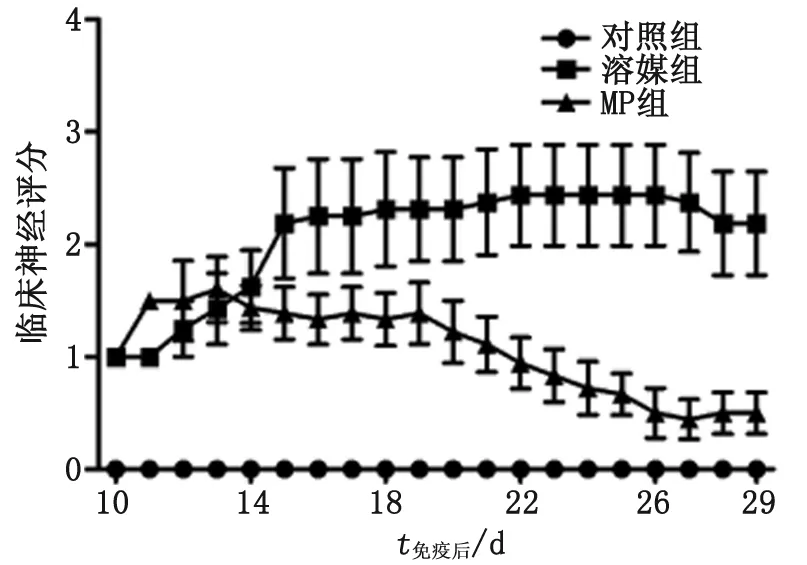
图1 小鼠临床神经功能评分Fig 1 Clinical score of mice
评分为(3.24±0.45)分;LFB染色见脊髓白质区有大小不等片状髓鞘脱失,髓鞘纤维松散,空泡形成;髓鞘脱失评分为(3.45±0.30)分;透视电镜可见小鼠髓鞘呈板状剥脱、崩解断裂、空泡形成,轴索肿胀结构疏松。MP组小鼠脊髓炎症细胞较溶媒组明显减少,炎症细胞浸润评分为(1.58±0.43)分;LFB染色显示髓鞘排列较清晰,髓鞘脱失评分为(1.26±0.50)分,髓鞘破坏情况较溶媒组明显减轻,2组比较差别有统计学意义(n=3,P<0.05,图2)。
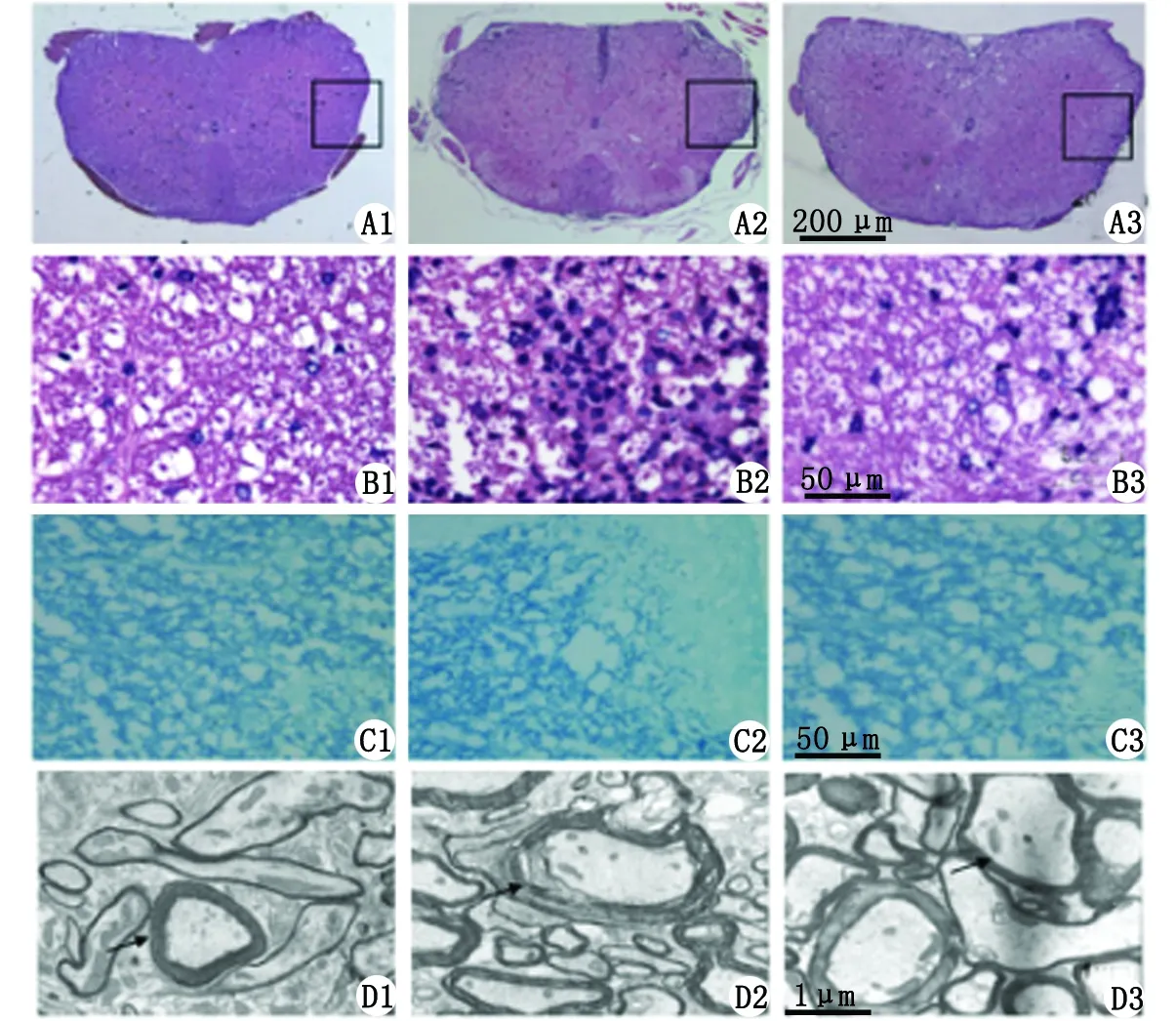
A1~A3,B1~B3为H-E染色; C1~C3为LFB染色; D1~D3为EM染色. A1,B1,C1,D1:对照组,H-E染色未见炎症细胞,LFB染色见髓鞘结构清晰,电镜下见髓鞘结构清晰,细胞器致密完整;A2,B2,C2,D2:溶媒组,H-E染色见大量炎症细胞浸润,LFB染色见脊髓白质片状髓鞘脱失,电镜下见髓鞘结构紊乱板层脱失;A3,B3,C3,D3:甲基强的松龙组,H-E染色见脊髓炎症细胞较溶媒组明显减少,LFB染色见脊髓白质部分髓鞘结构破坏,电镜下见部分髓鞘结构破坏.图2 EAE鼠脊髓组织病理学改变Fig 2 Histology of spinal cord tissues in EAE-inflicted mice
2.3MP影响EAE模型鼠脊髓细胞因子mRNA表达 实时荧光PCR方法检则结果发现,MP组小鼠脊髓促炎性细胞因子IFN-γ,IL-17,IL-21及IL-23明显下降,分别为溶媒组的33.32%,8.08%,36.03%及48.61%,而抑炎性细胞因子IL-5,IL-4及IL-10明显升高,分别为溶媒组的2.39,5.98及1.77倍,差别具有统计学意义(n=3,P<0.05,图3A)。
2.4MP抑制Th1/Th17特异性谱系转录因子mRNA水平及蛋白表达 与溶媒组比较,MP组Th1细胞特异性谱系转录因子T-bet和Th17细胞特异性转录因子孤核受体RoRγt的mRNA表达,分别下降了68%和52.5%(n=3,P<0.05,图3B),蛋白水平分别下降了71%和73%(n=3,P<0.05,图4)。
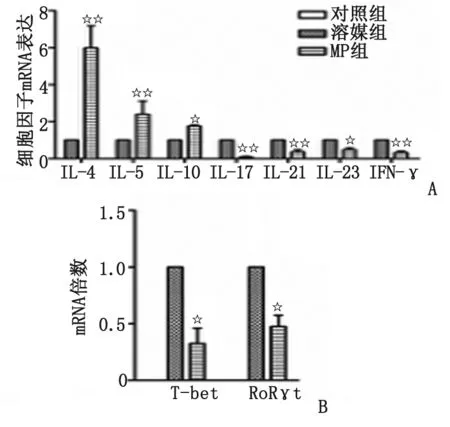
n=3. MP:甲基强的松龙; EAE:实验性自身免疫性脑脊髓炎. A:细胞因子mRNA相对表达量; B:转录因子T-bet和RoRγt mRNA表达量. 与溶媒组比较,☆:P<0.05,☆☆:P<0.01.图3 甲基强的松龙对EAE鼠脊髓细胞因子和转录因子mRNA表达的影响Fig 3 The expression of cytokines and transcription factors mRNA in spinal cords after MP treatment
2.5MP下调EAE模型鼠脊髓ERK1/2及NF-κB蛋白磷酸化水平 溶媒组小鼠较对照组小鼠脊髓pERK1/2和pNF-κB蛋白表达增高,分别为对照组的2.27及2.29倍(n=4,P<0.05,图5)。MP处理后,小鼠脊髓中pERK1/2及pNF-κB明显下降,分别下降了67.5%及61.1%(n=4,P<0.05)。
3 讨 论
MS是一种中枢神经系统炎症性脱髓鞘疾病,其发病机制复杂多样。目前针对MS的治疗主要以减轻患者恶化期的症状、缩短病程、改善残疾程度及防止并发症为主要目标。短期大剂量糖皮质激素治疗可促进MS患者急性发病期的神经功能恢复,但其作用机制仍未完全阐明[8-9]。
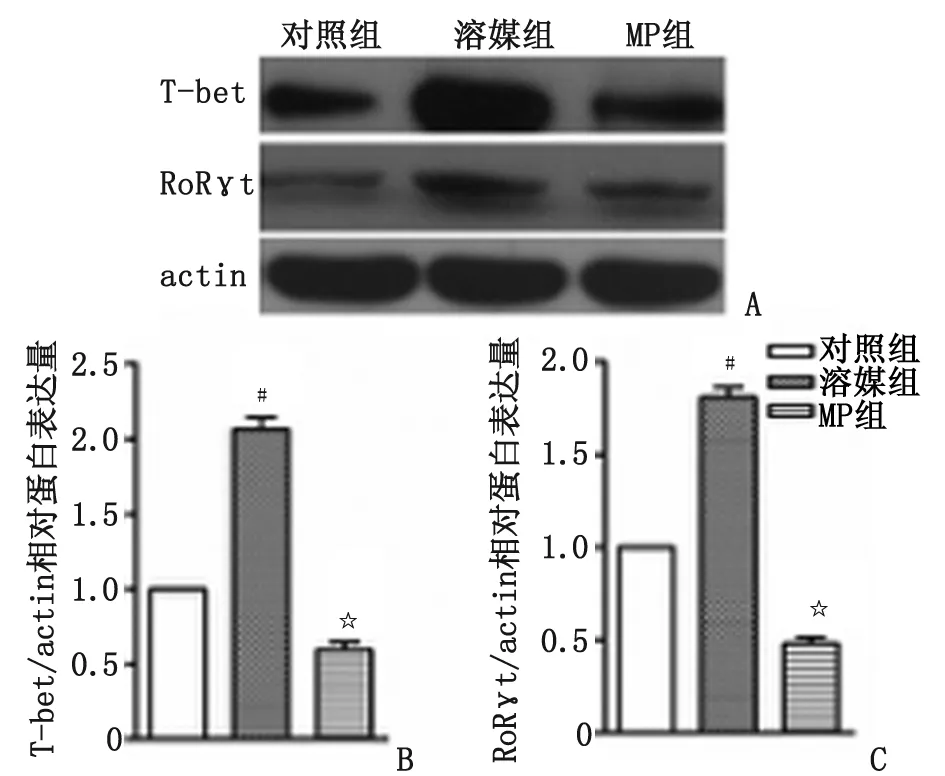
n=3. MP:甲基强的松龙; EAE:实验性自身免疫性脑脊髓炎. A:转录因子蛋白印迹图; B:T-bet相对蛋白表达量; C:RoRγt相对蛋白表达量. 与对照组比较,#:P<0.05;与溶媒组比较,☆:P<0.05.图4 甲基强的松龙对EAE鼠脊髓转录因子蛋白表达的影响Fig 4 The expression of cytokines and transcription factors in spinal cords after MP treatment
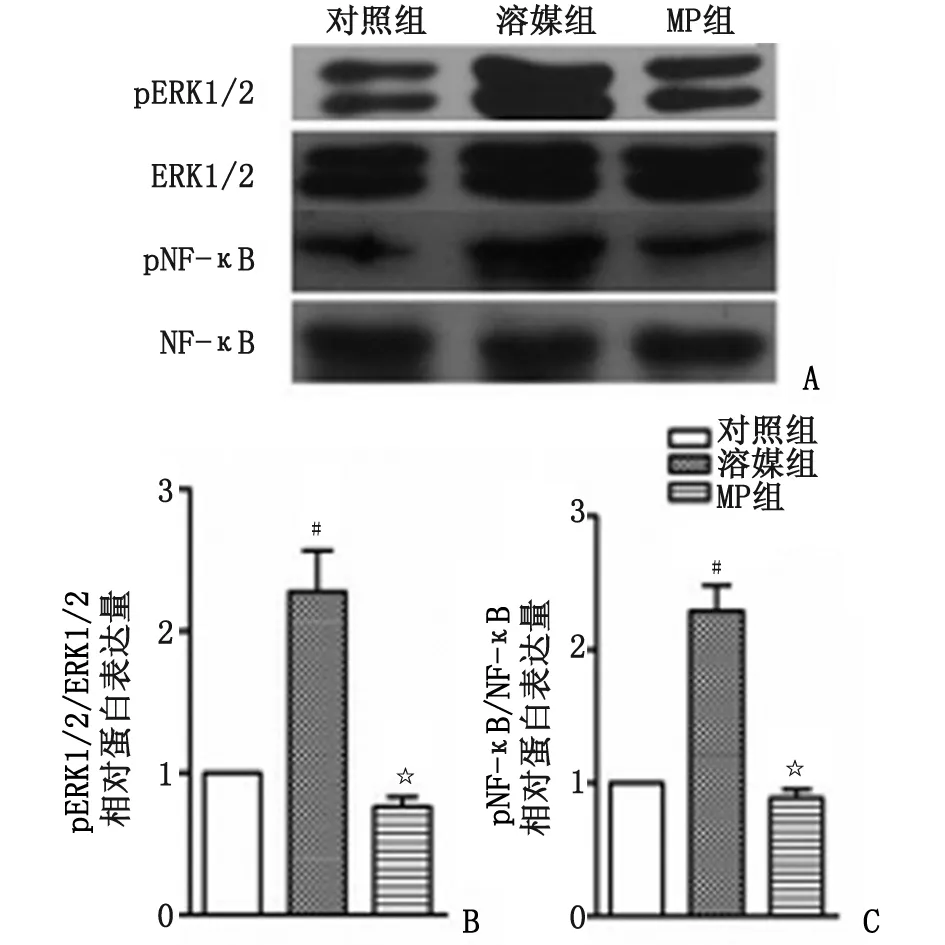
n=3. MP:甲基强的松龙; EAE:实验性自身免疫性脑脊髓炎. A:pERK1/2及pNF-κB蛋白印迹图; B:pERK1/2相对蛋白表达量; C:pNF-κB相对蛋白表达量. 与对照组比较,#:P<0.05; 与溶媒组比较,☆:P<0.05.图5 甲基强的松龙抑制EAE鼠pERK1/2和pNF-κB蛋白表达Fig 5 MP inhibited the pERK1/2-NF-κB signaling pathway
本研究通过建立MS动物模型——EAE鼠模型,待EAE出现临床症状时,给予人工合成的中效糖皮质激素(MP)治疗,模拟临床急性发病MS患者用药,在体研究MP的可能作用靶点,以期进一步指导临床治疗。研究发现,MP可改善EAE鼠的临床神经功能评分,减轻脊髓炎性细胞浸润及髓鞘脱失,7 d后撤除MP,小鼠临床症状未出现复发,提示MP具有减轻炎症反应及髓鞘损伤的作用。
MS最重要的发病机制是免疫失衡[10-11]。目前普遍认为,Th1通过分泌IFN-γ等细胞因子参与MS和EAE的致病过程,而Th2细胞分泌的IL-10及IL-4具有抗炎作用,对MS和EAE的病理发展有保护作用。近年发现一种高度致炎性细胞因子IL-17,主要由Th17细胞分泌,Th17细胞与Th1细胞共同参与EAE发生发展[12-13]。IFN-γ及IL-17协助致炎性T细胞通过血脑屏障进入中枢神经,导致自身免疫反应,募集更多效应细胞,扩大炎症反应,促进淋巴毒素或肿瘤坏死因子等炎质介质释放,引起髓鞘广泛脱失[14-15]。本实验显示,EAE小鼠脊髓的IFN-γ及IL-17明显高于对照组,证实Th1/Th17与EAE病情的严重程度密切相关。小鼠发病后给予MP治疗,脊髓致炎性细胞因子IFN-γ,IL-17,IL-21及IL-23 mRNA表达水平明显降低,抑炎性细胞因子IL-4,IL-5及IL-10 mRNA表达水平升高。同时Th1/Th17细胞特异性谱系转录因子T-bet/RoRγt mRNA及蛋白表达降低。提示MP可能影响EAE小鼠脊髓中T淋巴细胞分化,下调致炎性细胞因子释放,上调抑炎性细胞因子,起免疫调节作用。
本研究中,MOG35-55诱导EAE发病后,小鼠脊髓中pNF-κB及pERK1/2表达显著增高,与小鼠神经功能障碍、脊髓病理损伤密切相关。MP治疗后,pNF-κB及pERK1/2表达明显下降,且与小鼠神经功能及脊髓病理损伤改善一致。因此,推测pERK1/2由胞质转位到核内,进而介导NF-κB等转录因子活化,促进T淋巴细胞活化增殖,参与细胞内多种反应,可能与T细胞相关免疫性疾病的治疗有关。MP对ERK1/2-NF-κB的抑制作用可能是其抗炎的主要机制之一。
综上所述,MP可能通过抑制ERK1/2-NF-κB信号通路,下调Th1/Th17产生的致炎细胞因子,上调Th2产生的抑炎细胞因子,从而改善EAE神经功能评分,减轻脊髓炎性细胞浸润及髓鞘脱失。

