不同浓度硫酸锌对压疮模型大鼠的预防效果观察
洪 鹏, 周玉梅, 罗园园, 由淑萍, 樊慧婷, 阿依努尔·外力
(新疆医科大学护理学院1本科护理2015-2班, 2本科护理2016-4班, 3基础护理教研室, 4直升本2016-1班, 乌鲁木齐 830011)
压疮被认为是当今突出且具有负面影响的健康问题之一,其发生不仅会增加患者的痛苦,甚至会成为死亡的高风险因素之一[1],因此,压疮的防治预防更大于治疗,维持皮肤的完整性及防御功能已成为临床护理研究的热点问题。研究表明,我国临床对于压疮的预防更多凭借个人的主观经验,缺乏循证支持,无统一评价标准,也无统一效果评价[2]。伤口的愈合速度与伤口锌的浓度呈正相关[3],但硫酸锌是否可以预防压疮的发生未见有研究。本研究通过构建缺血-再灌注损伤(I/R)压疮大鼠模型[4-5],从形态学、生化指标[超氧化物歧化酶(superoxide orgotein dismutase, SOD),丙二醛(malondialdehyde, MDA)]、组织病理学方面观察硫酸锌对压疮大鼠形成的预防效果。
1 材料与方法
1.1实验动物健康雄性SD大鼠共60只,SPF级,体质量180~220 g,由新疆医科大学动物实验中心提供。常规安静环境中分笼饲养,每笼10只。光线12 h明暗循环,室温(22.0±1.0)℃,湿度60%。自由饮水、常规饲养(喂养经消毒处理的清洁普通颗粒型饲料)。
1.2试剂及主要仪器硫酸锌晶体(7733-02-0,西安泰华医药有限公司),黄芪注射液(A03171009,黑龙江珍宝岛药业),水合氯醛(H37022673,青岛宇龙海藻有限公司),超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(001-3,南京建成生物工程研究所),丙二醛(malondialdehyde,MDA)测定试剂盒(A003-1,南京建成生物工程研究所),L-530多管架自动平衡离心机(湖南长沙湘仪离心机仪器有限公司),数显恒温水浴锅(金坛市医疗仪器厂),722N可见分光光度计(菁华科技仪器上海有限责任公司)。
1.3实验方法
1.3.1 药物配置与剂量选择 0.1%硫酸锌灭菌注射液:硫酸锌晶体0.2 g+200 mL生理盐水混匀、配置成浓度为1 mg/mL的溶液,灭菌后备用;按照WHO制定的营养素每日供给量标准,成人每日锌摄入量15 mg,结合人和动物给药剂量换算,即:大鼠的剂量=人的剂量×6.13= 15 mg/60 kg×6.13≈1.6 mg,故选择10、5、2.5 mL/kg(硫酸锌含量2、1、0.5 mg)作为硫酸锌高、中、低剂量组。
1.3.2 实验分组、给药 将60只大鼠随机分成6组:空白组、模型组、黄芪组、硫酸锌高剂量组、硫酸锌中剂量组、硫酸锌低剂量组,每组10只,压疮模型制造前1 w,除空白组不给予任何注射外,模型组在大鼠大腿股薄肌朝向腹腔处腹腔注射生理盐水,硫酸锌实验组在大鼠大腿股薄肌朝向腹腔处腹腔注射不同剂量(10、5、2.5 mL/kg)的硫酸锌,黄芪组按10 mL/kg的剂量腹腔注射黄芪注射液[6],1次/d。1 w后所有大鼠行10%水合氯醛腹腔注射麻醉,对照组不予以压力,其余各组均给予3个周期的I/R(I=缺血2.0 h,R=再灌注0.5 h,施加 34.96 kpa压强)。加压装置见图1a,麻醉后的大鼠仰卧位固定于底盘,采用倒立的圆柱形铁钉加压固定于大鼠股薄肌处,游离卡尺测得铁钉帽直径约为0.9 cm,通过公式(P=F/S =mG/πr2,m=0.9 kg)计算加压重量。模型制备后,观察组织持续受压后的损伤变化。建模后4 h时处死所有大鼠。
1.3.3 标本收集 造模结束后4 h处死所有大鼠,心脏取血,以4℃ 3 600 r/min离心10 min,分离血清,用于检测血清MDA、SOD的水平。取大鼠压疮部位组织置于4%多聚甲醛中行HE病理组织学检测。
1.3.4 指标的观察 血清SOD、MDA含量测定:心脏取血后,分离血清于-70℃冰箱冻存待测,按照大鼠SOD试剂盒、MDA试剂盒说明书步骤操作,在酶标仪波长450 nm处测定SOD、MDA吸光度。HE染色观察压疮组织病理变化:在4%多聚甲醛中固定7 d后,进入脱水、透明、浸蜡程序后,进行石蜡包埋、切片(3~4 μm厚)、60℃恒温箱烤片、脱蜡、HE染色、乙醇梯度脱水、透明、封胶、观察。压疮分为3级[7]:1级肌纤维排列紧密,横纹清晰,少量炎症细胞浸润,无水肿;2级可见较多炎症细胞浸润,肌纤维轻度水肿,横纹欠清晰;3级肌纤维亦见明显炎症细胞浸润,水肿明显,间质增宽,横纹模糊。

2 结果
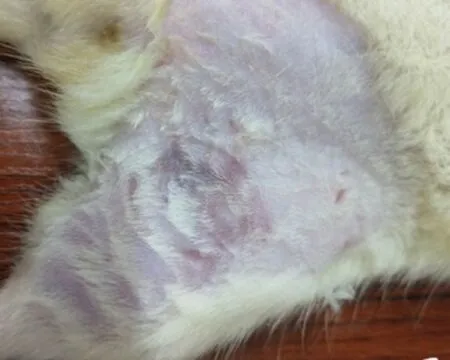
2.1大鼠压疮模型制备的形态学观察造模结束后,空白组大鼠皮肤完整,与实验前大鼠皮肤颜色无差异,模型组大鼠虽未出现明显的皮肤破损,但受压处皮肤呈现明显凹陷,且出现不可逆转的非苍白性红润,压疮局部组织可见明显红肿,肉眼观察模型组与黄芪组、硫酸锌不同剂量组造模后皮肤无明显差异,见图1b、1c。

a: 采用倒立的圆柱形铁钉加压固定于大鼠股薄肌处,制备压疮大鼠模型
b: 空白组大鼠备皮后显示,皮肤组织正常完整,颜色无异常

c: 模型组大鼠造模备皮后显示,皮肤亦完整,但受压部位组织凹陷,呈现非苍白性性红润
图1大鼠压疮模型制备
2.2不同实验组中大鼠血清SOD、MDA含量的测定与空白组比较,模型组SOD值明显下降,MDA值明显升高,差异有统计学意义(P<0.05);与模型组比较,黄芪组、硫酸锌高、中剂量组能够明显升高SOD水平(P<0.05),硫酸锌低剂量组SOD值也有上升趋势,差异无统计学意义(P>0.05);黄芪组、硫酸锌不同剂量组能够明显降低MDA水平(P<0.05),见表1。
2.3不同实验组中大鼠肌肉组织的病理变化HE染色可见,空白组大鼠肌肉组织结构清晰,结缔组织疏松,无炎性细胞,模型组大鼠压疮部位可见大量炎细胞,血管扩张充血明显,黄芪组和硫酸锌不同剂量组与模型组比较,炎细胞有所减轻,黄芪组炎性细胞渗出明显减轻,结缔组织较疏松,硫酸锌高剂量组可见散在的炎性细胞浸润,中、低剂量组炎性细胞渗出也有不同程度的减轻,见图2。

表1 不同实验组中大鼠血清SOD、MDA变化
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05。
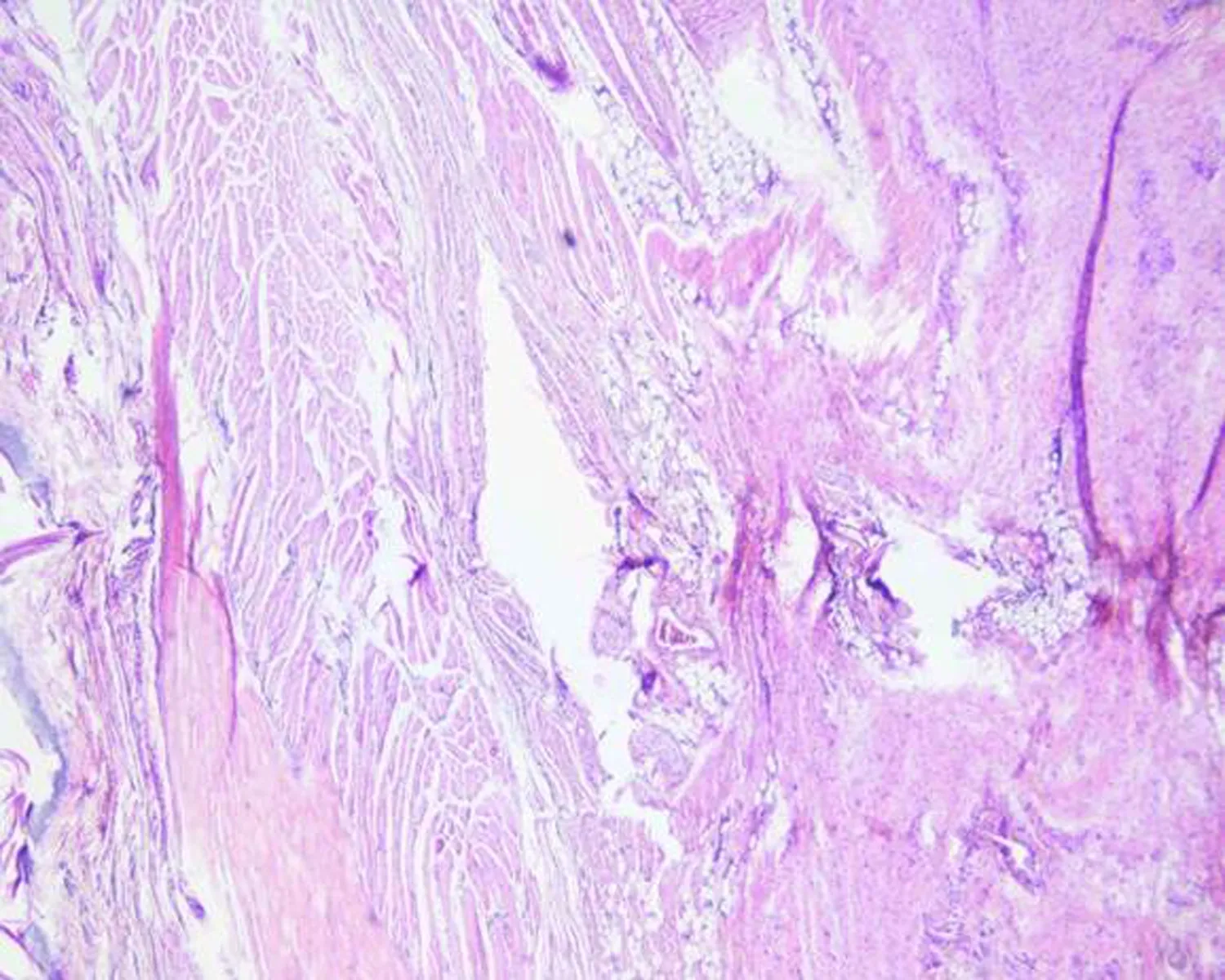
空白组

模型组

黄芪组
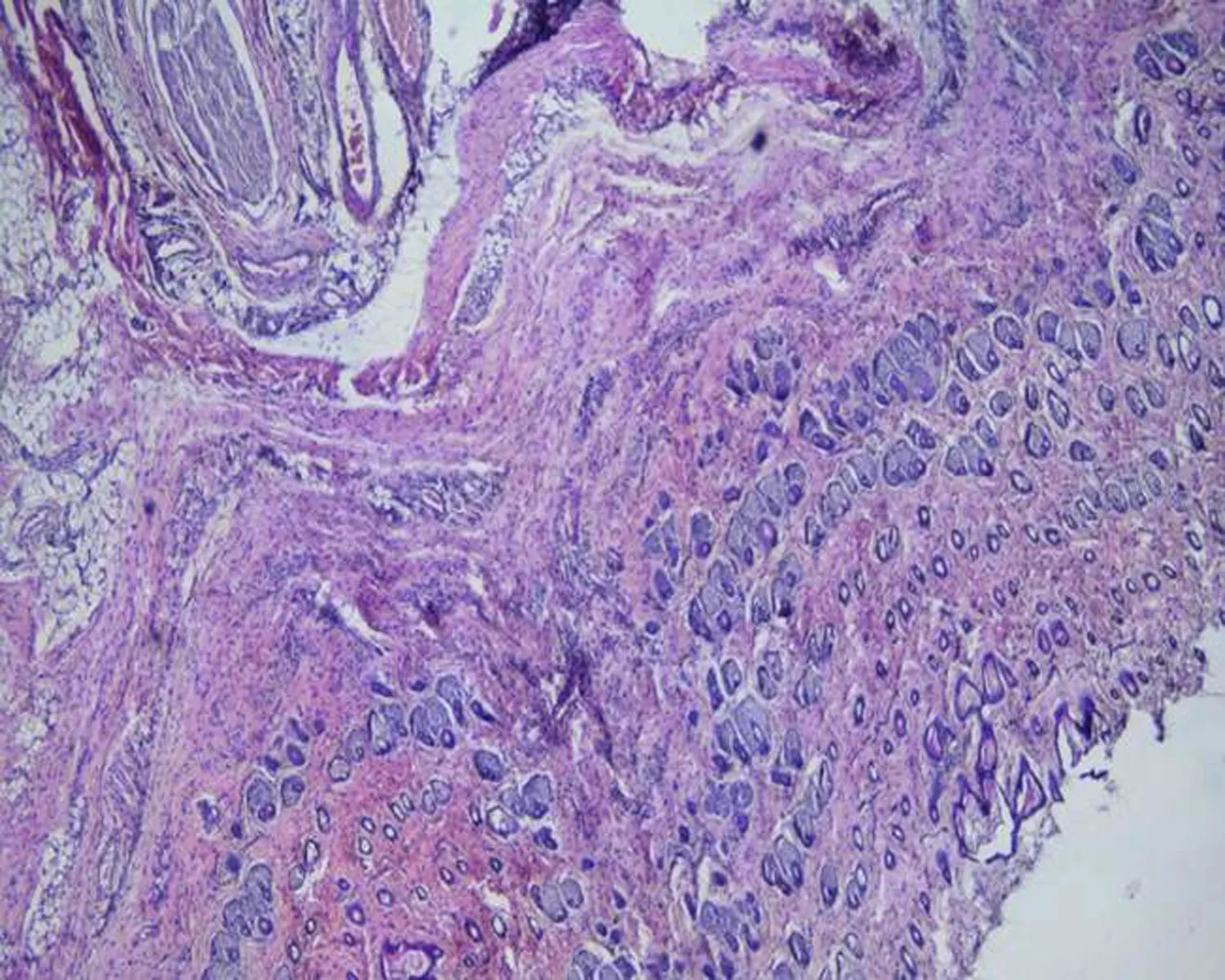
硫酸锌高剂量组

硫酸锌中剂量组
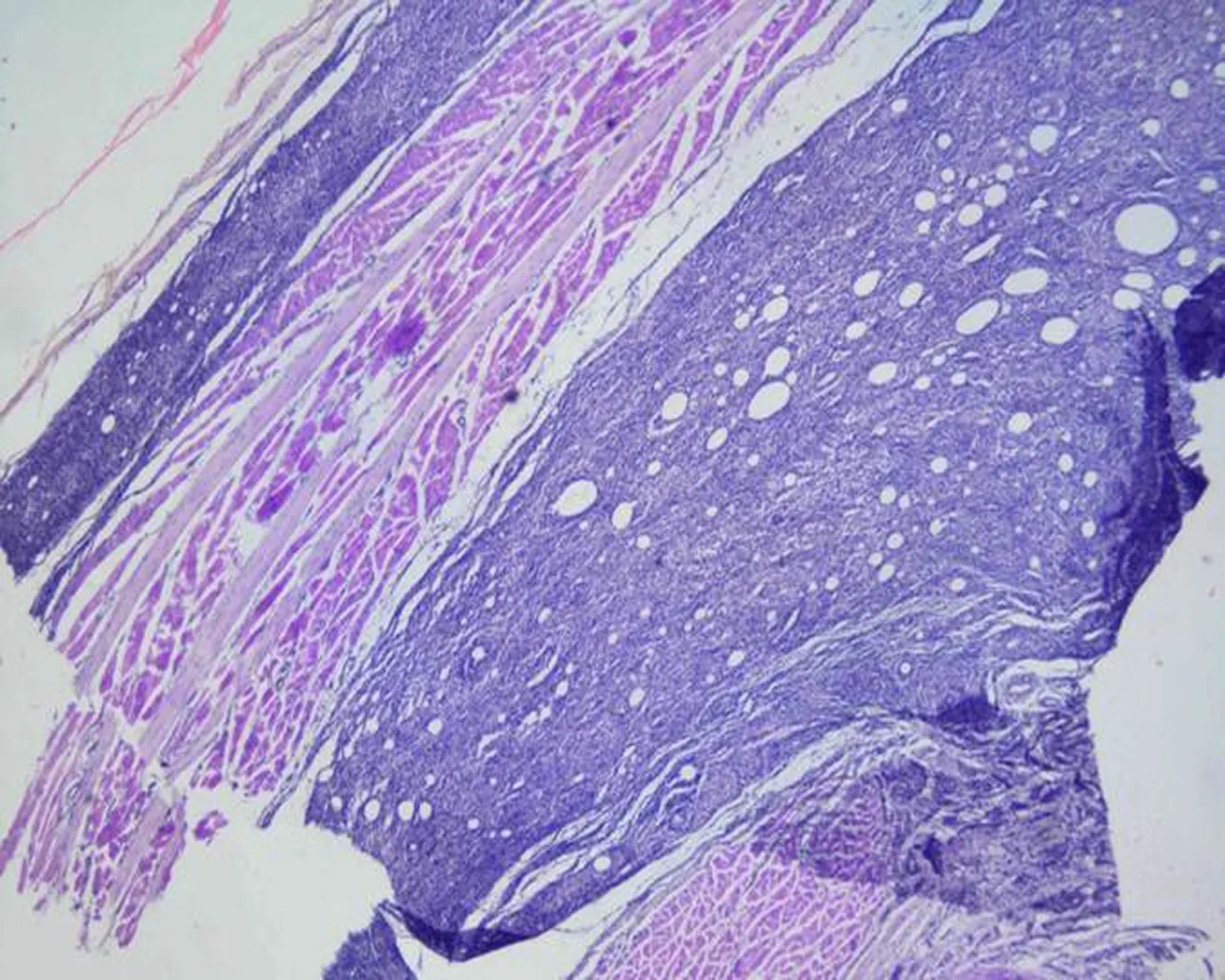
硫酸锌低剂量组
图2不同实验组中大鼠皮肤和肌肉组织的病理变化(×400)
根据病理HE染色的压疮分级标准进行评分,模型组与空白组比较,压疮程度有明显增强,差异有统计学意义(P<0.05);黄芪组与硫酸锌高、中剂量组的压疮程度低于模型组(P<0.05)。Ridit分析表明高、中剂量组的硫酸锌对大鼠压疮有积极的治疗效果,见表2。

表2 不同实验组大鼠压疮分级比较
3 讨论
压疮是局部组织长期受压、缺血缺氧等多因素、多机制共同作用的病理过程,严重者甚至会出现败血症而危及生命,导致大量医疗资源的消耗,患者经济负担的增加。越来越多的研究者开始寻求取材方便、毒副作用小的药物来预防压疮的发生,但药物的用法、浓度、剂量、权威性等等问题都缺乏权威性[8],因此利用动物模型对压疮的药物治疗及其机制进行研究成为临床研究的热点之一[9]。
3.1压疮缺血再灌注模型的建立本实验通过简易装置制造出不完全性缺血、再灌注压疮模型,历时7.5 h。实验过程中,通过肉眼对受压部位进行了形态学观察,发现不同时间段出现的压疮程度有明显差异:第1周期结束后,可见受压部位皮肤发红,与周围皮肤界限清楚,压之不褪色,第2周期结束后,可见受压部位部分表皮游离于皮下组织受损,皮肤基底红,偶见小量血泡;第3周期结束后,可见受压部位血泡形成,受压处可见明显凹陷,但皮肤尚完整。由此可见,本实验成功复制了大鼠缺血再灌注压疮模型,同时此种间歇性反复作用的低压力与临床患者压疮形成的背景趋于一致。
3.2硫酸锌能够有效的提高压疮大鼠的SOD活性,降低MDA含量压疮形成的最主要机制是缺血缺氧而致的氧化损伤,组织受压缺血会导致组织中含氧量减少,当再灌注时组织复氧的同时也会产生大量的电子受体,使氧自由基爆发性增加,此时,氧自由基可使血管内皮细胞、平滑肌细胞扩张、肿胀,细胞膜的完整性、流动性及通透性破坏[9],本研究观察到压疮模型组大鼠SOD活性明显下降,SOD广泛存在于生物体内,是机体重要的天然抗氧化酶,与细胞氧化代谢密切相关,被认为是内源性氧自由基清除剂;MDA是氧自由基作用于机体生物膜多聚不饱和脂肪酸时发生脂质过氧化反应的产物,它的产量与氧自由基的量相平衡,一定程度上反映了细胞抗氧化损伤的能力。
本研究结果显示,随着硫酸锌剂量的增加,SOD的活性增加,MDA的含量减少。提示硫酸锌作用于机体组织后,可以提升机体组织中SOD的活力,降低MDA含量,抑制压疮发生的恶性循环,对预防压疮具有一定的效果,其高剂量组的作用效果与黄芪组相当。
3.3硫酸锌对压疮具有预防作用,且硫酸锌高剂量组对压疮的预防效果最佳除氧化损伤之外,炎性细胞的浸润及炎性渗出在压疮的病理过程中发挥重要作用。本研究HE病理染色显示,模型组的压疮部位可见大量炎性细胞及渗出,而黄芪组和硫酸锌组的炎细胞均有不同程度的减少,其效果以硫酸锌高剂量组为最佳。众所周知,锌存在于众多的酶系中,如碳酸酐酶、呼吸酶、乳酸脱氢酸、超氧化物歧化酶、碱性磷酸酶、DNA和RNA聚中酶等中,是参与核酸、蛋白质、碳水化合物的合成和维生素A利用的必需物质,这些物质对于促进细胞免疫功能、增强机体免疫力具有重要作用[10]。提示硫酸锌可以提高免疫力、参与体内胶原蛋白的合成、增加大鼠自身的抵抗力,从而对压疮的发生具有预防作用。
综上所述,硫酸锌对压疮具有一定的预防作用,其具体的作用机制可以从两方面进行解释,一是硫酸锌可以缓解细胞的氧化损伤,通过增加SOD活性,降低MDA含量以清除内源性氧自由基,缓解血管内皮细胞及平滑肌细胞的扩张、肿胀,增强细胞的完整性[11];二是硫酸锌作为重要的酶和辅酶的辅助因子,参与物质代谢、细胞增殖分化和胶原纤维的合成[12],提高抵抗力以抑制炎性细胞的浸润及炎性反应的发生。

