光甘草定对大鼠对比剂急性肾损伤的保护作用及其主要机制研究*
刘巨旗 朱艺欣,2
(1.延安大学附属医院东关分院,陕西 延安 716000;2.延安大学附属医院东关心脑血管病专科医院,陕西 延安 716000)
随着临床冠脉介入及血管造影技术的迅速发展,对比剂的使用范围越来越广泛,由此造成的各种不良反应发生率亦明显增高,其中对比剂急性肾损伤是对比剂最常见的不良反应,不仅增加患者医疗负担、影响患者病情恢复,还可引发医院获得性肾功能衰竭,对患者的生命健康造成严重威胁[1-2]。研究结果表明,对比剂所致机体活性氧合成增多,引起的氧化应激损伤是造成对比剂急性肾损伤的主要因素,而目前临床针对该类型肾损伤的治疗并无权威方法,且对其新药研发亦尚属起步阶段,因此如何有效治疗对比剂所致急性肾损伤是临床迫切需要解决的重大课题[3-4]。光甘草定是一种提取自光果甘草(Glycyrrhiza glabraL.)的天然药物,具有较强的抗氧化、抗炎及抗菌活性[5]。为此,本研究旨在观察光甘草定对大鼠对比剂急性肾损伤的保护作用,并对其作用机制进行探讨,期望为该药物的临床新应用及对比剂急性肾损伤的临床治疗提供理论依据。现报告如下。
1 材料与方法
1.1 动物及分组 清洁级雌性Spague-Dawlay(SD)大鼠 50只,体质量 180~210 g,周龄 9~11周,由北京中医药大学动物实验中心提供并由该中心代饲养,饲养条件为标准饲养,饮食不限、日常光照、55%湿度、自由饮水及室温等,动物合格证编号:SCXK(京)2017-0321。
1.2 试药与仪器 光甘草定(美国Sigma公司;批号12889570),优维显碘普罗胺(美国Sigma公司;批号90982107;渗透压 774mOsm/kg H2O;碘含量 370 mg/mL)。血红素加氧酶(HO-1)、过氧化氢酶(CAT)、8-羟基脱氧鸟苷(8-OHDG)及髓过氧化物酶(MPO)荧光免疫组化染色所需抗体及试剂盒(美国Sigma公司,批号分别为 98009821、98110923、98092341 及 98109394);多聚甲醛及苏木精-伊红(HE)染色所需染色液均购自武汉古河生物科技有限公司。HN-89型光学显微镜(日本奥林匹斯公司);QU-20型全自动血液生化仪(美国贝克曼公司);R-8型切片机(德国安得宝科技公司);C-9型全自动酶标仪 (美国BIO-TEK公司);BN-09S型紫外分光光度计(上海观科分光仪有限公司);TB-718型生物组织包埋机 (武汉安达科技实业有限公司);HM325型石蜡切片机(德国米克公司)。
1.3 造模与干预 大鼠均进行7 d的适应性喂养后随机分为空白组、模型组、光甘草定高剂量组、光甘草定中剂量组及光甘草定低剂量组,每组10只。采用优维显碘普罗胺(注射剂量10 mg/kg)尾静脉注射法[6]对除空白组外其余各组小鼠进行造模,注射后1 h,对各组大鼠进行灌胃给药处理,其中光甘草定高剂量组、中剂量组及低剂量组大鼠分别给予200、100、50 mg/kg的光甘草定,空白组及模型组则均灌胃给予等量(0.2 mL)生理盐水,连续给药3 d。
1.4 标本采集及检测 1)末次灌胃24 h后,采用尾静脉取血法取各组大鼠静脉血,检测其中血肌酐(Scr)及尿素氮(BUN)等肾功能指标含量。2)取血后将各组大鼠处死,解剖并取双侧肾。利用多聚甲醛(pH=7.4)将左侧肾脏肾小管部位固定保存,经过石蜡包埋、HE染色、切片、烤片与封片处理后观察其病理组织学变化。3)将右侧肾脏肾小管部位平均分成4份,依次进行切片、脱蜡、水化、抗原修复、一抗结合、二抗结合、复染及封片处理,采用荧光免疫组化法观察其中HO-1、CAT、8-OHDG及MPO的表达情况,阳性表达为橙红色,并采用Image-proplus 6.0图像分析软件统计上述蛋白的相对表达量。
1.5 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表示,采用单因素方差分析对组间进行比较,两两比较则采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肾脏功能指标比较 见表1。与空白组比较,模型组、光甘草定高剂量组、中剂量组及低剂量组大鼠血清中Scr及BUN均明显增高(P<0.05)。与模型组比较,光甘草定高剂量组、中剂量组及低剂量组大鼠血清中Scr及BUN均明显降低(P<0.05)。与中剂量组及低剂量组比,光甘草定高剂量组Scr及BUN均明显降低(P<0.05)。与低剂量组比,光甘草定中剂量组Scr及BUN均明显降低(P<0.05)。
表1 各组大鼠肾脏功能指标比较(±s)
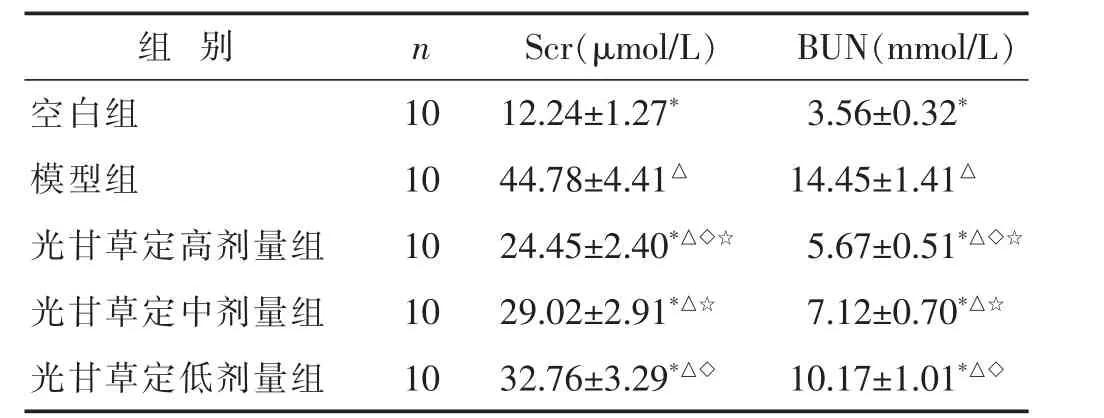
表1 各组大鼠肾脏功能指标比较(±s)
与空白组比较,△P<0.05;与模型组比较,*P<0.05;与光甘草定中剂量组比较,◇P<0.05;与光甘草定低剂量组比较,☆P<0.05。下同
组 别 n S c r(μ m o l/L) B U N(m m o l/L)空白组 1 0 1 2.2 4±1.2 7* 3.5 6±0.3 2*模型组 1 0 4 4.7 8±4.4 1△ 1 4.4 5±1.4 1△光甘草定高剂量组 1 0 2 4.4 5±2.4 0*△◇☆ 5.6 7±0.5 1*△◇☆光甘草定中剂量组 1 0 2 9.0 2±2.9 1*△☆ 7.1 2±0.7 0*△☆光甘草定低剂量组 1 0 3 2.7 6±3.2 9*△◇ 1 0.1 7±1.0 1*△◇
2.2 各组大鼠病理组织学比较 见图1。HE染色结果显示,模型组大鼠中可见大量肾小球内皮细胞肿胀、空泡及变性,肾小管结构破坏,肾间质炎性细胞浸润,肾小管上皮细胞呈刷状缘脱落;空白组大鼠中肾小球内皮细胞未出现明显损伤、肾小管结构正常;光甘草定高剂量组、中剂量组及低剂量组大鼠呈现不同程度肾小球内皮细胞变性、肾小管结构破坏及肾间质炎性细胞浸润,但程度均不及模型组。

图1 各组大鼠肾脏病理组织学比较(HE染色,200倍)
2.3 各组大鼠氧化应激指标表达情况比较 见图2~图5。 荧光免疫组化染色中,HO-1、CAT、8-OHDG及MPO阳性表达均呈橙红色弥漫状或颗粒状分布。结果表明,模型组大鼠肾组织中HO-1及CAT均呈弱表达或无明显表达,而8-OHDG及MPO则呈强阳性表达;空白组大鼠肾组织中HO-1及CAT均呈强阳性表达表达,而8-OHDG及MPO则均呈弱表达或无明显表达;光甘草定高剂量组、中剂量组及低剂量组大鼠肾组织中HO-1及CAT阳性表达情况明确强于模型组,而8-OHDG及MPO阳性表达情况明确弱于模型组。
半定量分析结果表明,与空白组比较,模型组、光甘草定高剂量组、中剂量组及低剂量组HO-1及CAT相对表达量均明显降低,而8-OHDG及MPO相对表达量均明显增高(P<0.05)。与模型组比较,光甘草定高剂量组、中剂量组及低剂量组HO-1及CAT相对表达量均明显增高,而8-OHDG及MPO相对表达量均明显降低(P<0.05)。与中剂量组及低剂量组比,光甘草定高剂量组HO-1及CAT相对表达量均明显增高,而8-OHDG及MPO相对表达量均明显降低(P<0.05)。与低剂量组比,光甘草定中剂量组HO-1及CAT相对表达量均明显增高,而8-OHDG及MPO相对表达量均明显降低(P<0.05)。见表2。

图3 各组肾组织中CAT表达情况(免疫荧光染色,400倍)

图4 各组肾组织中8-OHDG表达情况(免疫荧光染色,400倍)

图5 各组肾组织中MPO表达情况(免疫荧光染色,400倍)
3 讨 论
随着现代介入心脏病学及医学影像的迅速发展,越来越多患者在临床诊断及治疗中使用对比剂,而由此所引发的对比剂急性肾损伤已成为造成医院获得性肾功能衰竭主要原因之一[7]。流行病学研究结果显示,尽管对比剂急性肾损伤在普通人群的发生率不足2%,但在慢性肾炎、慢性肾衰竭及糖尿病等高危人群中的发生率高达50%以上,且对比剂急性肾损伤亦是增加冠状动脉介入诊疗术患者死亡率的独立危险因素之一,严重威胁广大患者的生命健康[8-9]。
表2 各组大鼠氧化应激指标荧光免疫组化相对表达量比较(±s)
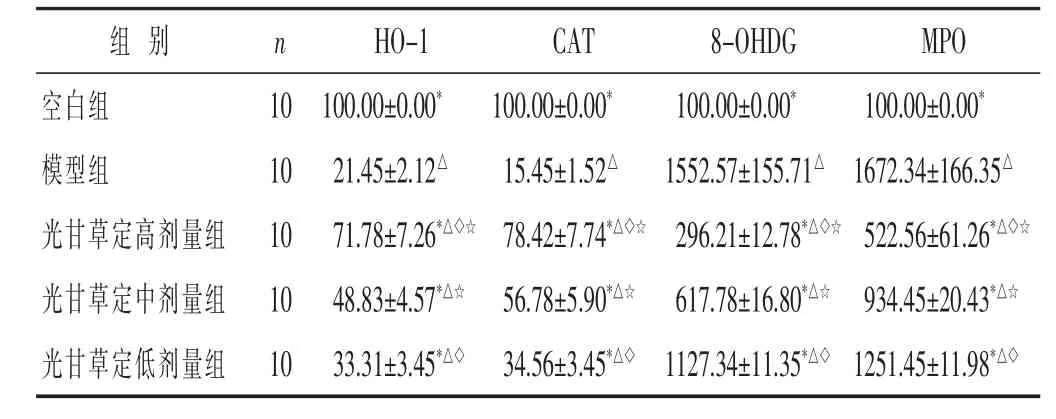
表2 各组大鼠氧化应激指标荧光免疫组化相对表达量比较(±s)
组 别 n空白组 1 0模型组 1 0光甘草定高剂量组 1 0 H O-1 C A T 8-O H D G M P O 1 0 0.0 0±0.0 0* 1 0 0.0 0±0.0 0* 1 0 0.0 0±0.0 0* 1 0 0.0 0±0.0 0*2 1.4 5±2.1 2△ 1 5.4 5±1.5 2△ 1 5 5 2.5 7±1 5 5.7 1△ 1 6 7 2.3 4±1 6 6.3 5△7 1.7 8±7.2 6*△◇☆ 7 8.4 2±7.7 4*△◇☆ 2 9 6.2 1±1 2.7 8*△◇☆ 5 2 2.5 6±6 1.2 6*△◇☆光甘草定中剂量组 1 0 4 8.8 3±4.5 7*△☆ 5 6.7 8±5.9 0*△☆ 6 1 7.7 8±1 6.8 0*△☆ 9 3 4.4 5±2 0.4 3*△☆光甘草定低剂量组 1 0 3 3.3 1±3.4 5*△◇ 3 4.5 6±3.4 5*△◇ 1 1 2 7.3 4±1 1.3 5*△◇ 1 2 5 1.4 5±1 1.9 8*△◇
目前,临床对于对比剂急性肾损伤的发病机制仍未研究清楚,多数学者认为其是一种由多种机制共同作用而引发的疾病,而氧化应激紊乱在其中扮演着重要角色[10]。研究结果显示,对比剂进入人体后不仅可直接产生大量氧自由基,还能够抑制肾脏中过氧化氢酶及超氧化物歧化酶等抗氧化蛋白的活性,从而引起局部氧化应激紊乱,并导致肾脏出现氧化性损伤[11]。此外,对比剂还可引起肾血管的剧烈收缩,造成肾脏缺氧缺血,加剧肾脏氧自由基的产生,最终导致肾小管细胞出现大面积坏死[12]。
临床研究也表明,应用超氧化物歧化酶、过氧化氢酶等可减轻对比剂所致肾功能的损伤,从而证明了氧自由基在 CIN 中的致病作用[13]。 Heyman SN 等[14]学者临床研究证实,对比剂进入患者体内时,机体脂质过氧化酶活性显著升高,氧自由基大量合成与释放,而运用大剂量抗氧剂时,对比剂所致的肾脏血流动力学及功能异常得到明显缓解,从而证明了氧自由基在对比剂急性肾损伤发病及进展中的重要作用。由此可见,进行合理有效的抗氧化治疗可能是改善对比剂急性肾损伤患者肾功能的重要方法。光甘草定是一种具有较强抗氧化活性的天然药物,可通过降低局部氧自由基含量治疗动脉粥样硬化、动脉闭塞性脑损伤及阿尔茨海默病等疾病[15-16]。尽管临床针对光甘草定的抗氧化研究已较为深入,但采用其治疗肾损伤的研究较少,而该药物能否具有较好的抗对比剂急性肾损伤活性亦不明确。因此,本研究通过建立对比剂肾损伤大鼠模型,对光甘草定的防治效果进行考察,并对其主要机制进行探讨,期望为该天然产物的应用及对比剂肾损伤的治疗提供一定的依据。
本研究利用注射对比剂成功构建了对比剂急性肾损伤模型,该方法稳定、成熟且可靠,且大鼠造模过程中死亡率较低。本研究中,造模后模型组Scr及BUN含量均显著增高25%以上,证实了本研究中造模方法的可靠性,而光甘草定治疗后,高剂量组、中剂量组及低剂量组Scr及BUN含量均明显低于模型组,且病理切片结果显示肾小球内皮细胞变性、肾小管结构破坏及肾间质炎性细胞浸润程度均不及模型组,提示光甘草定可有效改善对比剂急性肾损伤大鼠的肾脏功能。
研究结果显示,HO-1是机体血红素代谢反应中的主要限速酶,具有较强的抗氧化活性,可有效避免肾脏细胞免于对比剂刺激及肾血管收缩所致的氧化性损伤[17];CAT则是催化机体内过氧化氢的常见蛋白,能够改善过氧化氢所引起的肾脏损伤[18];8-OHDG是自由基及活性氧攻击机体DNA分子的鸟嘌呤碱基而生成的氧化性化合物,是目前肾脏细胞DNA氧化性损伤的重要标志物之一[19];MPO能够催化肾脏产生硝基酪氨酸、3-氯化酪氨酸及酪氨酰基等氧化剂,引起肾脏局部抗氧化防御机制紊乱,造成氧化应激损伤[20]。本研究荧光免疫组化染色结果显示,高剂量组、中剂量组及低剂量组大鼠肾组织中HO-1及CAT阳性表达情况明显强于模型组,且相对表达量均明显高于模型组,而8-OHDG及MPO阳性表达情况明显弱于模型组,且相对表达量均明显低于模型组,提示光甘草定能够有效改善对比剂所引起的局部氧化性损伤,而该化合物的抗氧化作用可能是光甘草定有效改善对比剂急性肾损伤大鼠肾脏功能的主要机制之一。
综上所述,光甘草定可有效地保护对比剂急性肾损伤大鼠肾脏功能,主要机制可能与其抗氧化作用有关,值得展开深入研究。然而本研究对于药物的具体作用机制研究尚属起步阶段,后期还需对该问题进行深入阐述。此外,由于目前临床对于对比剂急性肾损伤并无特效药物,故阳性药的选择无权威性,且临床常用的糖皮质激素类药物作用机制可能与本研究所探讨的机制存在较大的差别,故本研究并未设置阳性药对照组,可能对本研究的价值产生一定的影响。

