补肾化瘀方对肝纤维化大鼠肝组织TGFβ1/Smad3表达的影响*
叶 蕾 余亚平 陈芝芸 严茂祥 何蓓晖 蔡丹莉
浙江中医药大学附属第一医院 浙江 杭州 310006
肝纤维化是肝脏慢性炎症反复的结果,其特点是细胞外基质(ECM)合成与降解失衡导致其在肝脏内过度沉积[1]。在细胞和分子水平,这一过程主要表现为肝星状细胞(hepatic stellate cells,HSC)活化和转化生长因子-β(Transforming growth factor-beta,TGF-β)及其下游信号分子异常激活;Smads蛋白为TGF-β信号最重要胞内效应因子,介导其核内外的信号转导,并调节TGF-β家族的正、负反馈[2]。补肾化瘀方是笔者临床治疗肝纤维化的经验方,以往研究[3]表明,该方能抗肝纤维化、改善肝组织炎症和肝功能的作用,本研究探讨补肾化瘀方对CCl4诱导肝纤维化大鼠肝组织TGF-β1及其Ⅰ受体、Smad3表达的影响。
1 材料与方法
1.1 实验动物:SD大鼠30只,雄性,SPF级,体重140±10g,购于上海斯莱克实验动物有限公司[许可证号:SCXK(沪)2013-0016]。
1.2 补肾化瘀方制备:由仙灵脾、党参、积雪草各15g,黄精20g,女贞子、郁金各12g,虎杖24g,丹参30g等组成,浙江省中医院制剂中心制成4.4g/ml的流浸膏。
1.3 主要试剂及仪器:CCl4由上海凌峰化学试剂有限公司提供;TaKaRaMiniBEST Universal RNA Extraction Kit、PrimeScript™ RT Master Mix(Perfect Real Time)及SYBR® Premix Ex Taq™ II(TliRNaseH Plus)由宝生物工程(大连)有限公司提供。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、TGF-β1兔单抗为美国Abcam公司产品,Smad3鼠单抗为美国Santa Cruz公司产,超敏酶标山羊抗小鼠/兔IgG聚合物由北京中杉金桥生物技术有限公司提供。AB17900PCR扩增仪为美国ABI公司产品,Nikon eclipse 80i光学显微镜为日本Nikon公司产品。
1.4 实验方法:30只大鼠适应性喂养1周后随机分为正常组、模型组、补肾化瘀方组共3组,每组10只。模型组和补肾化瘀方组以橄榄油稀释的40%CCl4皮下注射,0.3ml/100g,首剂加倍,2次/周,共6周;正常组以等容量橄榄油皮下注射代替;同时补肾化瘀方组每天灌服4.4g/ml的补肾化瘀流浸膏1ml/100g,正常组和模型组则每天以等容量的生理盐水灌胃,均连续6周。于末给药次当晚禁食不禁水16h,次日空腹麻醉下处死,收集肝脏标本,部分存于-80℃用于荧光定量PCR检测,部分肝右叶组织10%中性甲醛中固定,常规梯度酒精脱水,二甲苯透明,石蜡包埋,切片,用于免疫组化检测。肝组织α-SMA、TGF-β1及其Ⅰ型受体[TGF-β receptorⅠ(TβRI)]、Smad3等基因mRNA表达采用实时荧光定量PCR检测,以β-actin为内参,相对表达量(2-△△Ct)表示目标基因表达量,引物由生工生物工程(上海)有限公司设计并合成。引物基因序列见表1。

表1 引物基因序列
肝组织α-SMA、TGF-β1、Smad3蛋白表达采用免疫组化检测。结果判断:α-SMA阳性细胞表现为胞浆呈棕黄色,少部分膜表达;TGF-β1阳性细胞为胞浆呈棕黄色;Smad3阳性细胞表现为胞浆/核呈棕黄色;以阳性细胞着色程度和范围进行半定量[4]。
1.5 统计学方法:采用SPSS21.0软件进行数据统计分析,计量资料以±s表示。行正态性检验,非正态分布资料转换成正态分布,采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 补肾化瘀方对肝纤维化大鼠肝组织α-SMA、TGF-β1、TβRⅠ和Smad3基因mRNA表达的影响:模型组大鼠肝组织α-SMA、TGF-β1、TβRⅠ及Smad3三者mRNA表达较正常组显著上调(P<0.01),应用补肾化瘀方干预后,肝组织上述基因mRNA表达较模型组明显下调(P<0.05,P<0.01),见图1。
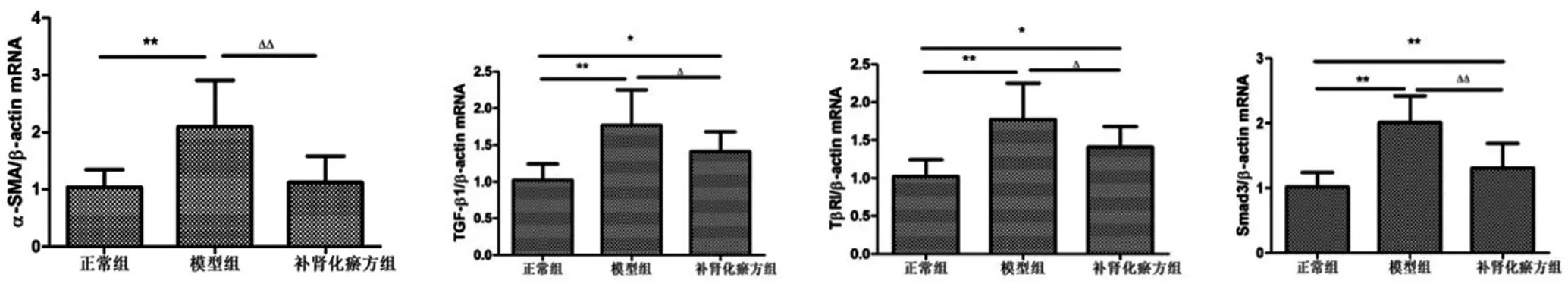
图1 肝组织α-SMA、TGF-β1、TβRⅠ及Smad3mRNA的表达(±s,n=10)
2.2 补肾化瘀方对肝纤维化大鼠肝组织α-SMA、TGF-β1、TβRⅠ、Smad3蛋白表达的影响:模型组大鼠肝组织α-SMA、TGF-β1、Smad3蛋白表达水平较正常组明显增强(P<0.01),补肾化瘀方组组大鼠肝组织α-SMA、TGF-β、Smad3的表达较模型组不同程度下降(P<0.05,P<0.01),见表2。
表2 补肾化瘀方对肝组织α-SMA、TGFβ1、Smad3蛋白表达的影响(±s,n=10)
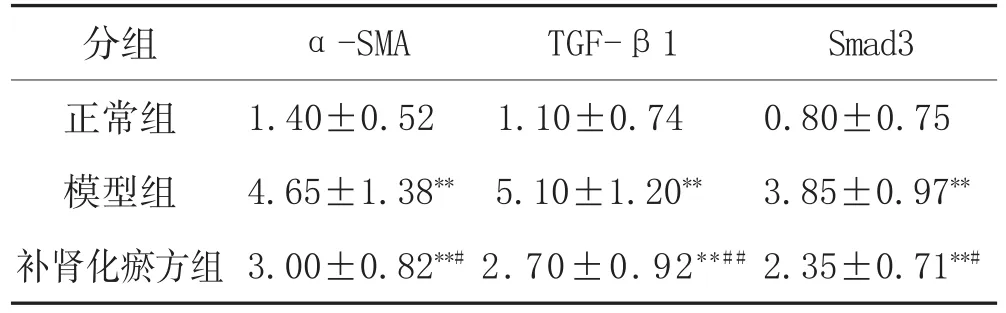
表2 补肾化瘀方对肝组织α-SMA、TGFβ1、Smad3蛋白表达的影响(±s,n=10)
Smad3 0.80±0.75 3.85±0.97**2.35±0.71**#分组正常组模型组补肾化瘀方组α-SMA 1.40±0.52 4.65±1.38**3.00±0.82**#TGF-β1 1.10±0.74 5.10±1.20**2.70±0.92**##
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3 讨论
ECM主要来源于HSC,HSC激活并转化为肌成纤维细胞是肝纤维化形成的核心。TGF-β1作为最重要的促HSC活化的细胞因子,由肝巨噬细胞、肝窦内皮细胞等合成分泌,激活HSC,同时能促进HSC自分泌、旁分泌TGF-β1,产生自我增殖的循环过程,活化临近HSC大量合成胶原[5]。细胞外TGF-β1与细胞表面TβR相互结合,能够激活其下游的信号转导分子smad2/3/4蛋白,形成复合物,最终转移入细胞核,直接或参与调节因子形成转录复合子,以诱导目的基因的转录表达[6];因此有研究认为,抑制TGF-β1的表达和TGF-β/smad信号通路的激活,是阻断肝纤维化的关键[7]。
补肾化瘀方由仙灵脾、黄精、女贞子、党参、虎杖、郁金、丹参、积雪草等组成,具有补肾益气,化瘀解毒等功效[3]。本研究发现,肝纤维化模型大鼠HSC活化标志物α-SMA mRNA和蛋白表达均较正常组明显上调,TGF-β、TβRⅠ、Smad3的表达也较正常组显著增强;而补肾化瘀方干预后能抑制上述关键分子mRNA和蛋白的过表达,提示模型大鼠肝组织HSC活化,TGF-β1/Smad3信号通路激活,补肾化瘀方能降低肝组织中TGF-β1、TβRⅠ及其信号转导分子Smad3的mRNA及蛋白表达水平,从而抑制HSC活化增殖、抑制TGF-β1通过信号转导分子Smad3促肝纤维化的作用。

