血清RANKL、tP1NP、N-MID、B-CTX及25-羟维生素D在骨质疏松患者中的变化及诊断价值
李自军
(郑州市骨科医院检验科,河南 郑州 450052)
我国骨质疏松症的发病率位于骨科常见病首位,并且还在不断攀升[1]。该病后期检测和治疗费用较高,因而寻找影响骨质疏松发病的关键因子,加深对骨质疏松发病机制的理解,探寻早期的干预方式和靶点,对骨质疏松的治疗至为关键。
骨代谢标志物是对骨质疏松早期诊断的重要指标,但因骨质疏松患者常伴有生理上的改变,可能引发漏诊。研究发现绝经后雌激素缺失及炎性反应时,肿瘤坏死因子及炎性因子前体白细胞介素1可通过增加间质细胞和成骨细胞核因子κB受体活化因子配体(RANKL)的表达调控骨吸收,并引起单核细胞向骨细胞分化[2]。RANKL的表达变化也越来越受到学者们的重视。本文深入探讨了骨质疏松患者血清RANKL及多种骨代谢标志物的水平变化,旨在为骨质疏松的临床早期诊断和治疗提供新的思路。现报告如下。
1 资料与方法
1.1 一般资料 选取我院 2016年 5月-2017年4月收治并确诊的骨质疏松患者89例为病例组、正常无骨质疏松人群作为对照组。
病例组,男17例、女72例,年龄56~83岁,平均(70.1±11.0)岁,骨密度(T 值)-3.59±0.61。 对照组,男 20 例、女 70 例,年龄 53~82 岁,平均(68.8±13.1)岁,骨密度(T 值)-1.33±0.52。 两组研究对象的年龄、性别比较,具有均衡性(P>0.05)。
1.2 纳入排除标准[3]
1.2.1 纳入标准 骨质疏松的诊断标准参考人民卫生出版社《诊断学》第八版中的标准[2];骨质疏松患者的骨密度(T值)≤-2.5SD;对照组来源于体检健康的自愿者;本研究获得研究对象的同意及医学伦理委员会的批准。
1.2.2 排除标准 伴有严重的感染性疾病;甲状腺功能疾病;伴有糖尿病;长期使用糖皮质激素、免疫调节类药物;伴有骨转移肿瘤、肝肾功能疾病;伴有其他影响本研究实验指标的疾病。
1.3 指标检测方法 所有检查对象均于入院次日清晨抽取5ml空腹静脉血,离心后取血清,-80℃条件下备存。使用电化学发光法法对血清中RANKL、tP1NP、N-MID、B-CTX 及 25-羟维生素 D 浓度进行检测,试剂盒购于南京建成生物研究所。
1.4 统计学方法 统计软件采用SPSS 16.0,采用均数±标准差(±s)进行统计描述,组间比较采用t检验;绘制ROC曲线,计算最佳诊断临界值及其对应的灵敏度、特异度、漏诊率、误诊率、ROC曲线下面积AUC值;P<0.05表示差异具有统计学意义。
2 结果
2.1 两组研究对象的血清 RANKL、tP1NP、N-MID、B-CTX及25-羟维生素D比较 病例组患者的血清RANKL显著高于对照组,差异具有统计学意义(P<0.05);病例组患者的血清 25-羟维生素 D 显著的低于对照组,差异有统计学意义(P<0.05);病例组患者的血清 tP1NP、N-MID、B-CTX 与对照组比较,差异无统计学意义(P>0.05),见表 1。
2.2 血清RANKL、25-羟维生素D鉴别诊断骨质疏松患者的临床价值 血清RANKL鉴别诊断骨质疏松的最佳临界点值为0.175ng/ml,诊断灵敏度为82.14%、 特异度为85.06%、ROC曲线下面积AUC值为0.833;血清25-羟维生素D鉴别诊断骨质疏松的最佳临界点值为30.50nmol/ml,诊断灵敏度为79.92%、 特异度为83.47%、ROC曲线下面积AUC值为0.814;血清RANKL+25-羟维生素D别诊断骨质疏松的灵敏度为87.42%、特异度为94.01%、ROC曲线下面积AUC值为0.916,见表 2、图1。
3 讨论
骨质疏松是常见老年病,具有发病率高、进程缓慢等特点,随着我国进一步的老龄化,发病率具有明显的攀升趋势。随着对骨质疏松发病机制和原理的深入,研究重点更趋向于该病的早期诊断和治疗的方法的探讨,进而延缓病程发展,提高预防能力[4]。
表1 两组研究对象的血清RANKL、tP1NP、N-MID、B-CTX及25-羟维生素D比较(±s)
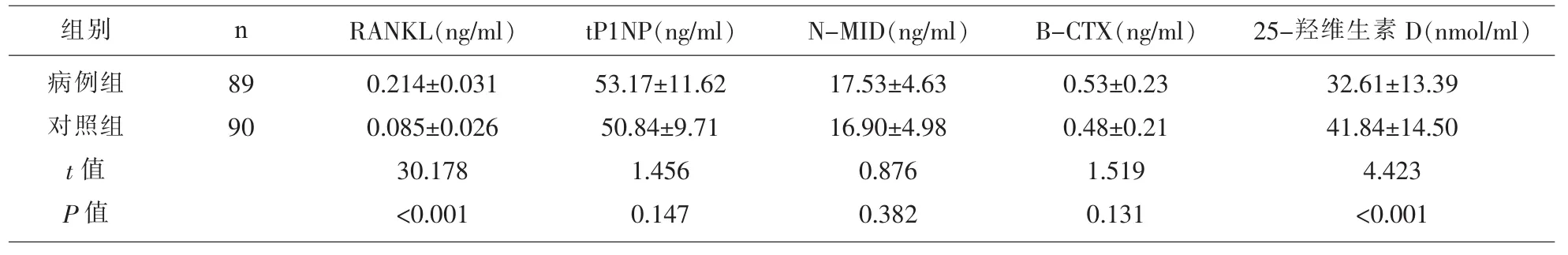
表1 两组研究对象的血清RANKL、tP1NP、N-MID、B-CTX及25-羟维生素D比较(±s)
组别 n病例组对照组t值P值89 90 RANKL(ng/ml) tP1NP(ng/ml) N-MID(ng/ml) B-CTX(ng/ml) 25-羟维生素 D(nmol/ml)0.214±0.031 0.085±0.026 30.178<0.001 53.17±11.62 50.84±9.71 1.456 0.147 17.53±4.63 16.90±4.98 0.876 0.382 0.53±0.23 0.48±0.21 1.519 0.131 32.61±13.39 41.84±14.50 4.423<0.001
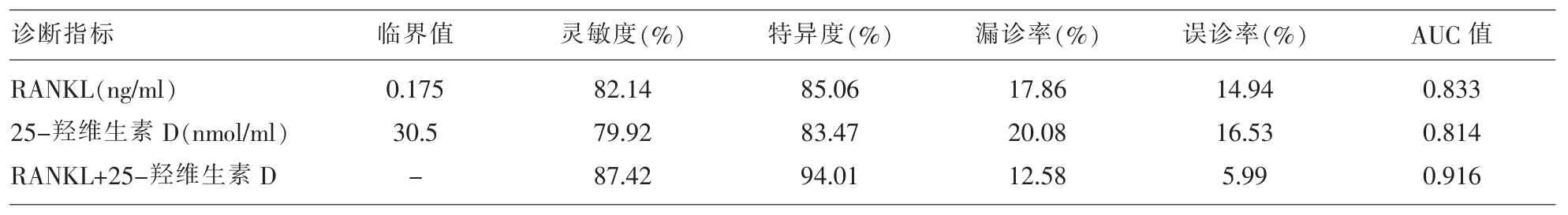
表2 血清RANKL、25-羟维生素D鉴别诊断骨质疏松患者的临床价值
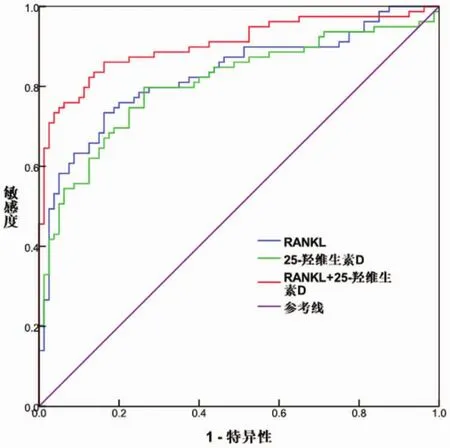
图1 血清RANKL、25-羟维生素D单独及联合应用鉴别诊断骨质疏松患者的ROC曲线
骨质疏松的诊断主要依靠骨代谢因子及其他相关因子为参考。受体活化因子RANKL及RANK归属以TNF受体超家族,两者可在破股前体细胞和破骨细胞中结合,并在破骨细胞的溶骨、分化及生存过程发挥重要作用[5,6]。RANKL及RANK结合后还可召集伴侣蛋白TNF受体相关因子6至浆膜,三者的有机结合对成骨细胞的分化和形成作用明显,严芳娜[7]的研究发现大鼠缺乏上述因子就会出现严重的破骨功能障碍。RANK除了能与RANKL结合外,还可活化NF-KB、蛋白激酶 B、T细胞核因子C1及细胞外信号调节酶等多个信号通路,并在破骨细胞的溶骨、分化及生存过程发挥作用[8,9]。本结果显示病例组患者的血清RANKL显著的高于对照组,差异具有统计学意义(P<0.05)。上述结果提示RANKL具有成为骨质疏松早期诊断的生物标志物的可能性。
骨代谢标志物可有效反映破骨细胞和成骨细胞功能、骨代谢变化速率及骨转换的速率和频率。最初骨代谢指标被认为是一类重要的可替代骨密度变化率的指标,现在更被认为是一类评估骨质量的有效指标并可用来评估未来发生骨折的风险性,还可被用来作为一种评估药物治疗效果的有效指标[10]。本研究结果显示病例组患者的血清25-羟维生素D显著低于对照组,差异有统计学意义(P<0.05)。 上述结果提示,25-羟维生素 D 具有成为骨质疏松早期诊断的代谢标志物的可能性。这可能与正常生理浓度的25-羟维生素D具有有效地防止骨质疏松,保护骨的作用有关。25-羟维生素D作为调节钙磷代谢的脂溶性维生素,在维持体内钙磷浓度稳定及钙的吸收方面具有重要作用。Nan等[11]的研究证实其还具有增强肌力、优化骨重建、促进正常骨细胞的分化等多重作用。
病例组患者的血清 tP1NP、N-MID、B-CTX 与对照组比较,差异无统计学意义(P>0.05)。 这可能因为人体的骨量峰值不同有关,达到峰值骨量后,经过一段时间进入骨量丢失期后,表现为绝对或相对的骨吸收和骨形成,而血清tP1NP、N-MID、BCTX主要反映的是骨代谢情况[12-14]。现阶段骨质疏松的诊断金标准是骨密度,一个处于骨量峰值的患者虽然处在骨高转换状态,但可因较好的骨量储备而未发生骨质疏松,同理一个处于骨量低值的患者虽然处在骨低转换状态,但可因未有较好骨量储备而出现骨质疏松,血清tP1NP、N-MID、BCTX只反映骨转换情况,而对骨质疏松的诊断效果较差[15]。
对血清RANKL、25-羟维生素D鉴别诊断骨质疏松患者的临床价值研究结果显示,血清RANKL鉴别诊断骨质疏松的最佳临界点值为0.175ng/ml,诊断灵敏度为 82.14%、特异度为 85.06%、ROC曲线下面积AUC值为0.833;血清25-羟维生素D鉴别诊断骨质疏松的最佳临界点值为30.50nmol/ml,诊断灵敏度为 79.92%、特异度为 83.47%、ROC曲线下面积AUC值为0.814;血清 RANKL+25-羟维生素D别诊断骨质疏松的灵敏度为87.42%、特异度为 94.01%、ROC曲线下面积 AUC值为0.916。上述结果提示血清 RANKL、25-羟维生素 D对骨质疏松的诊断均具有较高的特异度和灵敏度,若两种指标联合应用,特异度和灵敏度均可得到有效提高。
综述所述,骨质疏松患者血清RANKL、25-羟维生素D水平较正常人群变化较为明显,二者联合应用对于鉴别诊断骨质疏松具有一定的临床价值。

