联合检测AML1-ETO及其9a异构体在微小残留白血病监测中的意义
何飞 ,潘晓芬 ,陈永昌 ,梁昌达 ,易丽君 ,李红
(1、江西省儿童医院,江西 南昌 330000;2、江西省儿科研究所中心实验室,江西 南昌 330000;3、江西省全南县人民医院,江西全南341800)
急性 髓系 白 血 病 (acute myeloid leukemia,AML)是造血系统的髓系原始细胞克隆性恶性增殖性疾病,是一个具有高度异质性的疾病群,它由正常髓系细胞分化发育过程中不同阶段的造血祖细胞恶性变转化[1]。白血病的病因和发病机制非常复杂,尽管目前研究已经明确部分可能因素,但其病因仍未被完全阐明。多数研究表明白血病是环境因素与细胞遗传物质相互作用形成各种染色体易位或融合基因所致。t(8;21)(q22;q22)是急性髓系白血病最常见的非随机染色体易位,约40%~50%的AML1-M2(FAB分型)存在此种染色体易位[2]。染色体易位(8;21)合成的融合蛋白AML-ETO作为白血病发展的起始致癌基因,在白血病的发生发展中起了重要的作用,并且AE融合蛋白存在多个转录本[3],其中AE9a的致白血病作用最明显[4]。随着长期存活率的提高,如何提前预测复发成为白血病治疗策略改变的一个发展方向,微小残留病的监测是最常用的方法之一,研究表明[5]约87%伴有t(8;21)的AML-M2患者中AE融合基因与AE9a异构体共表达,据此,本文通过建立相对定量的方法,监测46例患者多次随访标本中AE及AE9a相对量的变化,探讨联合监测AE及AE9a在微小残留白血病(MRD)监测中可能存在的临床意义。
1 资料与方法
1.1 病例来源 46份ETO基因阳性骨髓标本采自2010年6月至2014年6月江西省儿童医院血液科住院及门诊患者,发病时一般情况:87%患儿(40例)有反复发热;12例患儿初诊时外周血白细胞数大于50×109/l;36例患儿骨髓幼稚细胞比例大于50%,10 例患儿比例为 20%~50%。诊断标准[6]:1.临床症状、体征:发热、苍白、乏力、出血、骨关节疼痛及肝脾淋巴结肿大等浸润灶表现;2.血象改变:血红蛋白及红细胞降低,血小板减少,白细胞增高、正常或减低,分类可发现数量不等的原、幼粒(或幼单)细胞或未见原、幼粒(或幼单)细胞;3.骨髓形态学改变:是确诊的主要依据,骨髓涂片中有核细胞大多呈明显增生或极度增生,仅少数呈增生低下,均以髓细胞增生为主,原粒+早幼粒(或原单+幼单)细胞必须≥20%才能确诊为AML;4.ETO融合基因阳性。化疗方案采用2006化疗方案[6],39例第一疗程获得缓解,7例第二疗程获得缓解。46例患儿随访3年未复发25例,3年内复发21例。标本检测时间为初诊时、诱导化疗结束时、随访每6个月检测1次以及复发时,随访时间为3年。
1.2 试剂与仪器 RT-PCR扩增试剂为大连宝生物工程公司产品;实时定量PCR扩增试剂为ABI公司产品;RT-PCR及实时定量PCR引物和TaqMan探针均由金瑞斯生物科技有限公司合成;RT-PCR扩增仪为美国ABI公司ABI7500;实时定量PCR扩增仪为MJ Research公司产品;电泳仪为Bio-Bad公司产品;紫外透视分析仪为Bio-CAPTver鄄sion99(VLIBERLOURMAT)。
1.3 RT-PCR 收集46例患儿各个监测点的骨髓标本,用Ficoll液分离骨髓MNC,用Trizol一步法及氯仿.异丙醇提取总 RNA,调浓度至 0.5ug/ul,取4ul并逆转成cDNA40u1
1.4 定性PCR及实时定量PCR检测AE9a和AE表达水平 扩增 (包括9a外显子)的AMLl-ETO(1530bp)长片段,将定性RT-PCR扩增AE长片段所获得的PCR产物作为模板进行实时定量PCR检测,并在此基础上设计特异性引物和TaqMan探针。PCR体系和扩增条件按说明书执行。
1.5 内参基因为 Abl,其中 Abl引物及探针、AML1-ETO和9a异构体的引物及探针序列选择欧洲公布的抗癌项目序列。每例标本的每个基因均做复孔检测,通过标本Ct值依据标准曲线计算出标准中Abl、AE及AE9a拷贝数。计算AE和AE9a表达水平(%)=拷贝数/Abl拷贝数×100%。
1.7 统计学处理 采用SPSS 13.0统计分析软件进行统计学分析,采用配对t检验及四格表χ2检验。
2 结果
2.1 AML1-ET09a异构体检测结果 在46例确诊伴有t(8;21)的AML-M2患者的骨髓标本中有 41例检测到AE9a异构体,占89.13%。21例复发患者均检测到AE9a异构体。
2.2 初诊时 AE、AE9a的表达 41例 AE及 AE9a均阳性患者,21例复发,20例未复发,两组患者AE及AE9a表达水平差异较大,但复发组平均表达水平高于未复发组,并且两组对比AE9a比AE高的更明显(P<0.01),见表 1、图 1。
2.3 初治后AE、AE9a的表达 46例患者经首次标准方案化疗后AE表达水平较初诊时明显下降,但复发组下降的百分比低于未复发组,差异有统计学意义 (P<0.05);41例AE9a阳性患者化疗后表达水平也明显下降,同样复发组下降的百分比低于未复发组,差异有统计学意义(P<0.05);比较复发组AE、AE9a化疗前后的变化发现,AE下降的水平明显高于 AE9a(P<0.01)。 见图 2。
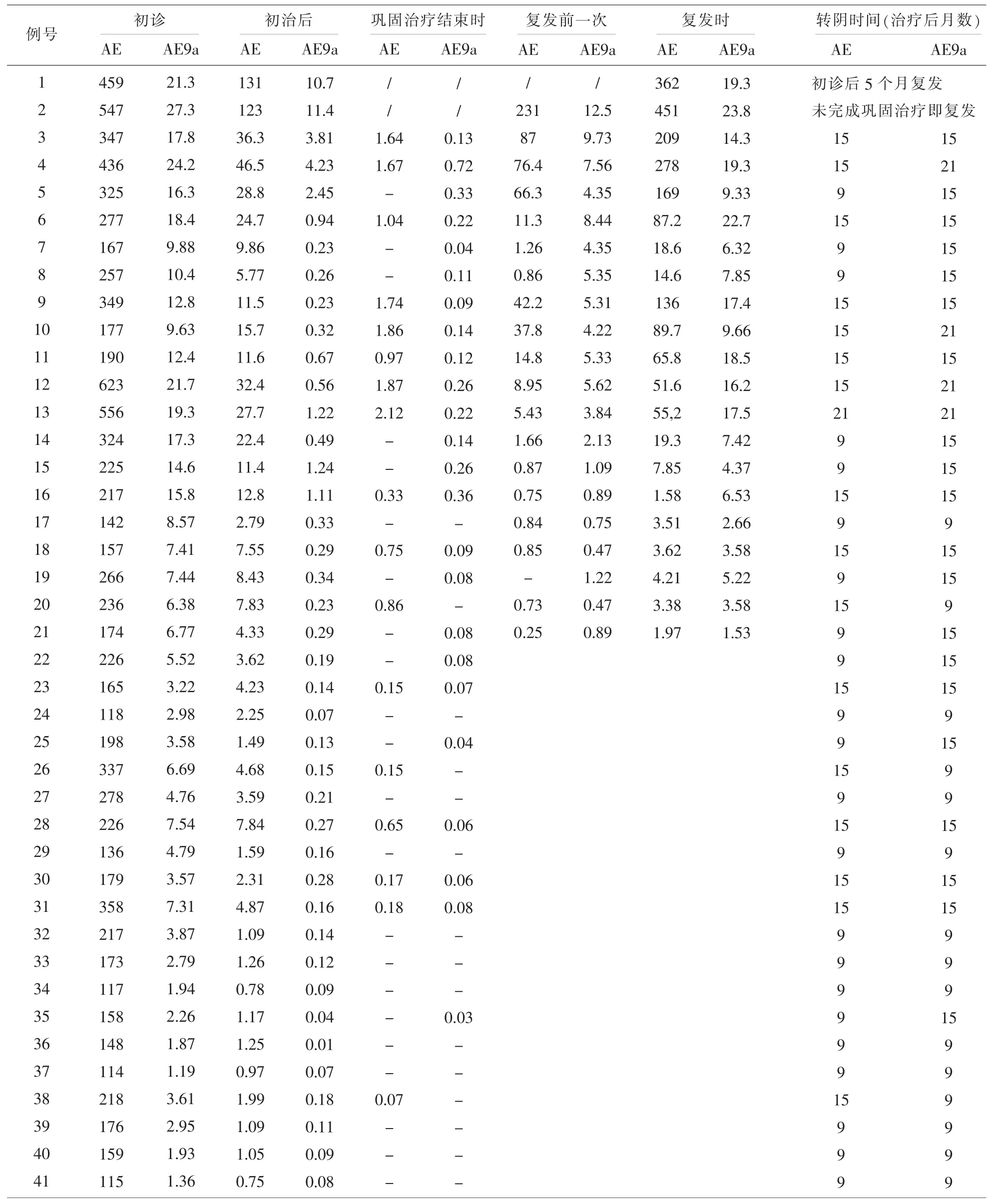
表1 41例AE、AE9a表达阳性患者诱导化疗前后表达水平(拷贝数/Abl拷贝数×100%)的变化
2.4 复发患者AE、AE9a表达水平的变化 21例复发患者复发时AE与AE9a表达水平均上升。66.7%(21例中14例)的患者在AE融合基因表达水平升高以及最终的形态学复发之前,AE9a已开始出现升高,甚至异常升高,而此时AE融合基因的表达处于较低水平。其余7例患者中5例AE9a表达水平升高与AE融合基因升高同步,并未提前;2例患者自发病至复发AE9a表达持续在较高水平,AE表达亦持续在较高水平,并且这2例在巩固治疗期间即复发。复发组AE及AE9a基因转阴时间似乎比未复发组更晚,是不是提示转阴时间与复发相关,但由于随访监测为6个月1次,对比无统计学意义。
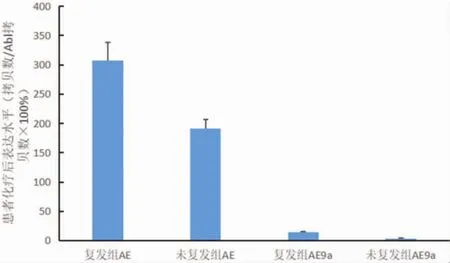
图1 复发组与未复发组治疗前比较
图2 化疗后复发及未复发组AE和AE9a下降幅度比较
3 讨论
急性髓系白血病常常伴有多种类型的基因突变或融合基因[7],AML1-ETO 作为 t(8;21)AML 典型的融合基因,既往用于微小残留白血病的监测[8],但近期研究发现AE融合基因存在于部分正常人和非白血病细胞系及伴有t(8;21)AML获得缓解的患者骨髓细胞中可持续低表达,因而单独检测AE并不能很好的预测白血病复发[9];表明AE融合基因单独并不能引起白血病的发生,需获得额外的突变才能转化为白血病[10]。Wolford[3]通过对t(8;21)患者骨髓样本进行RT-PCR检测,证明存在多种AMLl-ETO转录本,AE9a是其中一种最常见的;Yan等[11]通过建立动物模型研究AE及其异构体AE9a的致白血病作用,发现AE9a与白血病发生的关系较AE更紧密,这就让我们思考是否可利用监测AE和AE9a来达到监测微小残留病的目的。
本研究中,89.13%(41/46)确诊伴有 t(8;21)的AML-M2患者中检测到AE9a异构体的表达,证实了AE9a异构体与AE融合基因具有高度相关性,提示作为MRD监测指标的可行性。初诊患者经1个疗程标准方案化疗后,AE与AE9a的表达水平均有所下降,特别在未复发组患者中两者的表达水平下降较明显,但在复发组AE下降的水平明显高于 AE9a(P<0.01),表明 AE9a 表达水平下降幅度较AE低,至此我们推测高表达AE9a异构体的白血病细胞对化疗的敏感性较低表达AE9a的白血病细胞差,可能在疾病的发生及进展中占更加重要的地位。这与李林萌[12]研究结果一致,AE9a异构体可能在疾病发生及进展中发挥比AE更重要的作用。
是否可以单独监测AE9a来预测白血病复发呢?DeKelver RC[13]以及 Wang Z[14]报道中指出,AE9a基因总的表达水平较低,拷贝数与内参基因对比,常常低于10-4,在目前实验方法不能精确到10-6或更低级别情况下不宜单独作为监测指标。Link KA[15]发现AE可使长期培养的人脐带血CD34+细胞不出现凋亡现象,但如果仅仅有9a转录本似乎存在缺陷,AE和AE9a的共转导导致了表达细胞的选择性生长。本实验中,缓解期间66.7%(14/21)确诊伴有 t(8;21)的 AML-M2 患者在AE水平升高以及最终的形态学复发之前,AE9a表达水平已开始出现升高,而此时AE融合基因拷贝数处于较低水平。其余7例患者中4例AE9a百分比升高与AE融合基因升高同步,并未提前,可能与随访时间点比较少有关;2例自发病至复发,AE融合基因及AE9a百分比持续在较高水平。另外缓解期间,AE9a在复发组中表达水平高于非复发患者,说明AE9a在白血病中长期存在很可能是AML复发的重要影响因素,在白血病复发中发挥重要作用。本研究由于复发病例数较少,并且随访时间点为6个月,所以并不能说明AE9a比AE更好的作为MRD的监测指标,增加入组病例以及增加随访时间点,应该能得到更好的答案。
总之,在缓解期联合检测AE及AE9a表达水平的变化,作为微小残留病的监测,可能比单独监测AE融合基因能更早预测疾病的发展,从而可提前进行临床干预,降低患者的复发率,提高患者的长期生存率。

