低分子量肝素对大鼠SAP胰腺和肺组织形态学的影响
刘斌焰 ,邢雁霞 ,赵一锦 ,李 祥 ,李 婷 ,王 佳 ,刘斌钰 ∗
(1.山西大同大学医学院,山西大同037009;2.山西大同大学呼吸病与职业病研究所,山西大同037009)
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症,大约25%可转化为重症急性胰腺炎(Se⁃vere Acute Pancreatitis,SAP)[1]。SAP病变凶险、常伴有全身的多器官并发症[2-3],因此死亡率较高。SAP是多病因疾病,与胰酶过度自身消化、胰腺微循环障碍、炎症细胞过度激活及肠道细菌易位等有关。低分子量肝素(low molecular weight heparin,LMWP)具有抗凝、抗炎、降血脂和免疫调节等作用[4]。课题组前期研究显示LMWP对大鼠SAP的肝和肾组织损伤具有保护作用[5-6],本实验探讨LMWP对大鼠SAP胰腺和肺组织形态学的影响作用。
1 材料和方法
1.1 药品与动物
低分子量肝素为北京永康药业产品(15100501);雄性Wistar大鼠,体质量400±25 g,购于北京维通利华公司。
1.2 试剂
牛磺胆酸钠为美国Sigma公司产品,血清TNF-a和IL-6试剂盒为碧云天公司产品,苏木精和伊红为北京中杉金桥公司产品。
1.3 仪器
冰冻切片机(Leica,CM1950),台式冷冻离心机(D78532型)德国Hettich公司;酶标仪(ELX800型)美国BIO-TEK仪器公司。
1.4 方法
取雄性Wistar大鼠36只,采用牛磺胆酸钠制备SAP模型,造模方法参见文献[7];造模后随机分为2组,模型组和低分子量肝素组(简称肝素组),模型组立即给予等剂量溶剂,肝素组给予低分子量肝素100 iu/kg,每日2次腹腔注射,0.1 mL/100 g每次;每组又分为术后6、12和24 h 3个亚组,6只/组。
1.5 组织标本制备
各组于术后6、12和24 h取胰腺和肺组织,置10%中性缓冲甲醛液中固定24 h,常规制成石蜡块切片,苏木精—伊红(HE)染色,供病理检测。光镜下采集术后6、12和24 h大鼠胰腺和肺组织图像,拍照并统计每个完整切面的炎细胞数;随机采集5个/张切片不重叠视野图像,借助Image-ProPlus6.0计算机图象分析系统完成。
1.6 生化指标检测
在术后6、12和24 h取血分离血清,用双抗体夹心法(ELISA)法测定血清TNF-α和IL-6含量。
1.7 统计学处理
2 结果
2.1 低分子量肝素对SAP大鼠胰腺组织形态学的影响
2.1.1 胰腺肉眼观察结果
大鼠ST造模后,在6、12和24 h时间点,模型组大鼠胰腺出现不同程度的出血或坏死样改变,胰腺及胰周组织出现皂化斑,伴血性腹水;肝素组大鼠胰腺出血或坏死程度、胰腺和胰周皂化斑及血性腹水均较模型组有不同程度的减轻。
2.1.2 胰腺组织病理学检查HE
染色结果显示,SAP模型组6 h胰腺小叶间隙增宽,排列不整齐,伴炎细胞浸润和出血;12 h胰腺小叶结构破坏,组织大片坏死,坏死区域腺泡结构消失;24 h胰周脂肪片状坏死,细胞玻璃样变、核溶解消失,坏死区有不同程度炎细胞浸润(图1A)。各时间点肝素组的胰腺腺泡小叶结构破坏、腺泡肿胀、腺泡细胞变性和胰小叶坏死程度较模型组明显减轻,可见胰岛结构,病变区域炎细胞浸润减少,随低分子量肝素治疗时间的延长,病变逐渐减轻(图1B)。
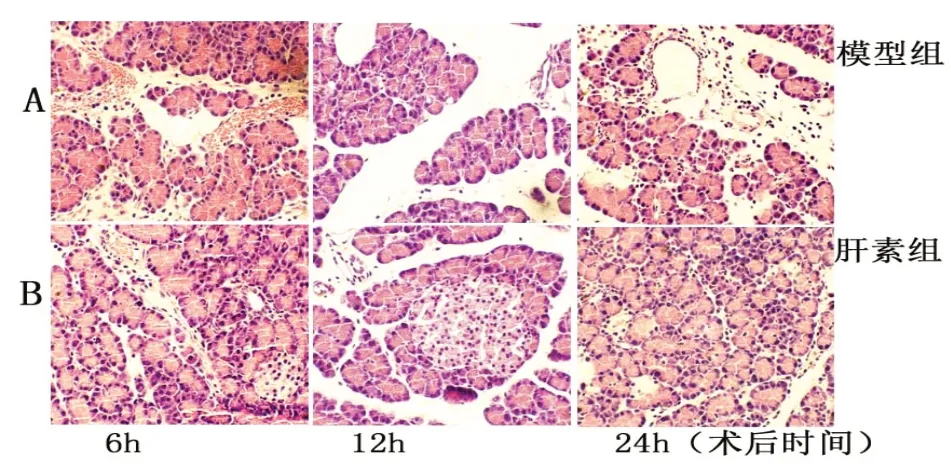
图1 大鼠SAP胰腺形态学变化(HE×400)
2.1.3 胰腺组织病理学评分标准
胰腺病理评分参考Kusske[8]标准,观察胰腺水肿、出血、坏死、炎细胞浸润情况并以此行病理学评分,见表1。
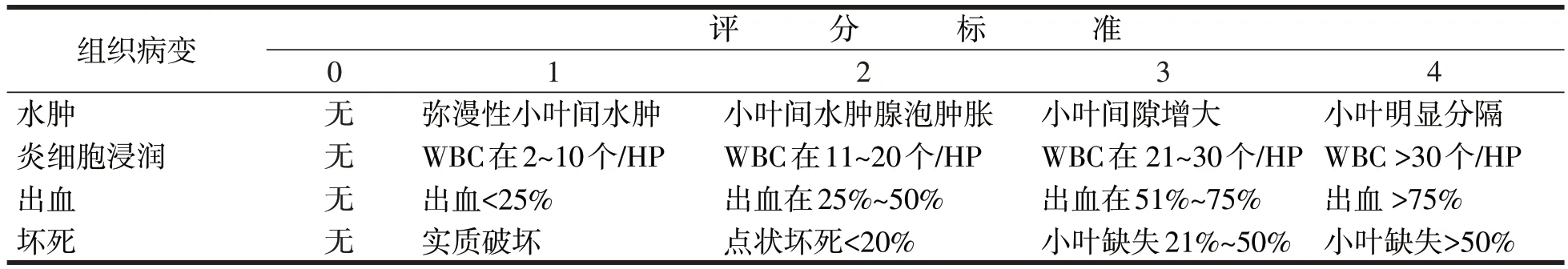
表1 胰腺组织病理学评分标准
2.1.4 胰腺组织病理学评分
得分=水肿+坏死+炎细胞浸润+出血。大鼠模型组与肝素组胰腺组织病理学评分,6、12和24 h不同时间t值分别为7.36、9.08、7.32,P<0.001,见图2。
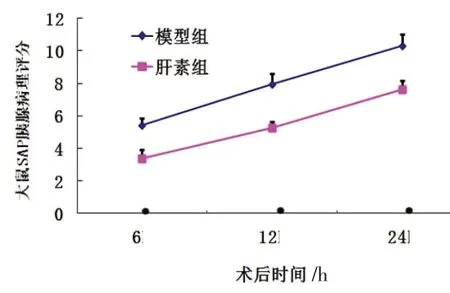
图2 大鼠SAP胰腺组织病理评分
2.2 低分子量肝素对SAP大鼠肺组织形态学的影响
2.2.1 肺组织肉眼观察的结果
模型组大鼠胸腔内可见多量的淡黄色或血性胸水,肺组织有不同程度出血水肿,并随时间延长逐渐加重;肝素组大鼠胸腔内见少量胸水,肺组织有轻度出血水肿,并随低分子量肝素的作用时间延长而减轻。
2.2.2 肺组织病理学检查
HE染色结果显示,SAP模型组6 h肺组织炎细胞浸润明显,肺间质有充血水肿及出血现象,12 h可见肺泡腔内出血明显,炎细胞浸润,邻近肺泡隔断裂形成肺大泡,24 h可见肺泡间隔增宽、肺泡萎陷和肺泡融合形成肺大泡(图3A);肝素组的肺组织炎细胞浸润、出血等病理形态改变较模型组轻(图3B)。
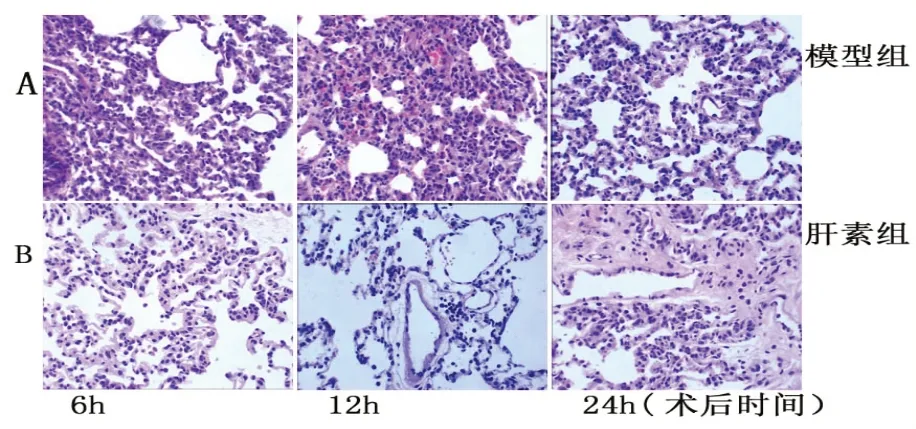
图3 大鼠SAP肺形态学变化(HE×400)
2.2.3 肺组织病理学评分标准
肺组织病理评分参照Hofbauer等[9]标准对大鼠肺组织病理变化进行评分,以水肿、炎细胞浸润和出血程度、肺实质组织和空肺泡所占面积的百分比来判断肺损伤的程度。评分标准见表2。
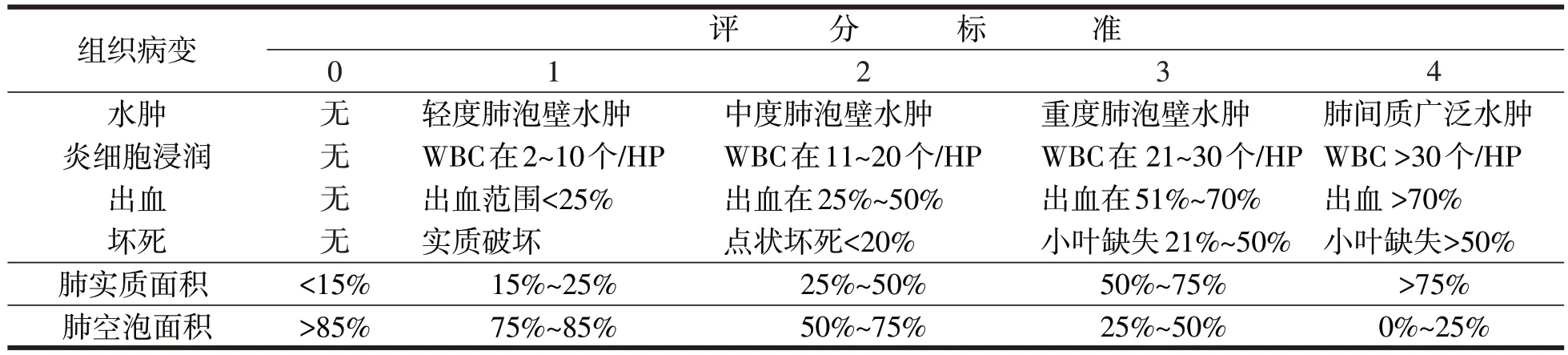
表2 肺组织病理评分标准
2.2.4 肺组织病理学评分
得分=水肿+炎细胞浸润+出血+肺实质面积+肺空泡面积。大鼠模型组与肝素组6、12和24 h肺组织病理学评分t值分别为5.76、5.34、9.02,P< 0.001,见图4。
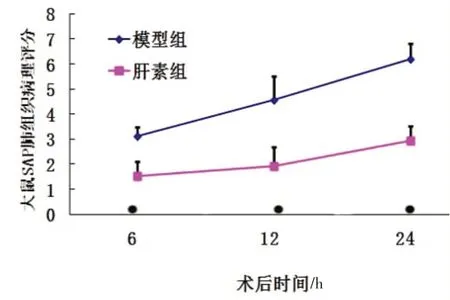
图4 大鼠SAP肺组织病理评分
2.3 低分子量肝素对SAP大鼠血清
血清TNF-α和IL-6的检测,采用ELISA相应TNF-α和IL-6试剂盒进行。结果见图5~6。
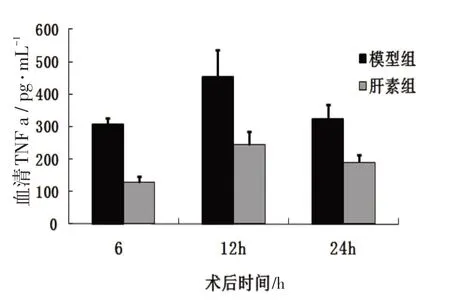
图5 大鼠SAP血清TNF-a比较
结果显示,术后6、12、24 h血清TNF-α水平肝素组与模型组比较有显著性差异(P<0.01);术后不同时间血清IL-6的水平肝素组与模型组比较有显著性差异(P<0.01)。
图6 大鼠SAP血清IL-6比较
3 讨论
低分子量肝素分子量低,平均为4 000~6 000,李介秋和范钦桥等[10-11]学者研究显示,LMWP抑制胰微血管内微血栓形成,同时还能使形成的微血栓溶解,从而达到改善胰腺微循环,减轻缺血-再灌注损伤和胰腺坏死。本实验结果显示:胰腺水肿、炎细胞浸润、出血和坏死以12~24 h最重,肝素组胰腺损伤程度比模型组明显减轻胰腺病理;肺组织病理结果显示肝素组肺损伤程度比模型组明显减轻。本结果提示低分子量肝素早期干预可减轻SAP胰腺和肺组织病理改变。程洁等[1]Meta分析结果显示,LMWP通过减少炎性介质释放,改善微循环,减少急性胰腺炎发展为SAP,减少并发症,降低死亡率。
TNF-a和IL-6均参与SAP炎症瀑布式级联反应,参与胰腺及肺等胰外器官损伤并起着重要作用[12]。本实验观察到TNF-a和IL-6水平从术后6 h开始升高,12 h继续上升,24 h出现不同程度的降低;在相同时间点肝素组与模型组比较,TNF-a和IL-6水平均下降(P<0.001),提示低分子量肝素通过抑制血清TNF-a和IL-6的水平,可以减轻SAP胰腺和肺损伤。
4 小结
低分子量肝素降低血清TNF-a和IL-6水平,抑制炎细胞聚集,减轻全身和胰腺组织炎症反应,缓解胰腺和肺组织病变。

