Rho激酶抑制剂联合神经生长因子促进脊髓损伤后神经再生的实验研究
董春霞,金 善
神经生长因子(NGF)广泛存在于神经系统中,属于神经调节因子之一,对神经细胞的生长、分化、存活、再生和功能维护等多方面具有调控作用;同时对于受损伤的神经,可以发挥营养和促进修复及再生的作用。研究发现髓鞘源性抑制分子可以激活Rho激酶活性,而NGF可以对此过程产生明显的抑制作用,因此能够在上游途径阻断Rho/Rho激酶信号通路[1,2];Fasudil属于 Rho 激酶的抑制剂,可以从下游途径对Rho/Rho激酶信号通路进行阻断。因此NGF联合Rho激酶抑制剂能够在上下游途径同时阻断Rho/Rho激酶信号通路,从而最大程度地促进神经修复和再生。目前针对脊髓损伤的情况,尚未有机构将二者联合应用进行研究。该研究选择应用Fasudil联合神经生长因子进行治疗,目的在于研究二者联合应用对大鼠脊髓损伤神经再生的促进作用。
1 材料与方法
1.1 基础资料及分组方式 该次研究共选择40只清洁级健康的雌性SD大鼠,体重均在250~300 g。按照随机分组的方式分成四组,每组10只,具体分为对照组,Fasudil治疗组,NGF治疗组和Fasudil+NGF联合治疗组四组。其中Fasudil治疗组在对大鼠进行脊髓横断后,立即给予腹腔注射Fasudil Hydrochloride 5 mg/kg,1次/d,同时采用微量注射泵以3μl/h的速度经蛛网膜下腔持续注射生理盐水20μl/d,连续注射4 W;NGF治疗组每只大鼠经微量注射泵以3μl/h的速度持续蛛网膜下腔注射NGF20 μl(60 μg)/d,同时腹腔注射生理盐水(与Fasudil Hydrochloride同体积)1次/d,连续4 W;Fasudil+NGF联合组同时腹腔注射Fasudil Hydrochloride 5 mg/kg,1次/d及微量注射泵蛛网膜下腔注射 NGF 3 μl/h,20 μl(60 μg)/d,连续 4 W;对照组腹腔及蛛网膜下腔注射等量生理盐水。
1.2 主要试剂 多聚甲醛 (上海化学试剂厂),Mouse Anti-Tau1抗体 (美国 Millipore公司),SABC-Cy3试剂盒 (武汉博士德生物工程有限公司),Fasudil Hydrochloride(天津红日药业有限公司),注射用鼠神经生长因子(武汉海特生物制药股份有限公司)。
1.3 仪器 眼科维纳斯剪(江苏六六视觉科技股份有限公司),手术显微镜(上海医疗仪器厂),微量注射泵(来普LP210型),MDF-32V超低温冰箱(日本SANYO),恒冷箱切片机(德国Leica公司),荧光显微镜(奥林巴斯BX51),多聚赖氨酸载玻片(上海桑戈生物科技有限公司)。
1.4 方 法
1.4.1 模型制备 使用10%的水合氯醛对大鼠进行腹腔注射麻醉,按照0.4 g/kg给药剂量注射;待麻醉起效后,将大鼠取俯卧四肢外展体位固定于手术台上。该次研究脊髓损伤位置均选择在T10节段,根据T9~T11的骨性标志进行查找定位,然后对手术区进行备皮、消毒并铺设无菌洞巾。在手术区域沿棘突做一约4 cm长的纵行切口,分层切开皮肤和浅筋膜,然后进行软组织分离,至T7~T9椎板暴露;将T8的椎板和棘突咬除,并注意尽量减少对周围脂肪组织的撕扯,以防由于椎管内静脉丛破裂而导致大出血。然后在显微镜下进行操作,将椎管和硬膜囊充分暴露出来,并剪开硬膜囊,应用眼科维纳斯剪跨过脊髓背侧中线将脊髓后3/4剪断,深度约为1.5 mm(该次研究所选大鼠的脊髓深度约在2 mm左右);并用棉片对受伤位置轻压止血,利用前期分离出的软组织进行创口填塞,从而达到减少脑脊液外漏及隔绝外界炎性物质刺激的作用,防止对脊髓继续造成损伤;同时在创口撒上青霉素粉剂,按照组织分层,从肌肉到皮下、皮肤逐层进行缝合。对于假手术组所有过程与横断组相同,但不进行脊髓切断。
1.4.2 大鼠蛛网膜下腔置管 大鼠横断模型制备成功后暂不完全缝合创口,于T10节段处蛛网膜下腔内插入硬膜外导管,导管与椎旁软组织及皮肤固定,另一端露于皮肤外,石蜡封口,注射药物时与微量注射泵连接。
1.4.3 术后护理 由于脊髓神经损伤,术后大鼠体温调节功能严重失调,出现体温偏低的情况,所以术后应将饲养环境中的温度保持在25~28℃,同时注意通风问题。术后预防性给予青霉素40万U,肌肉注射1次/d,连续给药7 d;同时为防止出现水电解质紊乱给予生理盐水10 ml/d,腹腔注射,连续给药7 d;另外术后7 d内给予含有呋喃坦啶的饮用水以防止和减轻尿路系统感染;术后应加强饮食营养支持,可给予适量饼干。术后实验大鼠分笼饲养,避免互相影响,垫料需要每日定时更换;同时为了避免大鼠术后出现下肢水肿和压疮,应每日进行患肢按摩,并对下肢周围皮肤进行清洗和干燥。术后1~2 W大鼠可以恢复自主排尿功能,在此之前应通过按摩和挤压膀胱辅助进行排尿2次/d。
1.4.4 运动功能评价 采用 BBB(Basso,Beattie,and Bresnahan)Locomotor Rating Scale[3]运动功能评分法对大鼠的后肢运动功能进行评价,评价采用实验操作者以外的双人、双盲独立评价方式,最后按照平均值进行评分。具体标准如下:0分:后肢完全未能运动。1分:1或2个关节可以进行轻微运动,多数为膝或踝关节。2分:存在1个可以进行广泛运动的关节,可同时伴或不伴有另1个可轻微运动的关节。3分:存在2个可以进行广泛运动的关节。4分:3个关节均可以进行轻微运动。5分:2个可轻微运动的关节和第3个可进行广泛运动的关节。6分:2个可进行广泛运动的关节和第3个可轻微运动的关节。7分:3个关节均可以进行广泛运动。8分:无负重状态下可以进行运动或足底踏地。9分:只有在静止状态下可以进行负重足底踏地,或者频繁甚至持续的足背踏地。10分:负重足底步态偶尔发生,但与前肢运动并不协调。11分:负重足底步态频繁或持续,但与前肢运动并不协调。12分:负重足底步态频繁或持续,与前肢运动偶尔协调。13分:负重足底步态频繁或持续,与前肢运动协调较为频繁。14分:持续存在负重足底步态,且与前肢运动协调状态持续存在;在刚抬腿和刚接触地面时姿势以内旋或外旋为主,呈现出频繁的足底步态,前后肢运动持续协调,偶见足背步态。15分:持续存在负重足底步态,且与前肢运动协调状态持续存在;前肢向前运动时未见或偶见趾尖交替踏地,爪子初次接触地面时爪位与身体方向相同且较有力量。16分:持续存在负重足底步态,且与前肢运动协调状态持续存在;前肢向前运动时趾尖交替踏地较频繁,当爪子初次接触地面时,及立足姿势在结束抬爪之前,爪位与身体方向相同且较有力。17分:足底步态和与前肢相协调的运动持续存在,前肢向前运动时趾尖交替踏地频繁,在落爪和抬爪时,爪位与身体方向相同且较有力。18分:足底步态和与前肢运动协调状态持续存在,前肢向前运动时趾尖交替踏地频繁,在落爪和抬爪时,爪位与身体方向相同且十分有力。19分:足底步态和与前肢相协调的运动持续存在,前肢向前运动时趾尖交替踏地频繁,在落爪和抬爪时,爪位与身体平行,且积极有力,大鼠尾部始终保持下垂状态。20分:足底步态和与前肢相协调的运动持续存在,前肢向前运动时趾尖交替踏地频繁,在落爪和抬爪时,爪位与身体平行且有力,大鼠尾部持续抬起状态,躯干稳定性差。21分:连续的足底步态,且步态协调,脚尖持续踏地,整个过程爪位有力且与身体平行,尾部持续抬起状态,且躯干稳定。
特别说明:(1)足底步态是指足底与地面接触以支持自身体重,且后肢积极进行向前方运动时足底能够再次与地面接触并支持体重。(2)足背步态是指在行走的过程中,足背的某个部位发挥支持体重的作用。
1.5 脊髓组织切片制备 每次评分结束后,在四组大鼠内各随机抽取5只,将右心耳剪开,然后经左心室插管到升主动脉内,首先灌注500 ml 37℃的生理盐水,然后快速灌注250 ml 4%的多聚甲醛(pH7.4),当大鼠全身抽搐时需要首尾拉直并减缓灌注速度;1 h内再次灌注250 ml的多聚甲醛,此时大鼠出现全身僵硬。完成灌注后,在脊髓横断上下位置各0.5 cm处取1 cm长度的损伤段脊髓,置于4%的多聚甲醛内进行固定,时间为6 h,然后进行脱水处理、石蜡包埋,恒冷切片机内切片,矢状位切片厚6μm,并贴于防脱载玻片上,晾干后-20℃保存。最后应用SABC法进行RhoA和ROCK2免疫组织化学染色。
1.6 免疫荧光染色(Tau1)方法 具体操作如下:(1)将冰冻切片在室温环境下放置1 h,然后置入0.01mol PBS 中清洗 3 次,10min/次;(2)滴加 0.01mol PBS1∶10稀释的正常血清封闭液,室温10 min,除去多余液体;(3)滴加 0.01 mol PBS1∶500 稀释的小鼠抗 Tau1 一抗,37 ℃ 2 h;(4)0.01 mol PBS 洗涤2 min×3 次;(5) 滴加 0.01 mol PBS1∶100 稀释的生物素化抗小鼠 IgG,37 ℃ 30 min;(6)0.01 mol PBS洗涤 2 min×3 次;(7) 滴加 1∶100 稀释的 SABCCy3,37 ℃ 30 min;(8)0.01 mol PBS 洗涤 5 min×3次;(9)1∶1 甘油 PBS 封固。
1.7 统计学方法 实验数据以 (x±s)表示,采用SPSS 10.0统计软件进行完全随机设计的方差分析,两组之间比较行Dunnett t检验,P<0.05为差异有统计学意义。
2 结果
该次研究成模的40只大鼠,在4 W观察期内,4只大鼠死亡,其中2只死于体重过低,另2只死于皮肤感染,已根据各组的条件死亡时及时给予补充。
2.1 大鼠BBB评分对比 Fasudil治疗组、NGF治疗组和对照组大鼠术后3 d BBB评分为0分,Fasudil+NGF联合组术后3 d有部分大鼠开始出现后肢轻微运动;术后 7 d、14 d及 28 d时间点Fasudil+NGF联合组、Fasudil治疗组和NGF治疗组BBB评分均较对照组明显升高(P<0.05);术后各时间点Fasudil+NGF联合组BBB评分均较Fasudil治疗组和NGF治疗组升高,差异有显著性意义 (P<0.05)。 见表 1、图 1。
2.2 免疫荧光染色结果 Tau1为轴突标志物,阳性纤维显示为红色荧光,用image软件测量阳性纤维的截面积。4 W时对照组损伤段脊髓组织内阳性纤维数量极少;NGF治疗组阳性纤维较对照组增加,但排列紊乱;Fasudil治疗组阳性纤维也较对照组明显增加,且部分阳性纤维连续性增强;Fasudil+NGF联合组阳性纤维数量较其他三组均明显增加,连续性也明显增强,如表2所示具有显著性差异(P<0.05)。相应运动功能评价见图2。
表1 各组大鼠不同时间点BBB评分,分)

表1 各组大鼠不同时间点BBB评分,分)
注:与 Fasudil组、NGF 组比较,*P<0.05;与 Fasudil组、NGF 组和 Fasudil+NGF 组比较,▲P<0.05。
?
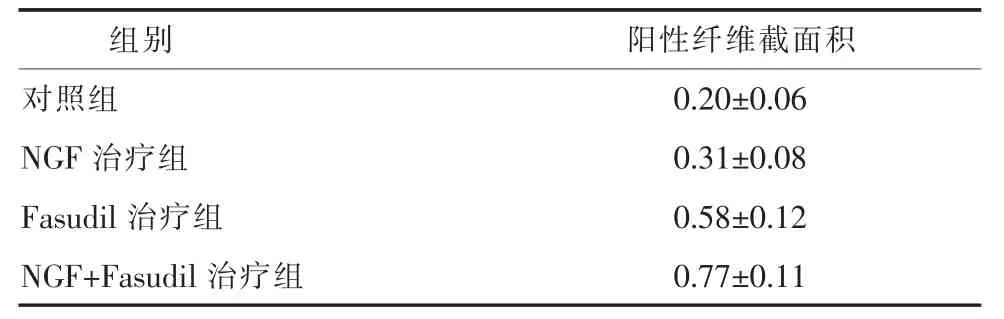
表2 各组大鼠4周时免疫荧光染色阳性纤维截面积(mm2)

图1 术后不同时点运动功能
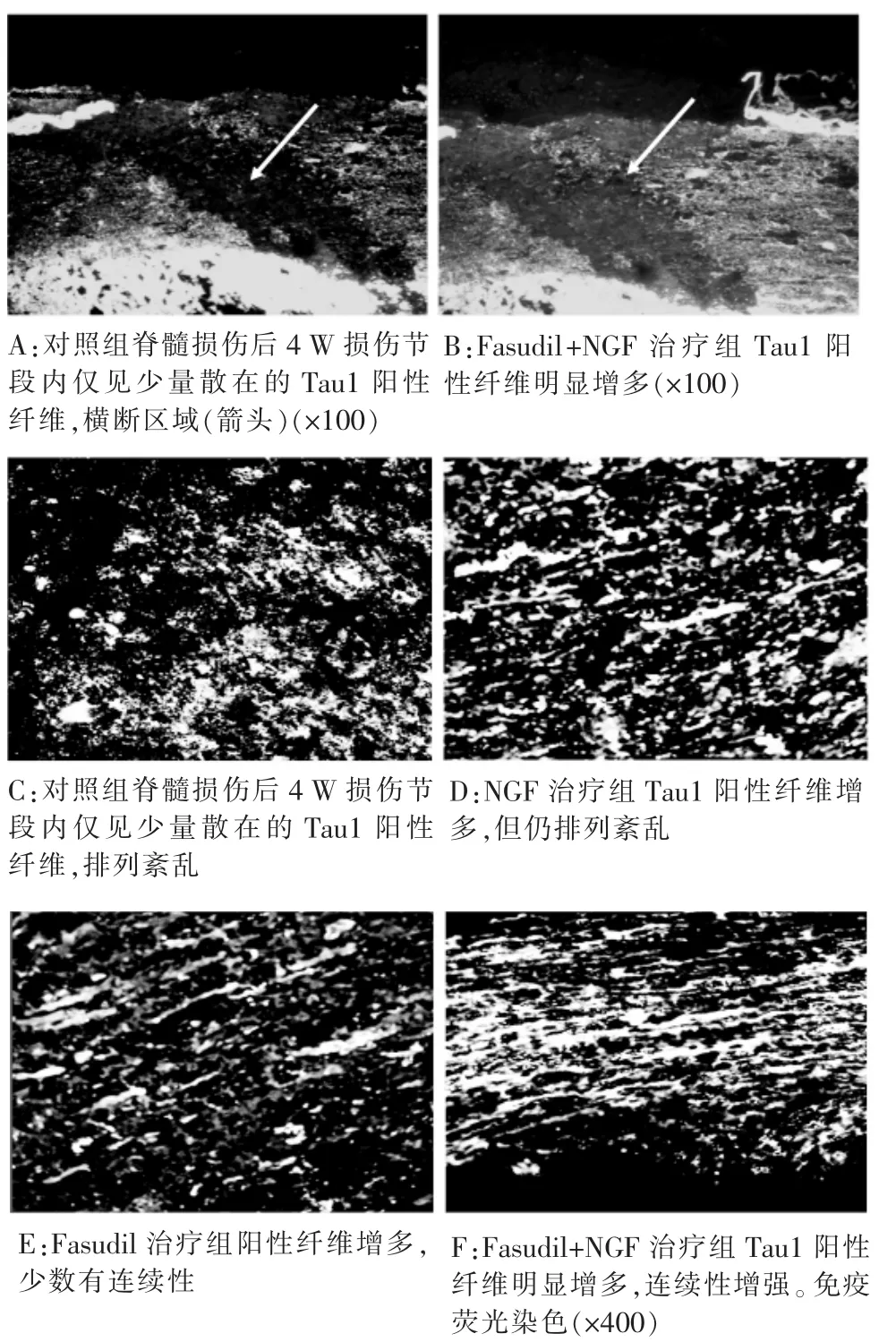
图2 4 W时免疫荧光染色结果
3 讨论
当中枢神经系统(CNS)出现损伤时,局部可发生较为复杂的生理和病理变化,同时存在着多种抑制神经再生的因素,例如局部神经营养因子的缺乏或浓度过低,以及损伤局部出现再生抑制蛋白以及在损伤区形成胶质瘢痕等情况,均不利于神经的修复和再生。Rho/ROCK信号通路的主要生理功能为调节细胞骨架蛋白的合成、降解、移动和收缩等,并参与细胞的迁移、增殖和存活等基本生命过程[4,5]。大量研究显示,Rho/Rho激酶信号通路对损伤脊髓的神经修复和再生具有很强的抑制作用,起到关键作用;因此阻断该信号通路将有助于促进损伤后的神经再生。神经再生过程主要分为三个阶段:轴突芽生、再生轴突的生长和延伸、恢复神经支配原靶器官。研究发现Rho激酶抑制剂Fasudil能够改善脊髓损伤后的运动功能,促进轴突再生,减轻继发性损伤[6]。神经生长因子(NGF)广泛存在于各机体神经系统中,属于神经调节因子之一,对神经细胞的生长、分化、存活、再生和功能维护等多方面具有调控作用;同时对于受损伤的神经,NGF可以发挥营养和促进修复及再生的作用。对其生物学效应进行分析,主要包括以下四个方面:(1)NGF具有较强的促进神经再生作用,可以直接对再生轴突发挥作用,通过受体介导细胞内进行信号转导,激活周围各种分化因子,有效发挥神经趋化作用,从而引导轴突生长并加快生长速度;并通过促进雪旺细胞的增殖分化,吞噬、清除细胞残渣,为神经元的重生提供空间,神经膜细胞同时可以产生髓磷脂对神经轴突进行包绕,恢复超微结构,从而为神经传导恢复打下坚实的基础。(2)NGF具有促进神经芽生的作用。(3)NGF对炎性反应趋化作用和再生神经的血管形成均有促进作用。通过以上分析可见,NGF可以有效促进中枢和外周神经元的生长、发育、分化、成熟,既能够维持神经系统的正常功能,又可以加快神经系统损伤后的修复[2]。同时NGF对已经出现损伤的神经元的基因表达发挥调控作用,抑制细胞凋亡,降低受损神经细胞的死亡率,具有抑制凋亡速度的作用,从而降低神经元的损伤程度。可能的作用机制包括:(1)NGF可以有效促进生长相关蛋白 43mRNA (growth-associated protein,GAP-43 mRNA)的合成;(2)NGF能促进突触素p38mRNA的表达;(3)对毒性氨基酸的释放具有显著的抑制作用;(4)对超氧自由基的释放和钙离子的超载也有显著的抑制作用[7,8]。脊髓损伤后外源性NGF能够发挥神经再生修复作用,但对损伤局部再生仍然存在着抑制作用,从而使NGF不能发挥促神经再生的最佳效果,如果在给予外源性促神经生长因子的同时阻断微环境中抑制神经再生的关键信号传导通路,即Rho/Rho激酶信号通路,就可以最大程度地发挥促进损伤神经的修复和再生作用。目前针对脊髓损伤的情况,尚未有将二者联合应用进行的研究。本研究针对大鼠脊髓损伤情况,选择应用Fasudil联合神经生长因子进行治疗,采用BBB评分及微管相关蛋白Tau1免疫荧光染色法观察联合应用对损伤后轴突再生及运动功能的改善作用,结果显示两者联合应用有协同效应,能在更大程度上促进轴突再生及改善运动功能。
盐酸法舒地尔(fasudil hydrochloride)注射液,属于ROCK抑制剂,可以通过竞争ROCK催化内的ATP结合位点,发挥竞争性拮抗作用,从而阻断ROCK活性,达到抑制Rho/Rho激酶信号通路下段的作用[9]。在Rho/Rho激酶信号通路被阻断后,对于可以导致生长锥形成塌陷的髓鞘源性的再生抑制分子,包括Nogo2A、MAG和Omgp等的传导受到抑制,从而使得损伤后的轴突可以继续进行修复和再生[10]。外源性NGF的应用补充了损伤环境中神经营养因子的缺乏,同时近年来的研究还发现中枢神经系统的髓鞘源性再生抑制分子(Nogo2A、MAG和Omgp等)与NGF之间存在一个共同的低亲和力受体,即p75NTR,所以通过给予外源性NGF,增加中枢神经系统局部NGF的浓度,从而大量与p75NTR发生结合,达到竞争性抑制Nogo2A、MAG和Omgp等与受体的结合,从而抑制其对 Rho 的激活[1,2]。 由此可见NGF能够在Rho/Rho激酶信号通路的上游途径发挥抑制作用,但由于p75NTR只是NGF的低亲和受体[2],因此可能这种抑制作用并不完全。NGF与Fasudil联合应用后,前者部分阻断了Rho/Rho激酶信号通路的上游途径,后者阻断了下游途径,两者共同作用下在更大程度上抑制了Rho/Rho激酶信号通路的传导,而此时NGF在再生抑制机制被阻断的前提下能够更有效地发挥其促神经再生的作用,因此NGF与Fasudil的联合应用在更大程度上促进了脊髓损伤后的轴突再生和相应的神经功能恢复。该次研究结果显示,联合应用Fasudil+NGF组的大鼠术后3 d时BBB评分明显高于对照组与单独应用Fasudil治疗和NGF治疗组的大鼠(P<0.05),同时Fasudil+NGF联合用药组的大鼠多数在术后3 d已经开始出现后肢轻微运动;之后各时间点的比较,Fasudil+NGF联合组的BBB评分也均高于其他三组,由此可以印证,采用Fasudil和NGF联合用药,分别对Rho/Rho激酶信号通路的上游和下游进行阻断,达到彻底阻断的作用。另外免疫荧光染色结果显示,Fasudil和NGF联合应用后,轴突阳性纤维数量更多且排列整齐,连续性更强,也说明二者联合用药对神经的再生具有很好的促进作用。
综上所述,联合应用Fasudil与NGF可以有效促进受损脊髓神经修复和再生,轴突纤维再生增多且连续性强,可以有效改善运动功能,两者联合应用将为脊髓损伤的药物治疗提供新的思路。

