羌活地上部位化学成分及其对农业病原真菌的作用
刘景坤,宿安详,谢 敏,燕志强, 李秀壮,杨晓燕,金 辉,秦 波
(1.中国科学院 兰州化学物理研究所,中国科学院 西北特色植物资源化学重点实验室/甘肃省天然药物重点实验室, 兰州 730000;2. 中国科学院大学,北京 100049;3. 农业部农药检定所,北京 100125)
羌活(NotopterygiumincisumTing ex H. T. Chang或宽叶羌活NotopterygiumfranchetiiH. de Boiss.)为伞形科羌活属多年生草本植物,常用中药材,以干燥根及根茎入药,其性温,味辛,具有解表散寒、祛风、除湿、止痛的功效[1-2]。羌活喜高寒,野生资源分布于云南、四川、青海、甘肃一带,范围较窄[3]。近年来,随着中医中药理念的发展,消耗量不断增加,野生资源不能满足需求,药农开始进行大量人工栽培,其中以川西、甘肃、青海等地为主产,产量可达4 t/hm2,这不仅能满足市场需求,增加药农收益,而且是保护野生资源和西部生态多样性的重要手段[4-6]。
羌活植株丛生,株高可达1 m,地上部位生物量较大,3 a总产量约为地下部分的3~5倍,但由于不能入药,生产中往往被丢弃在农田中。据文献报道,植株残体分解所产生的化学物质往往是其化感物质的重要来源之一,能引起作物连作障碍[7-9]。羌活地上部位丢弃不仅可造成再植障碍,而且也会影响周围植物的生长,降低植被覆盖率,对本已脆弱的西北生态多样性造成一定的影响[10-11]。羌活全株散香,富含挥发油、有机酸和香豆素类活性成分[12-17],目前有关其根部化学成分提取、分离、鉴定的文献较多,而对地上部位化学成分的关注较少,刘卫根等[18]仅对比了地上部位与入药部位中香豆素成分和含量。对羌活地上部位化学成分系统分析和开发利用的研究鲜见报道。
本研究对羌活地上部位化学成分进行分析,研究其挥发性成分中所含的活性化合物的种类,以及非挥发性成分中重要药效组分的含量;并将其提取物应用于3种重要农业病原菌,考察其对重要病原菌的生理活性。为羌活地上部位的处理提供合理的参考,提高植物资源的利用率,这不仅能为植物天然抑菌成分的发掘和开发提供理论基础和有效的研究材料,而且对于实现农业生产“两减”和推动绿色农业的发展[19]具有重要的现实意义。
1 材料与方法
1.1 材料和设备
宽叶羌活(NotopterygiumfranchetiiH.de Boiss.)2016年11月采集自甘肃省宕昌县哈达铺镇,2 a生人工栽培,经甘肃中医药大学晋玲教授鉴定为伞形科羌活属植物宽叶羌活;番茄早疫病病原菌(Alternariasolani)、灰葡萄孢菌(Botrytiscinere,灰霉病病原菌)和尖孢镰刀菌(Fusariumoxysporum,枯萎病病原菌)均由中科院西北特色植物资源化学实验室分离鉴定。试验所用分析纯溶剂(乙醇、甲醇等)购自西陇试剂公司,色谱纯试剂(丙酮、甲醇、乙腈等)购自Fisher公司,分析标准品购自百灵威公司,生物试剂(琼脂等)购自阿拉丁公司,其他试剂购自国药上海试剂厂。
单四级杆气相色谱质谱联用仪(美国Agilent,7890A-5975C),毛线管气相色谱柱为HP-5MS(Agilent);液相色谱仪(美国Waters,2695),配C18色谱柱(Waters,symmetry 5 μm×4.6 mm×250 mm)及DAD紫外检测器;万分之一天平(瑞士梅特勒,AL204),旋转蒸发仪(德国海道夫,4000),超净工作台(苏州净化,SW-CJ-2FD)。
1.2 试验方法
1.2.1 样品处理 采集的羌活去除根、根茎、枯叶、杂草,阴干晾晒,去除泥土等杂物,晾干后打碎,称取100 g ,用φ=90%乙醇浸泡18 h后超声浸提6 h(重复3次),将提取液用双层滤纸过滤后再抽滤(0.45 μm)。低压旋转蒸发至近干,称量计算出膏率。称量浸膏0.05 g两份,一份用丙酮溶解过膜(0.22 μm)后气质联用分析;另一份用甲醇溶解过膜(0.22 μm)后液相色谱分析。
1.2.2 仪器分析 气质联用分析:进样口温度230 ℃,柱温70 ℃起,5 ℃/min升温至280 ℃,保持20 min,辅助加热器280 ℃,四级杆温度150 ℃,离子源温度250 ℃,He做载气,柱流速1.0 mL/min,不分流进样,进样量1 μL,扫描范围30~500 aMu,溶剂延迟1.0 min。
液相色谱分析:选取羌活体内代表性香豆素化合物羌活醇、补骨酯素、东莨菪内酯、秦皮苷为对象,分析其在茎叶组织中的分布情况。用甲醇配制质量浓度为10、2.5、1.25、0.625、0.125 μg/mL标准溶液,样品采用梯度洗脱,流动相为甲醇(A)和水(B),梯度线性变化如下:0~15 min,20%~40% A;15~20 min, 40%~65% A;20~40 min,65% A;40~60 min, 90% A;流速0.8 mL/min, 检测波长310 nm,进样量10 μL,柱温28℃±3 ℃。
1.2.3 提取物对植物病原真菌的作用 采用带毒平板法考察提取物对常见作物病原真菌的作用[20]。无菌条件下称取适量的浸膏,加入二甲亚砜(DMSO)和吐温80进行助溶,待PDA培养基冷却至45 ℃左右时将培养基倒入浸膏溶液中混匀,使DMSO和吐温80的体积分数为1.5%,浸膏的质量浓度为20、10、5、2.5、1.25 mg/mL。将培养基倒入培养皿中,冷凝后,用无菌打孔器选取菌落生长状况一致的菌丝平板打取菌饼(直径4 mm),并将菌饼接种至上述带浸膏的平板上。对照组不加浸膏,仅加相同浓度的DMSO和吐温80。每个浓度和菌株在一个平板中接种3个菌饼为平行试验。所有接种平板放至于28 ℃恒温培养箱中培养。约3 d后观察长势,并用十字交叉法对每个菌落直径测量2次求直径平均,3个菌落再次取平均,计算抑制率,抑制率=(对照组菌落平均半径-试验组菌落平均半径)/对照组菌落平均半径×100%。使用SPSS 19.0求出回归方程,半数有效浓度(EC50)值。
2 结果与分析
2.1 羌活地上部分提取物分析
2.1.1 气质联用分析结果 在上述气相色谱和质谱条件下,得到的总离子流如图1所示,峰的数量较多表明其挥发性成分复杂,使用NIST 11.0标准谱库进行对比,共得到200多个组分,其中匹配度在80% 以上的物质有为53个,匹配度90以上的物质有40个(表1)。从表1中可以看出,挥发性成分主要是小分子的酸(如棕榈油酸、十七烷酸、肉豆蔻酸等)、酮(植酮等)、烯(毕澄茄烯、石竹烯、新异长叶烯等)、醇类(红没药醇、二氢山芹醇等)。采用面积归一法进行相对定量发现,占比较大的是长链脂肪酸、植物甾醇、部分烯类以及部分酰胺类物质。
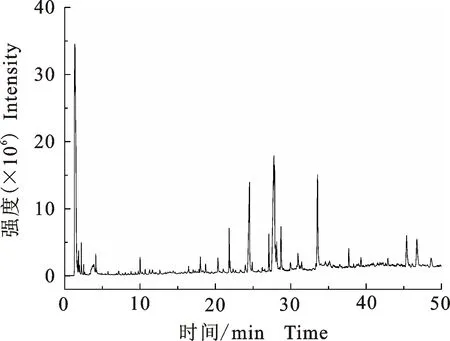
图1 羌活提取物的总离子流图(GC-MS)Fig.1 Total ion chromatography spectrμm(GC-MS) of extract of N.incisum
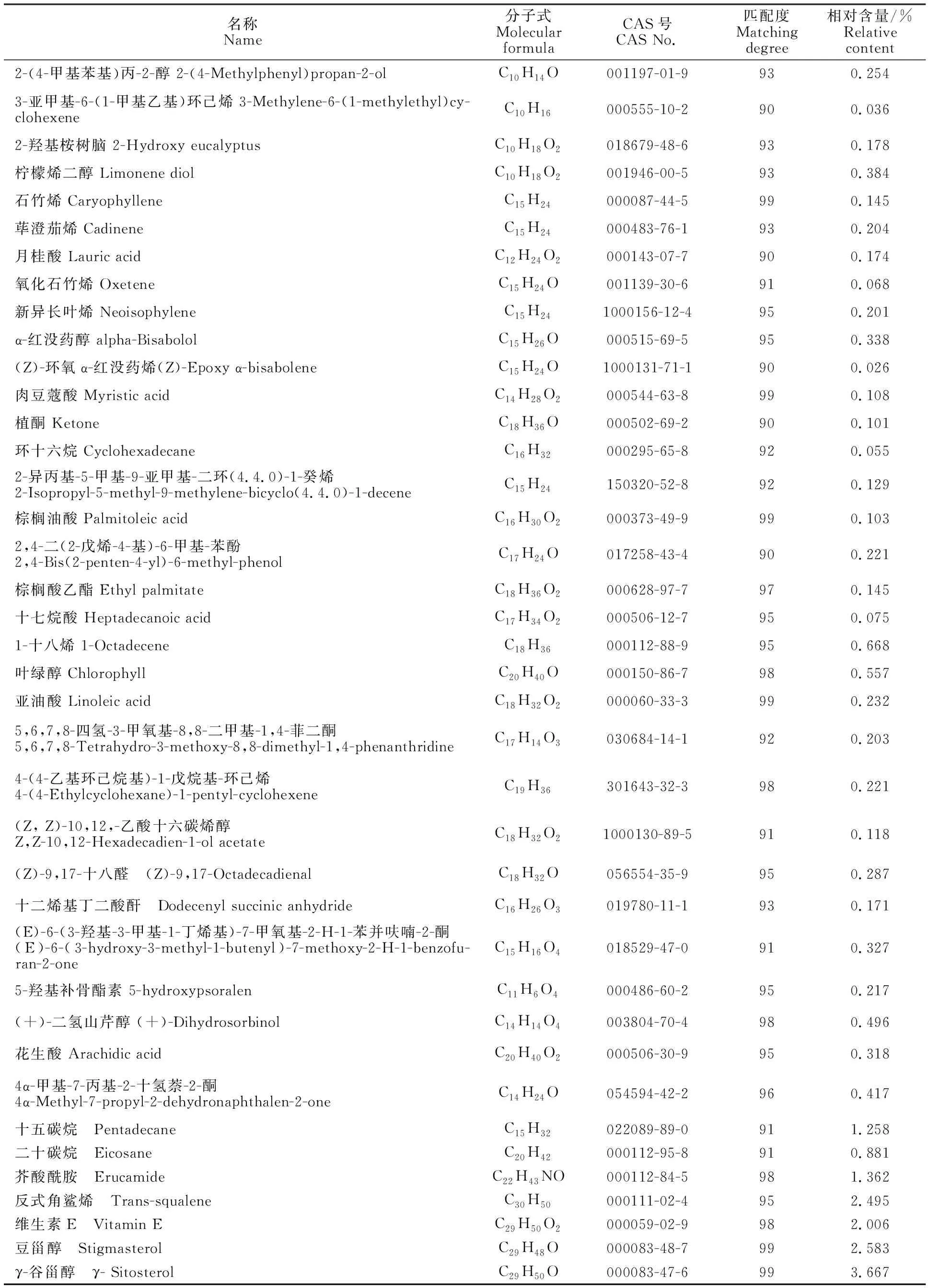
名称Name分子式Molecular formulaCAS号CAS No.匹配度Matching degree相对含量/%Relative content2-(4-甲基苯基)丙-2-醇 2-(4-Methylphenyl)propan-2-olC10H14O001197-01-9930.2543-亚甲基-6-(1-甲基乙基)环己烯 3-Methylene-6-(1-methylethyl)cy-clohexeneC10H16000555-10-2900.0362-羟基桉树脑 2-Hydroxy eucalyptusC10H18O2018679-48-6930.178柠檬烯二醇 Limonene diolC10H18O2001946-00-5930.384石竹烯 CaryophylleneC15H24000087-44-5990.145荜澄茄烯 CadineneC15H24000483-76-1930.204月桂酸 Lauric acidC12H24O2000143-07-7900.174氧化石竹烯 OxeteneC15H24O001139-30-6910.068新异长叶烯 NeoisophyleneC15H241000156-12-4950.201α-红没药醇 alpha-BisabololC15H26O000515-69-5950.338(Z)-环氧α-红没药烯(Z)-Epoxy α-bisaboleneC15H24O1000131-71-1900.026肉豆蔻酸 Myristic acidC14H28O2000544-63-8990.108植酮 KetoneC18H36O000502-69-2900.101环十六烷 CyclohexadecaneC16H32000295-65-8920.0552-异丙基-5-甲基-9-亚甲基-二环(4.4.0)-1-癸烯2-Isopropyl-5-methyl-9-methylene-bicyclo(4.4.0)-1-deceneC15H24150320-52-8920.129棕榈油酸 Palmitoleic acidC16H30O2000373-49-9990.1032,4-二(2-戊烯-4-基)-6-甲基-苯酚2,4-Bis(2-penten-4-yl)-6-methyl-phenolC17H24O017258-43-4900.221棕榈酸乙酯 Ethyl palmitateC18H36O2000628-97-7970.145十七烷酸 Heptadecanoic acidC17H34O2000506-12-7950.0751-十八烯 1-OctadeceneC18H36000112-88-9950.668叶绿醇 ChlorophyllC20H40O000150-86-7980.557亚油酸 Linoleic acidC18H32O2000060-33-3990.2325,6,7,8-四氢-3-甲氧基-8,8-二甲基-1,4-菲二酮5,6,7,8-Tetrahydro-3-methoxy-8,8-dimethyl-1,4-phenanthridineC17H14O3030684-14-1920.2034-(4-乙基环己烷基)-1-戊烷基-环己烯4-(4-Ethylcyclohexane)-1-pentyl-cyclohexeneC19H36301643-32-3980.221(Z, Z)-10,12,-乙酸十六碳烯醇Z,Z-10,12-Hexadecadien-1-ol acetateC18H32O21000130-89-5910.118(Z)-9,17-十八醛 (Z)-9,17-OctadecadienalC18H32O056554-35-9950.287十二烯基丁二酸酐 Dodecenyl succinic anhydrideC16H26O3019780-11-1930.171(E)-6-(3-羟基-3-甲基-1-丁烯基)-7-甲氧基-2-H-1-苯并呋喃-2-酮(E)-6-(3-hydroxy-3-methyl-1-butenyl)-7-methoxy-2-H-1-benzofu-ran-2-oneC15H16O4018529-47-0910.3275-羟基补骨酯素 5-hydroxypsoralenC11H6O4000486-60-2950.217(+)-二氢山芹醇 (+)-DihydrosorbinolC14H14O4003804-70-4980.496花生酸 Arachidic acidC20H40O2000506-30-9950.3184α-甲基-7-丙基-2-十氢萘-2-酮4α-Methyl-7-propyl-2-dehydronaphthalen-2-oneC14H24O054594-42-2960.417十五碳烷 PentadecaneC15H32022089-89-0911.258二十碳烷 EicosaneC20H42000112-95-8910.881芥酸酰胺 ErucamideC22H43NO000112-84-5981.362反式角鲨烯 Trans-squaleneC30H50000111-02-4952.495维生素E Vitamin EC29H50O2000059-02-9982.006豆甾醇 StigmasterolC29H48O000083-48-7992.583γ-谷甾醇 γ- SitosterolC29H50O000083-47-6993.667
羌活全株具有独特的芳香气味物质,这与其体内的挥发性成分具有重要的关系[12, 15-16],特别是芳香性的烯、酮、酰胺类化合物是其气味的主要来源之一;另外,在挥发性化合物中,有很多物质如异龙脑、石竹烯、柠檬烯、二氢山芹醇等具有杀菌的生物活性[12,15-16];此外,还有谷甾醇、豆甾醇、麦角固醇等甾体类、维生素E以及少量酰胺类化物可能在其生长过程中产生重要作用。
2.1.2 液相色谱分析结果 经液相色谱分析,羌活干燥的茎叶中秦皮苷未检出,东莨菪内酯、补骨酯素、羌活醇3种香豆素类化合物均检出,其质量分数分别为16.0±1.2 μg/g,55.0±4.0 μg/g, 1.24±0.30 mg/g。可以看出,东莨菪内酯和补骨酯素质量分数在茎叶中较小,羌活醇质量分数较大。羌活中含有多种香豆素类化合物,是其特征性成分,其中羌活醇和异欧前胡素质量分数较高,对羌活芳香性气味贡献也较大。尽管有文献报道[17]羌活药用部位根和根茎中羌活醇质量分数可超过10 mg/g ,是地上部位的近10倍,但羌活为多年生植物,生长较慢且根茎产量有限,但地上部位为1 a生,且产量较大,因此地上部位中所含的羌活醇资源也值得研究和开发利用。

1.秦皮苷 Fraxin;2.东莨菪内酯 Scopoletin;3.补骨酯素 Psoralen;4.羌活醇 Notopterol
2.2 羌活地上部分提取物抑菌效果
从图3可以看出,羌活提取物对番茄早疫病病原菌、灰葡萄孢菌、尖孢镰刀菌生长均有较明显的抑制效果,不仅菌落扩展半径受到明显抑制而且菌丝密度显著降低,随着提取物质量浓度增加,抑制作用加强,呈现出良好的量效关系。其中,对番茄早疫病病原菌的抑制最为明显,10 mg/mL质量浓度时抑制率达到73.63%;对灰葡萄孢菌的抑制强度相对降低,但菌落的扩张仍受到明显的抑制,10 mg/mL质量浓度时抑制率为54.28%;值得一提的是,提取物对尖孢镰刀菌的抑制也较为明显,2.5 mg/mL质量浓度时抑制率即达到28.98%。表3中计算出了羌活提取物对3种病原菌的毒力方程和EC50见表3,由表3可知,毒力方程的线性相关度较高。
试验所采用的3种病原菌是在农业生产中引起严重损失的重要种类,所寄生的作物涉及果树、蔬菜、豆类、茶叶、花卉等百余种,危害较为严重[21-22]。结果表明,羌活地上部位提取物对3种病原菌均能够起到较明显抑制作用,同时也表明在提取物中存在对这3种菌有抑制活性的化合物,能够为植物病虫害的生物防治提供较为有效的研究材料,在部位有机食品及无公害农产品的生产中可以尝试作为病虫害的辅助防控手段,具备较大的应用潜力和开发价值。
3 讨 论
本研究结果表明,羌活地上部位成分复杂,含有多种活性物质,其中,挥发性成分中所含多种化合物被报道具有抑菌活性;非挥发性成分包括多种药效物质,其中羌活醇质量分数相对较为丰富。以往的研究更多的注重羌活入药部位化学成分,也有部分涉及地上部位成分分析的,其实际利用的研究报道较少。在羌活的生产过程中,其地上部位被视为废弃物丢弃,其化感效应不仅可能造成其连作障碍,使农田的覆盖度下降,降低生态多样性,给生态系统造成压力,也是对植物资源的一种巨大浪费。本研究以前期的理论为基础,利用地上部分所含有的活性成分,将其利用于重要农业病原菌中,处理过程简单,对环境无污染,成本低廉,适合在农业生产中应用。研究结果为作物病虫害生物防治的提供有效的材料和理论支撑[23- 24],符合绿色和可持续农业的概念,具有巨大的开发和利用价值。
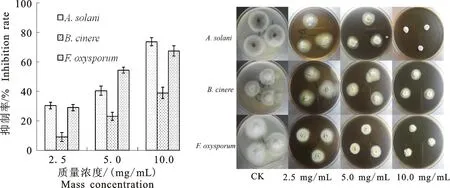
图3 不同浓度的提取物对病原真菌的抑制作用Fig.3 Inhibitions of different concentrations of extract to pathogenic fungi
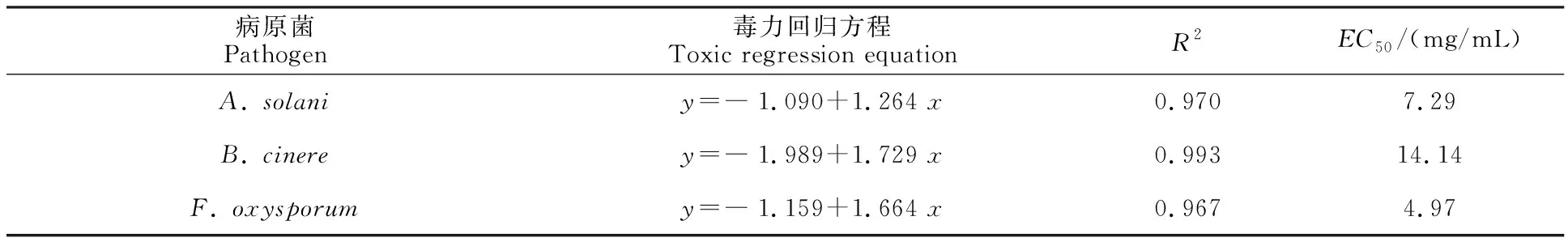
病原菌Pathogen毒力回归方程Toxic regression equationR2EC50 /(mg/mL)A. solaniy=―1.090+1.264 x0.9707.29B. cinerey=―1.989+1.729 x0.99314.14F. oxysporumy=―1.159+1.664 x0.9674.97

