小强度跑台运动对阿尔茨海默病转基因小鼠海马BDNF/ERK/CREB基因和蛋白表达的影响
赵刚 张合 刘慧莉
中国医科大学公共基础学院运动医学教研室(辽宁沈阳 110122)
阿尔茨海默病(Alzheimer’s disease,AD)是一种原发性中枢神经系统退行性疾病,以进行性学习和记忆能力减退为主要临床表现,是一种最常见的痴呆疾病,目前无特效的治疗药物和手段[1]。众多研究表明,运动能够减缓AD的发病和进展[2-4]。我们先前的研究结果证实,长期规律的小强度跑台运动改善AD转基因小鼠模型的学习和记忆损害,并同时增强海马DG区的海马长时程增强(long-term potentiation,LTP)[5]。但是有关运动防治AD的分子机制仍需深入研究。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是保护和维持神经元发育、神经突触可塑性和神经细胞活性的重要因子。研究表明,BDNF在神经元的生长、分化、突触可塑性、神经元的存活和修复过程中发挥着重要作用,并可能参与了AD的病理过程[6]。细胞外信号调节蛋白激酶(extracellular signal regulat⁃ed kinase,ERK)/cAMP反应元件结合蛋白(cAMP-re⁃sponse-element binding protein,CREB)信号途径与细胞的增殖生长密切相关,参与调解突触和神经元的可塑性及长时程记忆的形成,是学习和记忆研究中的热门领域。ERK1和ERK2是ERK的两种亚型。ERK1/2-CREB是介导BDNF细胞活性的重要途径,其主要通过促进BDNF对神经元细胞发挥抗损伤和促生长的作用。ERK1/2和CREB的磷酸化水平是反映信号通路活性的重要指标,磷酸化表达水平升高说明蛋白活性上调,同时检测蛋白表达总量可以说明磷酸化蛋白表达增高是否因为蛋白总量表达的变化所引起。
本研究通过观察5个月小强度跑台运动后BDNF、磷酸化细胞外信号调节蛋白激酶(phospho-extracellu⁃lar signal regulated protein kinase1/2,p-ERK1/2)、ERK1/2、磷酸化cAMP反应元件结合蛋白(phosphocAMP-respones-element binding protein,p-CREB)和CREB在AD转基因小鼠模型的海马中基因和蛋白的表达情况,探讨运动影响AD的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
APP/PS1双转基因小鼠(transgenic mice,Tg)及野生型小鼠(wild type mice,Wt),3月龄,由中国医科大学实验动物中心提供,生产许可证号SYXK(辽)2013-0007。自由进食和饮水,每日光照12小时。饲养室温度22~24°C,相对湿度40%~60%。实验动物饲养及取材严格遵守实验动物管理和保护的有关规定。
1.1.2 主要药品及试剂
兔抗BDNF蛋白多克隆抗体:美国Millinpore公司;兔抗p-ERK1/2蛋白单克隆抗体:美国Cell Signaling公司;兔抗ERK1/2蛋白单克隆抗体:美国Cell Signaling公司);兔抗p-CREB蛋白单克隆抗体:美国Cell Sig⁃naling公司;兔抗CREB蛋白单克隆抗体:美国Cell Sig⁃naling公司;小鼠抗GAPDH蛋白单克隆抗体:美国San⁃ta Cruz Biotechnology公司;实时定量逆转录聚合酶链反应(real-time quantitative reverse transcription-poly⁃merase chain reaction,real-time qRT-PCR)试剂盒:TaKaRa大连宝生物工程有限公司;RT-PCR引物由TaKaRa大连宝生物工程有限公司设计合成。
1.1.3 主要仪器设备
小动物跑台:淮北正华生物仪器设备有限公司;超速低温离心机:德国Heraus-Biofuge-Primo;UV-260紫外分光光度计:日本岛津;电泳仪、转印槽:中国,上海天能;BIO-RAD凝胶成像分析系统:美国BIO-RAD;ABI 7500 Real-time PCR 仪:美国 Applied Biosys⁃tems。
1.2 实验方法
1.2.1 实验动物分组
12只野生型小鼠和12只转基因小鼠随机分为4组:野生型小鼠对照组(WtC)、野生型小鼠运动组(WtE)、转基因小鼠对照组(TgC)、转基因小鼠运动组(TgE)。
1.2.2 运动方案
运动组小鼠经过2天的跑台适应性训练后,每天以5 m/min的速度开始运动5 min,后以8 m/min的速度持续运动5 min,最后以11 m/min的速度持续运动20 min,共运动30 min。每周运动5天,休息2天,持续跑台训练5个月,运动强度约为45%~55%最大摄氧量。所有动物均顺利完成运动训练。
1.2.3 样本采集
实验动物运动训练结束后进行学习和记忆行为学测试,1周后进行电生理学实验(行为学与电生理学实验结果已另文发表),数据采集后马上断头取脑,剥离海马,一半海马投入液氮速冻,-80°C保存待测;另一半海马加入Trizol,-80°C保存待测。
1.2.4 real-time qRT-PCR[7]
提取海马总RNA,逆转录合成cDNA。PCR扩增反应体系20 μl(SYBR Premix Ex TaqTMⅡ(2×)10 μl,10 μM PCR Forward Primer 0.8 μl,10 μM PCR Re⁃verse Primer 0.8 μl,cDNA 溶液 2 μl,dH2O 6.4 μl)。反应条件为预变性95°C、5 min,扩增循环共40个,95°C、15 s,55°C、15 s,72 °C、45 s。建立PCR产物溶解曲线,再变性95°C、15 s,退火60°C、1 min,缓慢加热到95°C、15 s。引物序列见表1。

表1 Real time qRT-PCR引物序列
根据标准曲线,荧光定量PCR仪自动分析并计算结果,实时PCR的结果以Ct值表示,即PCR反应指数增长初期荧光信号跨越阈值时的反应循环数。相对定量采用比较Ct法,根据等式Fold=2-△△Ct来计算WtE组、TgC组和TgE组与WtC组之间目的基因的相对表达差异。统计分析△△Ct值比较各组目的基因的表达差异。以β-actin基因为管家基因,其中△Ct值代表同一样本中目的基因和管家基因的Ct值差异,而△△Ct值表示对照组和处理组间的△Ct值差异。
1.2.5 Westernblot ting
用小剪刀剪碎冷冻的海马组织(冰上操作),按1︰4比例加入蛋白裂解液,超声粉碎,4°C裂解过夜,12000 rpm低温离心30 min,取上清,考马斯亮蓝法测定蛋白浓度,每管50 μg蛋白分装,-80°C冻存。
SDS聚丙烯酰胺凝胶电泳分离蛋白样品,4°C转膜过夜,5%BSA溶液室温封闭,一抗4°C孵育过夜,二抗室温孵育2 h,ECL发光。BIO-RAD凝胶电泳图像分析仪进行采图,Quantity One软件包分析。
1.3 统计学分析
采用SAS8.1统计软件进行统计分析。实验数据均以x±s表示,组间比较采用双因素方差分析。P<0.05表示差异具有显著性。
2 结果
2.1 real-time qRT-PCR 结果
2.1.1 各组小鼠海F mRNA表达
TgC组小鼠BDNF mRNA表达水平高于WtC组,是WtC组的1.64倍,差异具有显著性(P<0.05)。WtE组小鼠BDNF mRNA表达水平高于WtC组,是WtC组的1.60倍,差异具有显著性(P<0.05)。TgE组小鼠BDNF mRNA表达水平明显低于TgC组,差异具有显著性(P<0.05)。见表2。

表2 各组小鼠海马组织中BDNF mRNA的表达水平
2.1.2 各组小鼠海马ERK 1/ 2 mRNA的表达
TgC组小鼠海马组织中ERK1和ERK2 mRNA表达水平明显高于WtC组,差异均具有显著性(P<0.05)。WtE组小鼠ERK1/2的基因表达水平明显高于WtC组,差异具有显著性(P<0.05)。与TgC组比较,TgE组小鼠ERK1/2的基因表达水平明显减少,差异均具有显著性(P<0.05)。见表3。
2.1.3 各组小鼠海马CREB mRNA的表达
TgC组小鼠CREB mRNA表达水平明显高于WtC组,差异具有显著性(P<0.05)。WtE组小鼠CREB mRNA的表达水平明显高于WtC组,差异具有显著性(P<0.05)。TgE组小鼠CREB mRNA的表达水平明显低于TgC组,差异具有显著性(P<0.05)。见表4。

表3 各组小鼠海马组织中ERK1和ERK2 mRNA的表达水平

表4 各组小鼠海马组织中CREB mRNA的表达水平
2.2 Western blotting ting结果
2.2.1 各组小鼠海马BDNFBDNF蛋白表达
Western blotting结果表明,TgC组小鼠海马组织BDNF蛋白表达明显高于WtC组,差异具有显著性(P<0.05);WtE组BDNF蛋白表达明显高于WtC组,差异具有显著性(P<0.05);与TgC组比较,TgE组BDNF蛋白表达明显下降,差异具有显著性(P<0.05)。见图1。

图1 各组小鼠海马BDNF蛋白表达水平比较
2.2.2 各组小鼠海马p-ERKp-ERK1 1//2 2及ERKERK1 1//2 2蛋白表达
Western blotting结果显示,TgC组ERK1/2蛋白表达明显高于WtC组(P<0.05);WtE组ERK1/2蛋白表达明显高于 WtC组(P<0.05);与 TgC组比较,TgE组ERK1/2蛋白表达明显下降(P<0.05)。TgC组p-ERK1/2蛋白表达明显低于WtC组(P<0.05);与各自对照组比较,WtE组和TgE组p-ERK1/2蛋白表达均明显升高(P<0.05)。见图2。
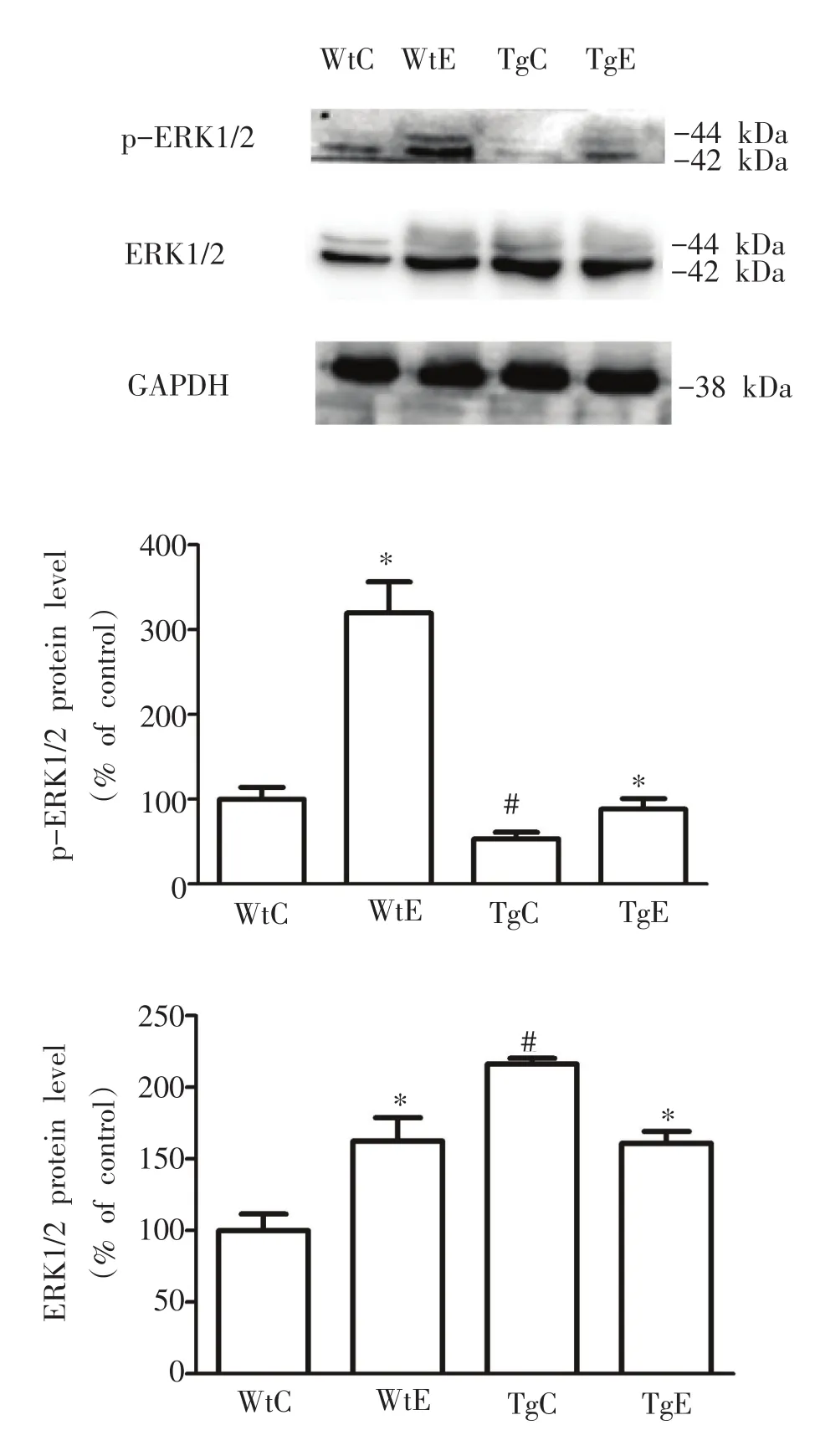
图2 各组小鼠海马p-ERK1/2、ERK1/2蛋白表达水平比较
2.2.3 各组小鼠海马p-CREB-CREB及CREBCREB蛋白表达
TgC组CREB蛋白表达明显高于WtC组(P<0.05);WtE组CREB蛋白表达明显高于WtC组(P<0.05);与TgC组比较,TgE组CREB蛋白表达明显下降(P<0.05)。TgC组p-CREB蛋白表达明显低于WtC组(P<0.05);与各自对照组比较,WtE组和TgE组p-CREB蛋白表达均明显升高(P<0.05)。见图3。

图3 各组小鼠海马p-CREB、CREB蛋白表达水平的比较
3 讨论
BDNF主要分布于大脑皮质和海马,是中枢神经系统中与学习和记忆有关的突触再生和突触可塑性机制的重要调节因子。已有研究证实,BDNF参与调节LTP[8]。BDNF和其受体酪氨酸激酶B(tyrosine kinase B,TrkB)结合后能诱导海马颗粒细胞持续产生LTP。研究表明,BDNF参与调节运动对脑的有益作用[9-11]。老年AD转基因小鼠海马组织中BDNF蛋白表达下降,跑台运动使其上调[12]。因此我们假设,AD转基因模型可能伴有BDNF表达下调,小强度跑台运动可能通过增加其表达减轻AD模型的学习和记忆损害。但是,在本研究中我们却发现,8月龄AD转基因小鼠BDNF基因和蛋白的表达水平高于野生型小鼠。实验动物的年龄和疾病阶段不同也许能够部分解释这个结果。BDNF可能随着AD疾病的发展有不同变化,在AD早期,BDNF水平可能会增加,但AD晚期出现BDNF水平下降;月龄较小时AD神经元变 性及退化可能激发代偿机制使BDNF过度表达,随着神经元功能的不断降低,BDNF的表达最终降低。以往研究表明,虽然多数AD患者体内BDNF表达下调,但也有轻微认知障碍和部分AD患者BDNF表达有所上升[13]。大鼠模型黑质-纹状体通路上的6-羟多巴胺合成出现障碍,在损伤的4个星期后,青龄组大鼠受损纹状体上BDNF蛋白出现显著上调,但是在老龄组中没有变化[14]。可见8月龄AD小鼠处于AD发病早期,更容易诱导BDNF的基因和蛋白代偿表达。我们同时发现,运动引起野生型小鼠BDNF基因和蛋白表达上调,APP/PS1转基因小鼠BDNF基因和蛋白表达下调。以往研究证实,虽然野生型小鼠和转基因小鼠都有认知能力提高和LTP增强,但是野生型小鼠伴有海马BDNF mRNA表达增加,而转基因小鼠表达减少[15]。这个结果并不能完全说明BDNF与运动改善转基因小鼠认知能力损害和LTP毫无关系。BDNF的突触作用与其受体TrkB的活性有关,如果TrkB的表达和活性下降,即使BDNF表达增加,也无法增强突触的传递效能。我们应该进一步研究TrkB,也许TrkB是运动改善青龄AD模型认知损害的另一分子标记。
BDNF与其受体TrkB结合,TrkB获得催化活性,激活自身酪氨酸激酶活性,导致自身磷酸化,活化后的受体能够激发信号转导,触发细胞内信号级联,包括其下游的信号分子ERK和CREB,从而增加突触联系,提高学习和记忆能力。ERK是学习和记忆形成信号转导通路中重要的信号分子,是一种丝氨酸/苏氨酸蛋白激酶,包括ERK1和ERK2两种亚型。在AD大鼠海马中,ERK蛋白表达显著降低,由高频刺激引起的LTP幅度降低,Morris水迷宫测试表明这些大鼠的空间学习和记忆能力减退[16]。CREB的激活是MAPK信号转导途径的关键步骤,它能启动蛋白的表达,参与长持续LTP和长时记忆的维持。目前己知受p-CREB调节的下游靶基因至少有100多个,因而认为CREB可能在学习记忆中起着“开关”作用。CREB的异常表达及活性变化参与了阿尔茨海默病的病理生理过程,并与神经保护机制有关[17]。研究表明,跑轮训练提高大鼠学习、记忆能力与运动诱导的CREB表达升高有关[18,19]。Vaynman等研究发现,运动使海马的可塑性提高可能与运动诱导CREB mRNA的表达有关[20]。我们前期的研究发现[5],此次检测的AD转基因小鼠出现学习和记忆功能下降并伴有LTP减弱,小强度跑台运动对其有改善作用。本研究发现,AD转基因小鼠ERK1/2 mRNA和蛋白表达水平上调,而p-ERK1/2蛋白表达水平下降,长期小强度跑台运动使AD模型p-ERK1/2蛋白表达水平上调。CREB基因和蛋白表达水平也发现相同趋势。结果提示,AD发病早期,动物模型月龄较小,ERK1/2、CREB的基因和蛋白表达水平代偿性增加,但磷酸化水平下降,活性下调;小强度跑台运动通过提高ERK1/2和CREB的磷酸化水平,上调其活性,使代偿作用减低。以往研究也证明,ERK磷酸化水平的调节与学习和记忆关系更为密切。经过水迷宫训练后的大鼠,海马CA1/CA2区的ERK被激活,使用其上游激酶的抑制剂PD 098059使磷酸化ERK蛋白含量降低,出现长期空间记忆的形成受损[21]。Gooney等研究发现,在进行Morris水迷宫行为训练和保持LTP的大鼠,其齿状回BDNF释放增加,ERK磷酸化增加,认为LTP的形成与ERK的激活有关[22]。综上所述,我们推测,此动物模型可能存在TrkB的磷酸化水平下降,长期跑台运动提高TrkB活性,进而通过激活ERK1/2-CREB途径调节突触功能和学习、记忆功能。
4 结论
小强度跑台运动减少8月龄APP/PS1转基因小鼠BDNF代偿性合成增加,运动改善APP/PS1转基因小鼠学习和记忆功能并不依赖BDNF的表达增加,可能与TrkB的活性变化有关。8月龄APP/PS1转基因小鼠ERK1/2、CREB基因和蛋白表达上调,但其活性形式即磷酸化水平下调,长期跑台运动训练使AD转基因小鼠模型ERK1/2、CREB基因和蛋白表达水平下调,但其磷酸化蛋白表达水平上调,因此认为,运动改善APP/PS1转基因小鼠学习和记忆能力损害、提供LTP效能与ERK/CREB信号转导通路有关。学习和记忆的分子生物学机制十分复杂,而运动影响学习和记忆能力提高与多条信号转导通路的激活有关,要想全面阐述运动对AD模型的神经保护作用机制,还需要进行更深入的研究。

