补肾活血方调控膝骨性关节炎大鼠软骨下骨的作用机制研究
叶大林 谢平金 魏合伟 柴生颋 刘海全 梁桂洪
1.广州中医药大学第三附属医院骨科,广东 广州 510104 2.广州中医药大学,广东 广州 510405
膝骨性关节炎(knee osteoarthritis,KOA)是在力学因素和生物学因素的共同作用下导致软骨细胞、细胞外基质、软骨下基质三者降解和合成失衡的一种慢性、进展性关节疾病[1]。其病理以关节软骨退变、软骨下骨硬化与骨赘形成为特点[2]。KOA与多种因素有关,其发病率也逐渐升高,所造成的关节功能障碍严重影响了生活质量,而其病因和发病机制尚未完全明确。本研究通过切除实验大鼠双侧膝关节的前交叉韧带、内侧副韧带及内侧半月板建立KOA大鼠模型,探讨补肾活血方调控BMP-2及Smad-1/5在KOA软骨下骨骨重建过程的变化水平,以进一步研究补肾活血方在KOA软骨下骨骨重建过程中的作用机制,为其临床应用提供参考价值及理论依据。
1 材料和方法
1.1 材料
1.1.1动物:SPF 级健康6月龄雌性SD大鼠24只,体重180~220 g,由广州中医药大学实验动物中心提供。
1.1.2主要试剂:BMP-2试剂盒、Smad-1/5试剂盒购自广州市齐云生物技术有限公司。
1.1.3药物制备: 补肾活血方(桑寄生30 g,鸡血藤30 g,阿胶(烊化)20 g,补骨脂20 g,怀牛膝20 g,龟板30 g,丹参10 g,熟地黄30 g,仙鹤草10 g,地龙15 g,当归10 g,黄芪30 g,白芍30 g),加水浸泡30 min后,文火煎煮1 h,过滤取出药汁,加水复煎0.5 h,合并2次滤液,取上清液加热浓缩,其提取物按照人与大鼠体表面积折算,含生药量0.8 377 g/mL(由广州中医药大学附属骨伤科医院制剂室提供)。
1.2 方法
1.2.1分组与造模: 将动物随机分为假手术组、模型对照组和治疗组,每组8只,用10%水合氯醛麻醉大鼠后,参考改良Hulth造模法[3],模型对照组和治疗组均切断双侧膝关节的前交叉韧带、内侧副韧带及内侧半月板,彻底止血,逐层缝合;假手术组切开双膝关节处皮肤,不切断韧带。术后分笼饲养,术后连续4 d给予青霉素溶液 4 万U/d肌注。
1.2.2干预方法:术后第 4 周,开始灌胃给药治疗,治疗组灌服补肾活血方2 mL,模型对照组及假手术组灌服等量的生理盐水,每天1次,连续灌胃8周。
1.2.3检测指标:(1)OA软骨下骨骨组织内BMP2、Smad-1/5的动态变化检测:分别于给药后4、8周随机选取3只大鼠右侧胫骨,置于10%多聚甲醛固定、脱钙、脱水、透明、浸蜡、包埋,制作成骨长轴方向切片,采用SABC法免疫组化染色,测量BMP-2及Smad-l/5不同时间点的表达水平。每张切片随机选5个视野(x400),用倒置显微镜(Olympus IX70)观察软骨下骨组织并拍照,采用MOTC6.0图像分析软件(厦门麦克奥迪有限公司)对每张照片进行BMP-2及Smad-l/5表达的阳性细胞计数及进行灰度值测量。测量前需进行:①空间定标:将刻有已知直径圆圈的标尺,在400倍镜下采集150I|tm圆圈图像,以备图像分析时空间定标时使用。②亮度定标:采用SMR103黑白标准密度片(中国计量科学研究院),在400倍镜下连续采集21个级数密度图象,以备图像分析时亮度定标使用。每张、每组切片取其平均值,试验以PBS替代一抗作阴性对照。阳性判断标准:当细胞膜,胞浆和或细胞核出现棕黄色阳性物质为阳性细胞。用平均灰度值表示染色强弱。(2)软骨下骨骨组织计量检测:于灌胃8周后,处死大鼠,取大鼠左侧胫骨,进行固定、脱水、不脱钙骨硬组织包埋。包埋块用硬组织切片机分别切下9 μm切片,直接封片,采用HMIAS22000图像分析系统(广州中医药大学国家重点实验室)行软骨下骨组织形态计量分析。每例标本3张,每张随机取6个视野,测量后取平均值。测量参数包括:①骨体积(BV/TV):测量范围内骨小梁体积占全部骨组织体积的百分比,反映骨小梁分布密度;②骨小梁厚度(Tb.Th);(2000/1.199)×(骨小梁面积/骨小梁周长);③骨小梁密度(Tb.N):(1.199/2)×(骨小梁周长/骨小梁面积);④骨小梁分离度(Tb.Sp):(2000/1.199)×([总面积-骨小梁面积] /骨小梁周长)。
1.3 统计学处理
2 结果
2.1 软骨下骨骨组织计量检测
假手术组、治疗组在BV/TV、Tb.N上明显低于模型对照组(P<0.05),在Tb.Th、Tb.Sp上明显高于模型对照组(P<0.05)。假手术组与治疗组Tb.N、Tb.Th、Tb.Sp上比较,差异有统计学意义(P<0.05)。见表1。

表1 各组软骨下骨组织计量学分析比较Table 1 Comparison of bone histomorphometry of the subchondral bone among the
注:与假手术组对比:▲P<0.05;与模型对照组对比:△P<0.05。
2.2 OA软骨下骨骨组织内BMP2、Smad-1/5的变化
给药后4、8周各组BMP-2 图像变化结果,见图1~6。
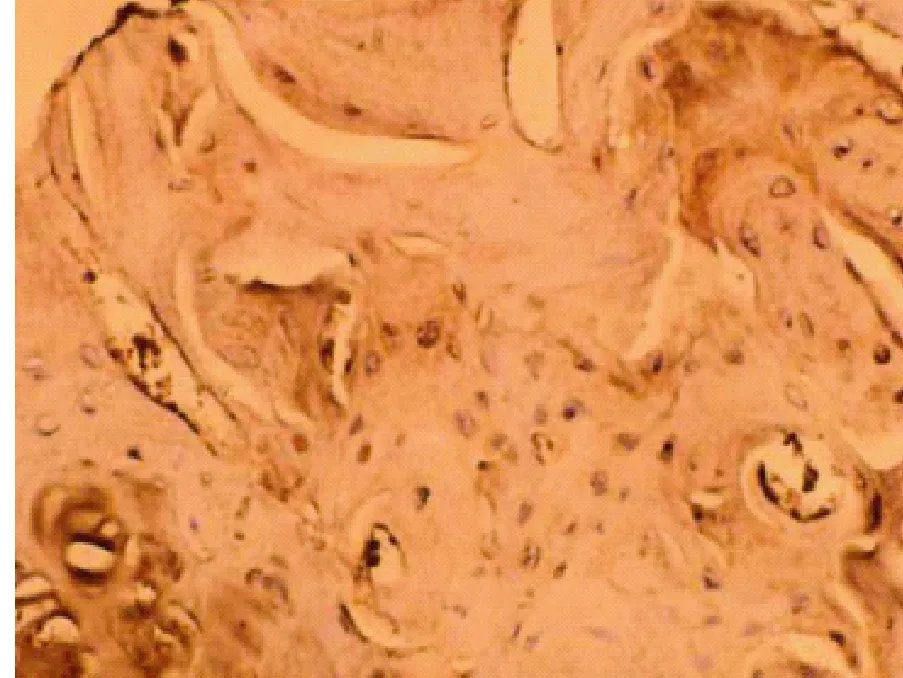
图1 给药后4周模型对照组胫骨干骺端BMP-2(免疫组化染色,×400)Fig.1 Immunohistological staining of BMP-2 in the epiphysis of the tibia in the model control group after 4-week drug administration (×400)

图2 给药后4周假手术组胫骨干骺端BMP-2(免疫组化染色,×400)Fig.2 Immunohistological staining of BMP-2 in the epiphysis of the tibia in the sham operation group after 4-week drug administration (×400)

图3 给药后4周治疗组胫骨干骺端BMP-2(免疫组化染色,×400)Fig.3 Immunohistological staining of BMP-2 in the epiphysis of the tibia in the treatment group after 4-week drug administration (×400)

图4 给药后8周模型对照组胫骨干骺端BMP-2(免疫组化染色,×400)Fig.4 Immunohistological staining of BMP-2 in the epiphysis of the tibia in the model control group after 8-week drug administration (×400)

图5 给药后8周假手术组胫骨干骺端BMP-2(免疫组化染色,×400)Fig.5 Immunohistological staining of BMP-2 in the epiphysis of the tibia in the sham operation group after 8-week drug administration (×400)
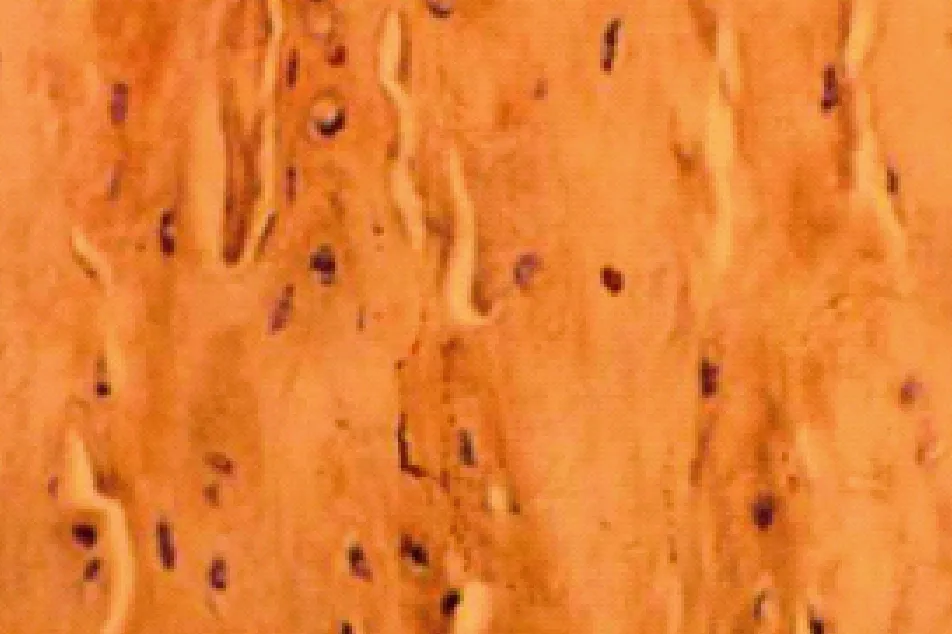
图6 给药后8周治疗组胫骨干骺端BMP-2(免疫组化染色,×400)Fig.6 Immunohistological staining of BMP-2 in the epiphysis of the tibia in the treatment group after 8-week drug administration (×400)
由图1-6,可见用药4周,治疗组BMP-2 阳性细胞个数较模型对照组增加,较假手术组有所减少;用药8周,治疗组较模型对照组显著增加。
给药后4、8周各组Smad-1/5 图像变化结果,见图7~12。

图7 给药后4周模型对照组胫骨干骺端Smad-1/5(免疫组化染色,×400)Fig.7 Immunohistological staining of Smad-1/5 in the epiphysis of the tibia in the model control group after 4-week drug administration (×400)

图8 给药后4周假手术组胫骨干骺端Smad-1/5(免疫组化染色,×400)Fig.8 Immunohistological staining of Smad-1/5 in the epiphysis of the tibia in the sham operation group after 4-week drug administration (×400)

图9 给药后4周治疗组胫骨干骺端Smad-1/5(免疫组化染色,×400)Fig.9 Immunohistological staining of Smad-1/5 in the epiphysis of the tibia in the treatment group after 4-week drug administration (×400)

图10 给药后8周模型对照组胫骨干骺端Smad-1/5(免疫组化染色,×400)Fig.10 Immunohistological staining of Smad-1/5 in the epiphysis of the tibia in the model control group after 8-week drug administration (×400)

图11 给药后8周假手术组胫骨干骺端Smad-1/5(免疫组化染色,×400)Fig.11 Immunohistological staining of Smad-1/5 in the epiphysis of the tibia in the sham operation group after 8-week drug administration (×400)

图12 给药后8周治疗组胫骨干骺端Smad-1/5(免疫组化染色,×400)Fig.12 Immunohistological staining of Smad-1/5 in the epiphysis of the tibia in the treatment group after 4-week drug administration (×400)
由图7~12,用药4周,治疗组Smad-1/5阳性细胞个数较模型对照组增加,较假手术组有所减少,差异无统计学意义;用药8周,治疗组较模型对照组显著增加。
2.3 不同时段各组BMP-2 灰度值及阳性细胞个数变化结果
用药4周,治疗组BMP-2 灰度值及阳性细胞个数较模型对照组增加(P<0.05),较假手术组有所减少,差异无统计学意义(P>0.05);用药8周,治疗组较模型对照组显著增加(P<0.05),较假手术组增加(P<0.05)。见表2。

表2 各组大鼠胫骨上端软骨下骨BMP-2灰度值及阳性细胞个数
注:与假手术组对比:▲P<0.05;与模型对照组对比:△P<0.05; 与治疗后4周对比:*P<0.05。
2.4 不同时段各组Smad-1/5灰度值及阳性细胞个数变化结果
用药4周,治疗组Smad-1/5灰度值及阳性细胞个数较模型对照组增加(P<0.05),较假手术组有所减少,差异无统计学意义(P>0.05);用药8周,治疗组较模型对照组显著增加(P<0.05),较假手术组增加(P<0.05)。见表3。

表3 各组大鼠胫骨上端软骨下骨Smad-1/5灰度值及阳性细胞个数
注:与假手术组对比,▲P<0.05;与模型对照组对比,△P<0.05;与治疗后4周对比:*P<0.05。
3 讨论
膝骨关节炎(knee osteoarthritis,KOA),是一种以膝关节软骨的变性、破坏及关节周围骨质增生为特征的慢性关节病[1],常见于中老年人,临床上症状多表现为膝关节局部疼痛、晨僵、肿胀、活动受限,严重者可出现关节的畸形,并最终可导致残疾的风险。中医学认为该病当属“膝痹”范畴,其病机为“本虚标实”,而肾虚血瘀则是发病的关键因素。本研究中,采用改良Hulth造模法复制膝骨性关节炎,即通过切除6月龄雌性老年大鼠的双侧膝关节前交叉韧带、内侧副韧带及内侧半月板,导致膝关节的持续力学失稳态,进而诱发骨关节炎,有利于临床与基础研究相互结合而更加明确地阐述KOA的病理及作用机制。
骨吸收的增加和骨重建的加快为早期KOA关节软骨下骨变化主要表现[4],这种骨吸收增加可导致后期软骨下骨骨质硬化和材料学性质改变,因此越来越多研究重视如何控制其软骨下骨骨重建速度及改变软骨下骨硬度。Felson等于1972年初次提出关节退变的发病机制可能起始于软骨下骨[5]。骨组织持续不断地重复着陈旧骨清除及新骨形成的骨重建过程,骨重建过程无论在细胞学还是组织学水平都被认为是骨吸收与骨形成过程的偶联,一但发生失衡,即可导致骨量与骨结构的变化。在细胞水平,破骨细胞和成骨细胞的协同调控是骨重建中两个最重要的过程[6]。在分子水平,多条骨重建调控途径获得证据被认为参与了KOA软骨下骨骨重建的调控。骨形态发生蛋白(bone morphogenetic protein,BMP)途径是主要参与调控骨形成过程的重要途径之一。BMPs是一组多功能参与软骨再生的主要软骨形成生长因子,具有类似结构的高度保守的功能蛋白,在其羧基端部分包括特征性的7个高度保守的半胱氨酸,属于转化生长因子TGF-β超家族成员[7]。有研究[8]表明,TGF-β1和BMP2诱导的人关节软骨细胞与骨关节炎关节软骨细胞(AC)的浅表和深层亚群具有不同的代谢特征。BMP2不仅诱导软骨形成,而且在异位骨/软骨形成过程中促进软骨内骨化,BMP2可以在同一系统内自发诱导软骨形成分化,成骨分化和软骨内骨形成,目前亦有相关研究用于软骨组织工程以调节软骨形成[9]。有研究[10-11]表明,细胞外信号调节激酶(ERKs),c-Jun N-末端蛋白激酶(JNK)能通过介导的BMP2表达和Smad-1/5/8磷酸化增强成骨细胞分化。BMPs功能十分广泛,其发挥生物学作用主要通过信号转导蛋白 (drosophila mothers against decapentaplegic proteins,Smads)依赖性和非Smads 依赖性两条途径实现[12-13]。已有研究表明,抑制BMP2活性引起Smadl表达上调[14];Runt相关转录因子2(runt-relatedtranscription factor 2,Runx2)可以与Smadl和Smad5相互作用而增强一些成骨细胞特异性基因的表达[15];体内外研究已经确定BMP-Smad信号通路能调控成骨细胞生命周期的各个方面,包括骨髓间充质干细胞(MSCs)向成骨细胞分化、骨原细胞的扩增、成骨细胞矿化的活力以及其与破骨细胞的偶联[16-17]。由此可知,骨吸收/骨形成偶联发生失衡,即可导致骨量与骨结构的变化,可能与BMP-Smad信号通路的功能异常有关。Hyuck等[18]研究发现,通过刺激Smad-1/5/8和p38途径增强BMP2的体内成骨能力,被认为是骨疾病的治疗策略之一。
肾虚血瘀则是KOA发病的关键因素,补肾活血方作为我院的经验方,具有补肾壮骨、健脾益气、活血通络的功效,在临床治疗KOA上取得一定的疗效。前期基础研究表明,补肾活血中药治疗KOA的疗效和止痛效果均优于塞来昔布,且在改善患者的膝关节功能和安全性方面与塞来昔布相当[19];补肾活血方能抑制骨性关节炎关节软骨中MMP-1 的表达及降低关节液中的PGE2水平,促进软骨细胞生长,以减缓骨性关节炎[20]。本实验结果表明,补肾活血方通过调控BMP-2及Smad-1/5在KOA大鼠软骨下骨骨重建过程的表达水平,使BMP-2及Smad-1/5的表达水平提高;使软骨下骨组织BV/TV、Tb.N、Tb.Th、Tb.Sp水平重新调节以趋向平衡。经造模后的大鼠BV/TV、Tb.Th水平升高,这可能在OA早期阶段,受到破坏的骨质,软骨下骨破骨细胞的活跃,骨小梁破坏、吸收,然后启动软骨下骨的骨重塑过程,导致了软骨下骨骨代谢增强,骨小梁的进一步增生和增厚。由此表明补肾活血方可能通过调控BMP-2及Smad-1/5水平,从而调控BMP-Smad信号通路使其骨吸收/骨形成偶联趋向平衡。补肾活血方可以改善OA软骨下骨异常代谢,从而起到预防和治疗OA的作用。本研究为补肾活血方在防治OA上提供了一定的实验依据。虽然目前中医药对OA作用机制有了一定深入的研究,也使得中医药治疗骨关节炎的作用机制有一定的科学依据,对其的治病思路和用药指导有一定的帮助,而且在越来越多的证据表明KOA与骨质疏松的发病及进展中相互联系,而软骨下骨在其中起着非常重要的作用,故科学研究不应只局限在关节软骨方面,应多重视软骨下骨的研究,其可能为治疗KOA寻找新靶点提供的突破口,为补肾活血方治疗KOA提供实验依据和新的指导理论。

