神经内镜微创术联合置管吸引术治疗脑出血的疗效分析
张杰 王恩任 张列 刘海波
脑出血是临床中较为常见的神经外科急危重疾病,其发病机制复杂,患者预后质量较差,发病率及病死率居高不下,严重威胁患者生命健康安全[1]。近年来伴随医疗技术的发展,微创手术具有安全性高、操作简便的优点,受到人们的关注[2]。对脑出血患者采用微创手术进行治疗时可有效降低颅内血压并改善外周神经系统[3]。神经内镜微创术联合置管吸引术能够通过十字型切口将硬脑膜切开,通过防止引流管,对于患者本身具有较小的创伤,有助于老年脑出血患者神经功能的恢复,以及生活质量的提高[4,5]。但神经内镜微创术联合使用置管吸引术的研究仍鲜有报道。本文围绕神经内镜微创术联合置管吸引术治疗脑出血进行研究,对术后疗效、并发症发生情况、术后24 h血肿清除率、NHSS评分、血清炎性因子进行分析,以期脑出血患者得到较好的临床疗效。
资料与方法
一、纳入与排除标准
选取成都医学院第一附属医院神经外科自2015年1月至2018年1月收治的100例脑出血患者。 纳入标准:(1)GCS 评分 4~12 分;(2)高血压脑出血,年龄≤75岁;(3)可耐受气管插管全麻手术;(4)幕下血肿量≥10 mL或幕上血肿量30~80 mL[6]。排除标准:(1)脑血管畸形或动脉瘤激发脑出血;(2)脑干出血;(3)入院病情危重,3 d 内死亡;(4)脑疝,双侧瞳孔散大;(5)主动申请退出本研究。
二、研究分组
按照随机信封法将符合纳入与排除标准的患者分为观察组与对照组,每组50例。观察组男性33例,女性 17例,年龄范围 49~75岁,年龄(58.83±4.92)岁,入院时 GCS 评分 5~8 分,平均(6.90±0.81)分,手术至发病时间3.74~8.92 h,平均发病时间(5.73±0.83)h;对照组男性 32 例,女性 18 例,年龄范围 48~74 岁,年龄(58.91±4.67)岁,入院时 GCS 评分5~8 分,平均(6.83±0.74)分,手术至发病时间 3.50~9.22 h,平均(5.88±0.91)h。2组患者一般资料比较,差异无统计学意义(P>0.05)。所有入院患者及家属均签署患者知情同意书,研究获得伦理委员会审议批准。
三、治疗方法
对照组患者采用神经内镜微创技术治疗,观察组采用神经内镜微创术联合置管吸引术治疗。对照组患者采用纵行切口4.0~5.0 cm,后铣下2.5 cm左右直径大小的骨瓣。十字切开硬膜后采用电灼脑表面,使用透明穿刺导引器对脑血肿进行穿刺,接入透明套筒并固定套筒,使用0°内镜进入透明套筒清除脑血肿。观察组在此基础上将引流管置入出血部位,抽吸10 mL,出血后对局部头皮进行缝合并固定引流管,外界封闭式引流装置,持续引流。
四、观察指标
(1)临床疗效:对患者临床疗效进行评估时包括治愈、有效及无效。治愈:患者意识清醒,肢体肌力≥Ⅲ级,可正常生活;有效:意识稍有模糊,肌力<Ⅲ级;无效:患者死亡或意识完全消失。治疗总有效率=(治愈例数+有效例数)/总例数×100%;(2)血肿清除率:采用CT检测术前及术后24 h血肿量,血肿清除率=(血肿量术前-血肿量术后)/血肿量术前×100%。(3)术后并发症:观察2组患者术后并发症,包括再次出血、电解质紊乱和颅内感染等。(4)美国国立卫生研究院卒中量表(the National Institutes of Health stroke scale,NIHSS)评分:治疗前及治疗后 30 d时采用NIHSS对患者神经功能进行评估,神经功能越高分数越低[7]。(5)血清炎性因子水平:治疗前及治疗后3个月时采集空腹静脉血并采用ELISA法检测血中超敏C反应蛋白 (hypersensitive C-reactive protein,hs-CRP)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)及白细胞介素 6(interleukin 6,IL-6)等炎性因子水平。
五、统计学分析
采用SPSS20.0统计学软件进行数据分析,NIHSS评分和炎性因子水平以均数±标准差(±s)表示,组间比较采用独立样本t检验;治疗有效率、并发症发生情况及术后24 h血肿清除率以率 (%)表示,采用χ2检验。以P<0.05为差异具有统计学意义。
结 果
一、患者治疗半年总有效率比较
对比2组患者半年总有效率显示,观察组显著高于对照组,差异具有统计学意义(P<0.05),详细信息见表1。
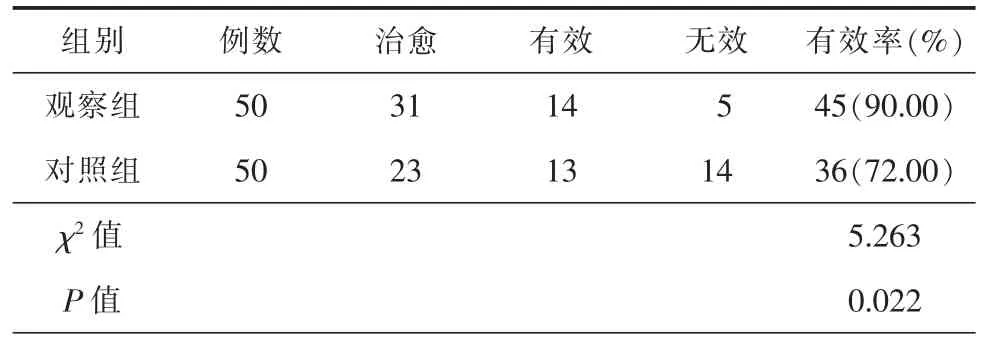
表1 2组患者治疗半年总有效率比较
二、2组患者术后并发症发生率及术后24 h血肿清除率比较
观察组患者24 h血肿清除率高于对照组,且再次出血及电解质紊乱发生率低于对照组,差异均具有统计学意义(P<0.05)。但2组患者颅内感染发生率比较,差异无统计学意义(P>0.05),详细信息见表2。
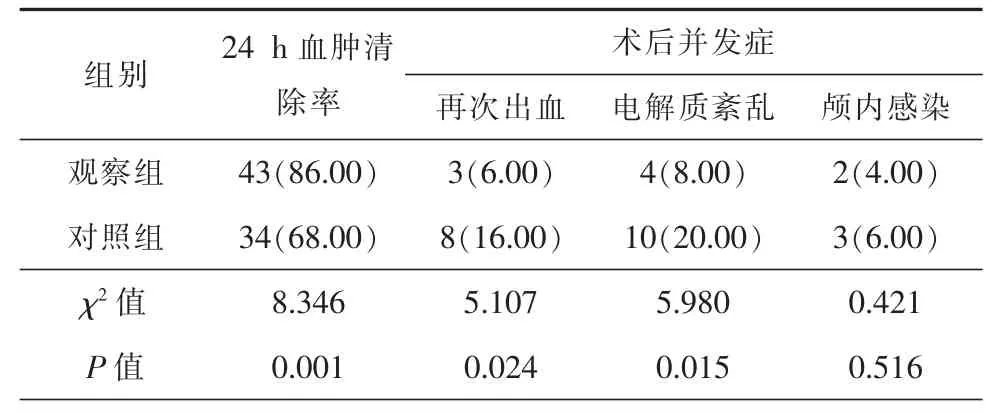
表2 2组患者术后并发症发生率及术后24 h血肿清除率比较[例(%)]
三、2组患者治疗前后NIHSS评分比较
2组治疗前NIHSS评分比较,差异无统计学意义(P<0.05);同组治疗前后 NIHSS评分比较,差异具有统计学意义(P<0.05);观察组治疗后NIHSS评分低于对照组,差异具有统计学意义(P<0.05)。详细信息见表3。
四、2组患者治疗前后血清炎性因子水平比较
治疗前2组患者TNF-α、Hs-CRP及IL-6比较,差异无统计学意义(P>0.05),治疗后 2 组 TNF-α、Hs-CRP及IL-6水平均较治疗前显著降低,且治疗后观察组TNF-α、Hs-CRP及IL-6水平显著低于对照组,差异均具有统计学意义(P<0.05),详细信息见表4。
表3 2组患者治疗前后NIHSS评分比较(±s,分)
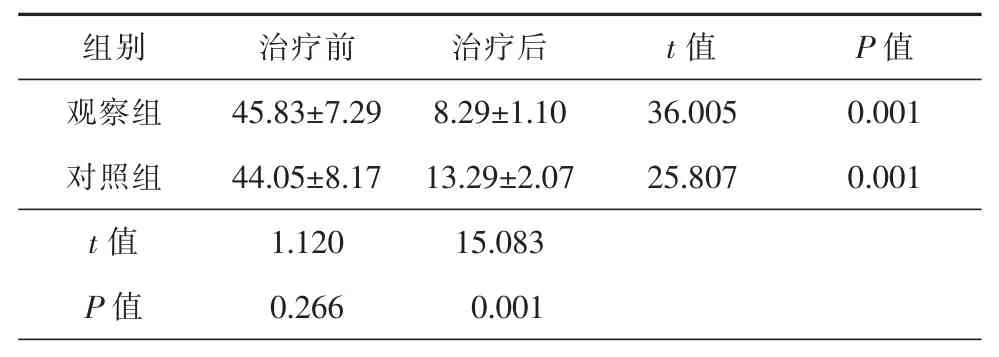
表3 2组患者治疗前后NIHSS评分比较(±s,分)
?
表4 2组患者治疗前后血清炎性因子水平比较(±s,ng/L)
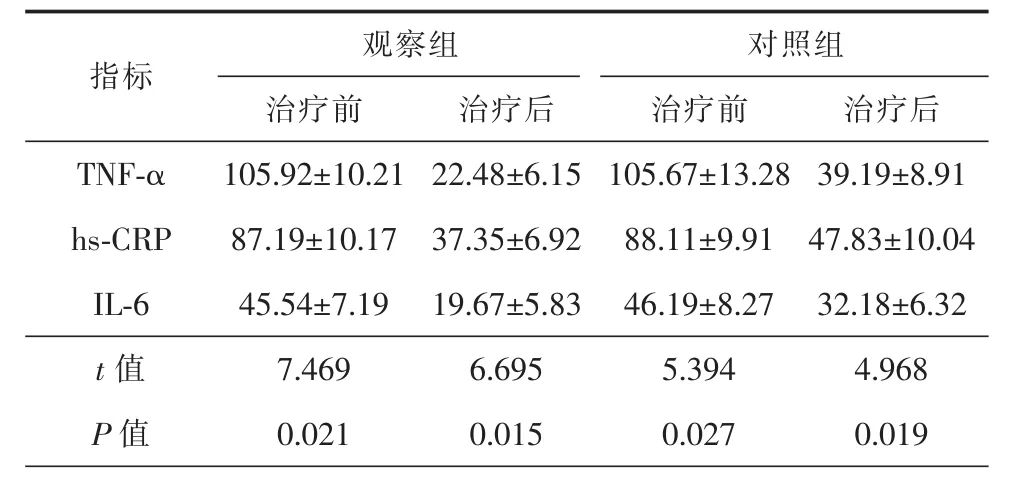
表4 2组患者治疗前后血清炎性因子水平比较(±s,ng/L)
TNF-α:肿瘤坏死因子-α;hs-CRP:超敏 C 反应蛋白;IL-6:白细胞介素 6
?
讨 论
脑出血是临床比较常见的急性疾病,此疾病中老年患者多发,且患者多合并有其他慢性疾病,如高血压。患者发生的脑出血疾病为非外伤性脑部实质中的血管发生破裂致使血管出血压迫脑部实质部位从而导致疾病发生。此疾病的病因多为颅内血管畸形、脑动脉硬化、高血压等。患者发病之前多会有情绪激动等诱因,此疾病发展迅速,死亡率很高。目前临床中常采用开颅血肿清除术进行治疗,手术多在侧裂区,脑肿胀病情较轻情况下可采用分开侧裂通过岛叶进入血肿腔内[8]。但有学者指出,一旦脑组织出现肿胀只能在富血管颞叶皮层造瘘进入[9]。手术打击大、手术时间长,牵拉脑组织导致脑组织继发水肿,频繁电灼止血造成病灶脑组织及周围毗连组织和血管损伤,对患者神经功能及意识状态恢复造成严重影响[10]。有研究指出患者恢复良好状态下仍需手术修补颅骨[11]。采用立体定向血肿穿刺术治疗时虽然创伤性较低,血肿清除率低。神经内镜有照明光源,进镜深浅度灵活控制,观察范围广,弥补传统显微镜可能存在观察死角的缺点,更好观察并识别血肿病变区及病变毗连区结构及血管,具有明显的优势[12,13]。有研究结果指出,在血肿脑损伤发生及发展过程中起到重要作用,约58%脑出血患者为基底节出血[14]。若不及时治疗则可能导致患者病情进展,颅内动脉破裂导致血肿形成,出现占位效应,加重水肿并导致脑功能出现不可逆性损害[15]。目前临床中对早期血肿患者进行治疗时及时清除,积极解除压迫,降低颅内压,降低神经毒性,恢复神经功能,改善脑灌注及预后质量,有助于降低病死率[16]。传统开颅清除血肿具有创伤大的缺点,因而导致其在临床应用中存在一定局限性。
本研究应用穿刺引导器穿刺血肿腔,后利用透明套筒将血肿进行清除。一般情况下,透明套筒前方存斜坡,清除血肿过程中在不牵拉脑组织或改变位置情况下旋转套筒尽可能将血肿自行挤入术野,最大程度地避免脑组织牵拉损伤[17,18]。此外,由于以额中回无血管区作为穿刺入路,通道出血量较少,相较于开路手术有明显优势[19]。采用神经内镜微创手术治疗时将穿刺通路脑组织推开,避免对患者脑组织造成大范围损伤,并可最大程度地清除血肿减轻对正常脑组织的损伤,加速患者意识恢复并降低并发症发生率[20]。脑出血治疗后并发症发生情况是影响患者预后质量的重要因素[21]。本组研究结果显示,观察组患者治疗总有效率及4 h血肿清除率显著高于对照组,观察组患者再次出血及电解质紊乱发生率显著低于对照组。对患者神经功能恢复情况进行分析发现,观察组NIHSS评分改善情况显著优于对照组。分析认为,采用神经内镜微创术联合置管吸引术对脑出血患者进行治疗后,可有效吸除血肿,尽可能降低对脑组织损伤。此外,在患者发病后及时治疗,有效清除病灶,改善患者预后质量。
有研究指出,患者在脑出血后常导致脑组织受损,使脑组织处于缺血、缺氧状态,而且在此过程中出现的血红蛋白分解物可能诱发并释放大量炎性因子,导致出现全身性应激反应[22]。 TNF-α、hs-CRP及IL-6是其中最为常见的重要炎性因子,也是评估患者脑出血损伤程度重要的指标[23]。本组研究结果显示,经治疗后观察组患者血中TNF-α、hs-CRP及IL-6水平均显著降低,表明采用神经内镜微创术联合置管吸引术治疗后可显著降低脑出血患者血中炎性因子水平,减轻继发性损伤,有效改善患者预后质量。
综上所述,采用神经内镜微创术联合置管吸引术对脑出血治疗后可有效提高临床疗效,降低不良反应发生率并改善患者预后质量。但本研究为单中心研究,有待后续深入研究。

