高产纤维分解酶康氏木霉诱变选育与发酵条件优化
朱玉霞 高爱琴 张铁鹰 刘俊丽 刘欣彤 张志鹏 廖朝勇
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.内蒙古农业大学动物科学学院,呼和浩特010018)
我国是玉米种植大国,每年玉米秸秆产量巨大,2017年玉米秸秆产量达9亿万t[1]。因缺乏切实可行的处理与利用技术,焚烧玉米秸秆现象严重,年焚烧量超过2亿t[2],造成资源浪费和严重的环境污染。玉米秸秆蕴藏能值丰富,若经科学处理,可作为能量饲料资源的补充。利用微生物产生的多种纤维分解酶对玉米秸秆进行转化利用是当前研究的热点方向[3]。
丝状真菌(黑曲霉、木霉和白腐霉)被认为可产生较全的纤维素酶系和部分半纤维素酶系[4],也是分解秸秆纤维成分的理想菌株。康氏木霉是生物降解玉米秸秆的常用菌,可高效降解玉米秸秆中的纤维成分。常娟[5]在玉米秸秆中接种康氏木霉,发现康氏木霉可显著降低玉米秸秆中纤维素和半纤维素含量。史国翠[6]筛选出分解纤维素能力强的菌种为康氏木霉,随着时间的延长,其对牛瘤胃中性洗涤纤维、酸性洗涤纤维、纤维素、半纤维素降解率增大。玉米秸秆含多种复杂的化学键,水解需要多种酶配合协同完成,康氏木霉不仅有分泌纤维素酶的能力,还有分泌大量木聚糖酶的能力,这对高效水解玉米秸秆具有重要意义。李慧君[7]研究发现,康氏木霉产纤维素酶和木聚糖酶的最大活性均对其降解玉米秸秆的能力影响较大。冯波[8]在试验中筛选出1株产木聚糖酶活性能力较高的菌株——康氏木霉。由此可见,纤维分解酶种类与活性对高效水解秸秆纤维成分影响较大,获得酶谱全、活性高的菌株是生物处理玉米秸秆的关键。
玉米秸秆化学结构复杂,微生物纤维分解酶往往需要非酶蛋白因子(解氢键酶[9]、溶多糖单加氧酶[10]、溶胀素[11])共同参与才能高效水解纤维素。与基因工程菌液态发酵产生的单一酶种相比,野生菌固态发酵产生的多酶复合体系更适合于秸秆水解处理,其不仅酶谱丰富,且可产生多种辅助因子,更有利于打开复杂的纤维结构。但野生菌固态发酵产生的酶活性低、成本高,限制了其在水解处理作物秸秆中的应用。因而,提高野生菌产酶能力和生长速度是秸秆生物酶解处理技术的关键[6]。诱变筛选是提高微生物产酶能力和降低酶制剂成本的常用方法。紫外、化学诱变因效果好、操作简单、条件和设备要求较低,现已成为快速突变各类微生物基因组的有效方法。例如在木霉的选育中,Ike等[12]利用紫外线诱变方法筛选出2株高产纤维素酶木霉菌株。Li等[13]以绿色木霉为原始菌株,经紫外线和微波诱变处理后,获得7株高产突变菌。李敏霞[14]对绿色木霉进行紫外、硫酸二乙酯和亚硝酸钠复合诱变后,筛选得到高产突变菌。综上所述,复合诱变作为一种高效生物突变手段,在菌种改良领域将具有良好的应用前景。因此,本文拟采用紫外、化学和紫外+化学复合诱变方法,对康氏木霉进行诱变,以微晶纤维素为唯一碳源,筛选生长快、产酶能力高的突变菌。通过对突变菌固态发酵产酶条件的优化,以期获得高产纤维分解酶菌株及其其固态发酵工艺参数,为玉米秸秆高效生物转化提供指导。
1 材料与方法
1.1 原菌菌种
试验用原菌菌种为康氏木霉13006,由中国工业微生物菌种保藏中心提供。
1.2 培养基
传代培养基:玉米秸秆粉5 g(沸水洗至无色,过200目筛),硫酸铵1.65 g,磷酸氢二钾(K2HPO4)0.5 g,七水合硫酸镁(MgSO4·7H2O) 0.25 g,琼脂18~20 g,自然pH,用蒸馏水定容至1 L。
微晶纤维素刚果红培养基:微晶纤维素5 g,硫酸铵1.65 g,刚果红0.3 g,K2HPO40.5 g,脱氧胆酸钠0.2%,MgSO4·7H2O 0.25 g,琼脂18~20 g,自然pH,用蒸馏水定容至1 L。
固体发酵基础培养基:玉米秸秆(过2 mm筛)7.0 g,麸皮3.0 g,硫酸铵2%,料水比1.0∶2.2,自然pH。
1.3 孢子悬液制备
孢子悬液制备:将木霉孢子悬液2.5 mL(107个/mL)接入50 mL的限量培养液(葡萄糖0.1%,硫酸铵0.05%)中,30 ℃,150 r/min培养,记录孢子萌动过程,以萌动率20%~30%为最佳萌动时间。
1.4 康氏木霉紫外、化学和复合诱变
将康氏木霉孢子液稀释为40个孢子菌悬液进行紫外诱变(暗室中紫外诱变仪,预热30 min,并吸取10 mL至直径为6 cm无菌培养皿中,放入紫外诱变仪。选择365 nm紫外线波长,并不断搅拌,照射时间分别为8、11、14、17、20、23 min。为防止回复,紫外线诱变后的操作均在红灯下进行)或化学诱变(取3.5 mL孢子悬液备用,将1 mL的硫酸二乙酯与0.5 mL的无水乙醇混合均匀后加入到制备好的孢子悬液中。诱变时间分别为10、20、30、40、50、60 min后加入0.5 mL 25%硫代硫酸钠(Na2S2O3)以终止反应,以加无菌水处理的作空白对照),吸取不同诱变时间菌液均匀涂布微晶纤维素刚果红培养基上,30 ℃恒温培养36 h,菌落计数,统计诱变前后的变化,计算致死率。
突变菌交叉复合诱变:将第1轮突变菌交叉再进行紫外和化学诱变,操作步骤同上述一致。
1.5 最优突变菌筛选
以原菌康氏木霉13006在微晶纤维素刚果红培养基上所产透明圈菌落大小为对照,挑选平板上突变菌长得快、菌丝短、产孢子晚、透明圈大的菌落。用0.9%的生理盐水洗下,然后涂到传代培养基上,培养4~6 d长出单菌落后收集保藏,接种至固体发酵培养基上进行发酵,测定其纤维素酶(NY/T 912—2004)、木聚糖酶(GB/T 23874—2009)和滤纸酶(GB/T 23881—2009)活性,比较其酶活性大小以确定高产纤维分解菌株。
1.6 突变菌产酶发酵条件优化
1.6.1 单因素试验
以基础培养基为基准,30 ℃恒温培养,依次对发酵时间(48、60、66、72、78、84、90、96、102、108、114、120 h)、硫酸铵浓度(0、1%、2%、3%、4%、5%、6%)、磷酸二氢钾浓度(0、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%)及孢子(107个/mL)接种量(0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4 mL)进行单因素试验,每个处理3个重复。测定不同发酵条件下突变菌康氏木霉UH-1产纤维素酶、木聚糖酶、滤纸酶活性,确定这些因素对突变菌康氏木霉UH-1产酶的影响,并获得最佳产酶条件。
1.6.2 正交试验
根据对单因素试验的结果,进行L9(34)正交试验,即选择单因素试验中对产酶影响比较大的4个因素,每个因素设3个水平进行正交试验,从而确定康氏木霉UH-1产木聚糖酶、纤维素酶、滤纸酶的最优固体发酵条件组合。将试验菌株接种于最优发酵培养基中,在最优发酵条件下进行发酵培养,测定发酵产物几种酶的活性,并与原菌康氏木霉13006进行比较。
1.7 数据统计分析
运用SPSS 19.0统计软件进行单因素方差分析和差异显著性检验,结果以平均值±标准差表示。
2 结果与分析
2.1 康氏木霉紫外、化学诱变与突变菌筛选
将康氏木霉孢子萌发20 h后(萌发率为20%)进行紫外、化学诱变,最佳紫外照射时间为10 min(致死率为80%),最佳化学诱变时间为30 min(致死率为80%)。经多轮紫外、化学诱变,挑选出(微晶纤维素刚果红培养基,培养7 d)各轮诱变菌透明圈直径/菌落直径较大的初筛突变菌。初筛突变菌经固态发酵进行复筛,突变菌康氏木霉13006产酶能力见表1。由表可知,通过突变菌菌落大小比较,获得2个突变菌,经固态发酵复筛发现,突变菌康氏木霉U11-2的滤纸酶、纤维素酶和木聚糖酶活性较原菌康氏木霉13006均有所提高(P>0.05)。这说明单一手段诱变康氏木霉13006无法获得较优突变菌。鉴于康氏木霉U11-2产酶能力有提高趋势,将其作为下轮交叉复合诱变的出发菌。
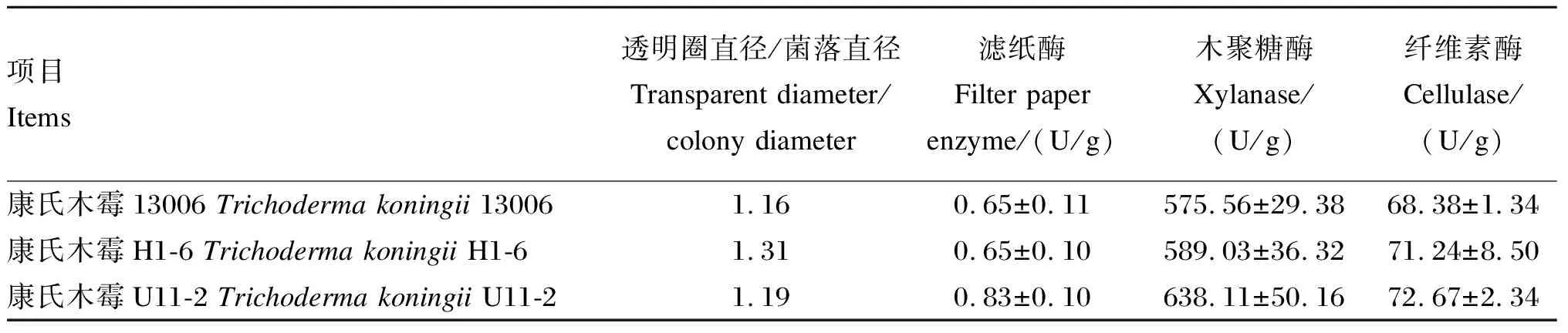
表1 康氏木霉13006突变菌产酶能力
同列数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。表2~表7同。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as Table 2 to Table 7.
U:紫外诱变;H:化学诱变。下表同。
U: ultraviole mutagenesis; H: chemical mutagenesis. The same as below.
2.2 康氏木霉U11-2交叉诱变与突变菌筛选
康氏木霉U11-2在紫外(20 min)和化学(30 min)最佳诱变条件下,经多轮紫外、化学交叉诱变,各轮诱变菌株产透明圈(微晶纤维素刚果红培养基,培养7 d)和发酵产酶,康氏木霉U11-2突变菌产酶能力见表2。由表可知,各突变菌(康氏木霉U11-2、康氏木霉UH30-2、康氏木霉UH-1)的木聚糖酶和纤维素酶活性较原菌康氏木霉13006均显著提高(P<0.05),滤纸酶活性也有所提高(P>0.05)。
由图1可见,突变菌康氏木霉UH-1发酵样品较原菌康氏木霉13006颜色明显变深,说明菌株发生了突变,这说明交叉复合诱变是康氏木霉较为适宜的诱变手段。鉴于突变菌康氏木霉UH-1发酵产酶综合能力较强,将其作为后续研究的出发菌。

表2 康氏木霉U11-2突变菌产酶能力

图1 康氏木霉原菌和突变菌发酵样品颜色变化
2.3 突变菌康氏木霉UH-1产酶发酵条件优化
2.3.1 发酵时间对康氏木霉UH-1产酶能力的影响
由表3可知,发酵时间对康氏木霉UH-1产酶能力的影响较大,随着发酵时间的延长,滤纸酶、纤维素酶和木聚糖酶活性呈升高-降低-升高的变化趋势,并均于84 h时达到峰值,随后滤纸酶活性呈降低趋势,木聚糖酶和纤维素酶活性呈现无规律变化。由于发酵时间越短,对降低生产成本较为有利,因此将康氏木霉UH-1最佳发酵时间定为84 h。
2.3.2 硫酸铵浓度对康氏木霉UH-1产酶能力的影响
由表4可知,滤纸酶和纤维素酶活性在硫酸铵浓度为6%时最高,显著高于硫酸铵浓度为0、1%、2%时(P<0.05),硫酸铵浓度为2%时显著高于硫酸铵浓度为0、1%时(P<0.05)。木聚糖酶活性在硫酸铵浓度为2%时最高,显著高于其他硫酸铵浓度(P<0.05)。因此,综合考虑硫酸铵硫酸铵对纤维素酶、木聚糖酶和滤纸酶活性的影响,康氏木霉UH-1产酶的最佳硫酸铵浓度定为2%。

表3 发酵时间对康氏木霉UH-1产酶能力的影响
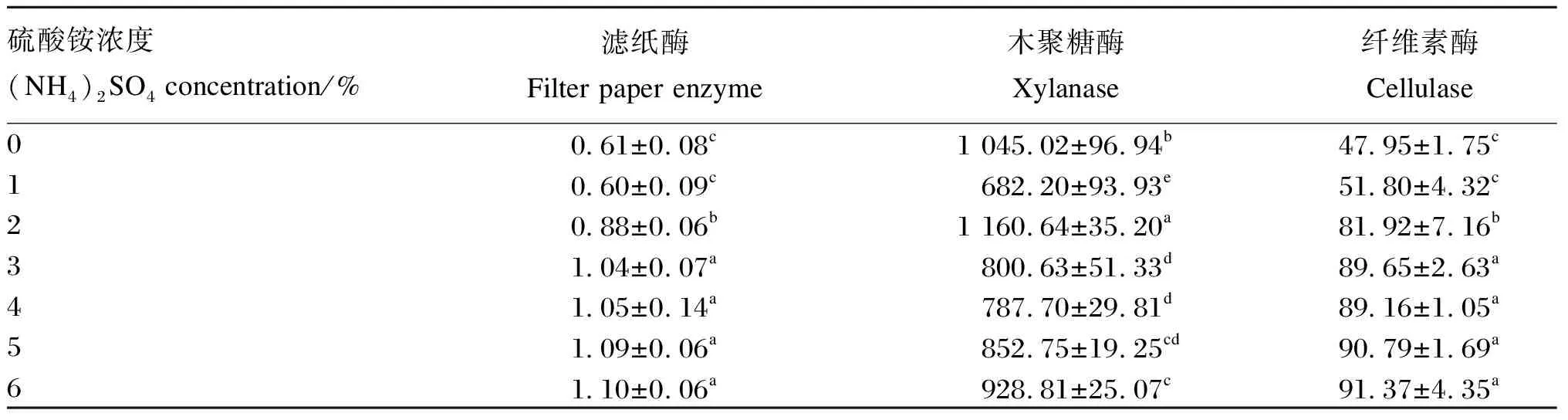
表4 硫酸铵浓度对康氏木霉UH-1产酶能力的影响
2.3.3 磷酸二氢钾浓度对康氏木霉UH-1产酶能力的影响
由表5可知,磷酸二氢钾浓度对滤纸酶、纤维素酶、木聚糖酶活性均无显著影响(P>0.05),且磷酸氢二钾浓度为1%时各个酶活性相对较高,综合考虑成本,因此康氏木霉UH-1产酶的最佳磷酸二氢钾浓度定为1%。

表5 磷酸二氢钾浓度对康氏木霉UH-1产酶能力的影响
2.3.4 接种量对康氏木霉UH-1产酶能力的影响
由表6可知,滤纸酶活性在接种量为1.2 mL时最高,显著高于接种量为0.8、1.1、1.4 mL时(P<0.05)。纤维素酶活性在接种量为1.0 mL时最高,显著高于接接种量为1.3 mL时(P<0.05)。木聚糖酶活性在接种量为1.3 mL时最高,显著高于接接种量为0.9 mL时(P<0.05)。综合考虑,康氏木霉UH-1产酶的最佳接种量定为1.0 mL。

表6 接种量对康氏木霉UH-1产酶能力的影响
2.3.5 培养基含水量对康氏木霉UH-1产酶能力的影响
由表6可知,培养基含水量对康氏木霉UH-1的产酶能力无显著影响(P>0.05)。综合考虑,康氏木霉UH-1产酶的最佳培养基含水量定为67%。

表7 培养基含水量对康氏木霉UH-1产酶能力的影响
2.3.6 正交试验结果
根据单因素试验的结果,选择对康氏木霉UH-1固体发酵产酶能力影响较大的4个因素(发酵时间、硫酸铵浓度、接种量、培养基含水量)进行L9(34)的正交试验。由表8可知,影响滤纸酶活性的主要因素依次为硫酸铵浓度>培养基含水量>发酵时间>接种量,其最优发酵条件为硫酸铵浓度3%、培养基含水量67%、发酵时间78 h、接种量1.2 mL。影响纤维素酶活性的主要因素依次为硫酸铵浓度>发酵时间>接种量>培养基含水量,其最优发酵条件为硫酸铵浓度4%、发酵时间90 h、接种量1.0 mL、培养基含水量68%。影响木聚糖酶活性的主要因素依次为硫酸铵浓度>接种量>培养基含水量>发酵时间,其最优发酵条件为硫酸铵浓度2%、接种量1.1 mL、培养基含水量67%、发酵时间84 h。

表8 正交试验结果

续表8项目Items因素 Factors发酵时间Fermentation time/h硫酸铵浓度(NH4)2SO4concentration/%接种量Inoculation quantity/mL 培养基含水量Culture medium moisture/%滤纸酶Filter paper enzyme 纤维素酶Cellulase 木聚糖酶Xylanase K3(2)90.03791.29086.77086.683R(2)4.0709.5773.9962.697K1(3)681.657879.277674.313728.537K2(3)713.003640.643756.250690.453K3(3)711.603586.343675.700687.273R(3)31.346292.93481.93741.264
K1、K2、K3分别为各因素在1、2、3水平时产酶量;R为极差;(1)为滤纸酶活性;(2)为纤维素酶活性;(3)为木聚糖酶活性。
K1, K2 and K3 were the enzyme production when the factors at 1, 2 and 3 levels, respectively; R was the range; (1) was the filter paper enzyme activity; (2) was the cellulase activity; (3) was the xylanase activity.
2.3.7 正交试验验证
在上述正交试验优化条件下,对原菌康氏木霉13006和诱变菌康氏木霉UH-1固态发酵产纤维素酶、木聚糖酶和滤纸酶活性的最适发酵条件进行验证。由表9可知,康氏木霉UH-1产滤纸酶与木聚糖酶的最优条件为硫酸铵浓度2%、接种量1.1 mL、培养基含水量67%、发酵时间84 h,活性分别可以达到0.86和1 150.32 U/g。康氏木霉UH-1产纤维素酶的最优条件为硫酸铵浓度4%、发酵时间90 h、接种量1.0 mL、培养基含水量68%,活性可以达到103.99 U/g。康氏木霉13006纤维素酶、木聚糖酶和滤纸酶活性最高可以达到53.17、812.78和0.30 U/g,康氏木霉UH-1较其酶活性均有所提高。
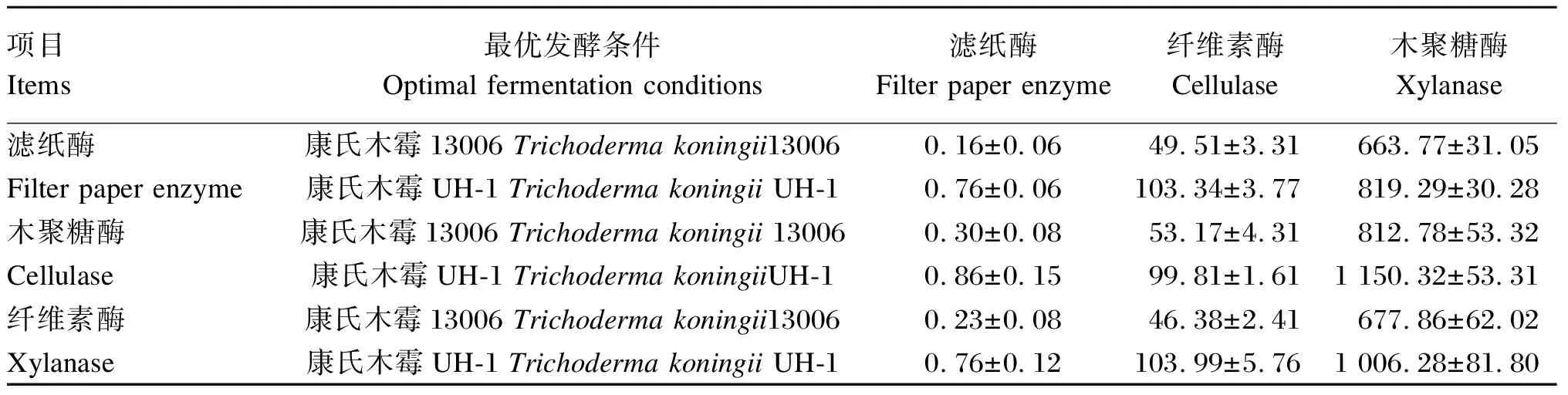
表9 正交试验验证
3 讨 论
玉米秸秆化学结构复杂,很难被动物高效利用。利用微生物产生的多种纤维分解酶将玉米秸秆转化为易于动物消化吸收形式的饲料资源是当前秸秆综合利用的研究热点。通过诱变和基因改造获得高产酶能力的优良菌株是生物酶解处理秸秆的关键。因霉菌的成熟分生孢子处于休眠状态,萌发孢子可改善诱变育种的效果[15-17]。刘春芬[18]试验表明,利用萌发的孢子进行诱变可提高菌株正突变率。因此本试验对康氏木霉孢子进行萌发处理,当孢子萌发率达到20%时进行诱变处理,并获得了较高的突变率。本文通过对康氏木霉13006进行紫外、硫酸二乙酯、紫外-硫酸二乙酯复合诱变获得了产酶能力较强的突变菌康氏木霉UH-11。获得的突变菌康氏木霉UH-1木聚糖酶活性较原菌康氏木霉13006提高了42.7%,纤维素酶活性提高了78.5%。这可能与单一诱变方法突变点单一、突变几率小、不稳定和菌株易对单一诱变剂发生抗性有关,因此复合诱变可能是丝状真菌更为有效的诱变方式。
在诱变育种过程中如何快速高效筛选出优良的突变菌十分关键。本研究采用透明圈和固态发酵酶活性测定对突变菌进行初筛与复筛。结果发现,虽然菌株产酶高低和透明圈与菌落直径比值间存在有一定关联,但也并非比值越大的突变菌酶活性就越高。因丝状真菌在天然作物秸秆平板培养基上生长较快,且透明圈不明显,难以用来筛选突变菌。在本试验中采用微晶纤维素平板筛选突变菌,虽具有一定代表性,仅展示出菌株对微晶纤维素的分解能力,不能代表其对秸秆的降解能力。同时,康氏木霉固态发酵可以产生多种酶系,包括纤维素酶、木聚糖酶、滤纸酶、外切葡聚糖酶活、β-木聚苷酶活、β-葡萄糖苷酶,这些酶在秸秆的降解过程中发挥着不同作用。因此,发酵酶活性测定是突变菌筛选的必要手段。但酶活性测定耗时费力,如何建立一种可快速筛选高效降解作物秸秆丝状菌株的方法尚需要进一步研究。
氮是微生物细胞重要营养素,也是菌体合成酶蛋白的关键营养素。微生物不仅可利用有机氮,还可大量利用非蛋白氮。因硫酸铵等无机氮价格低廉,常作为微生物发酵的主要氮源[17-20]。孙君社等[21]研究康氏木霉产纤维素酶发酵条件时,适宜的硫酸铵浓度为2%,发酵时间为84 h,这与本试验研究结果一致。磷是微生物生长所必不可少矿物元素。菌体代谢培养基中碳源会产生大量的酸,导致发酵pH下降,从而影响菌体生长和产酶能力。在固态发酵培养基中加入一定量磷酸盐不仅能起缓冲作用,还可促进微生物生长和代谢。谢夏阳[20]和王实玉[22]在研究康氏木酶产纤维素酶条件时确定适宜的磷酸二氢钾浓度为0.1%,与本试验研究结果不一致,可能与菌株发酵培养基碳源组成有关。
在丝状真菌的固态发酵过程中不能进行养分补充,接种量对发酵产酶量影响至关重要。孙斐等[23]确定拟康氏木霉适宜接种量为10%,与本试验结果一致。培养基含水量过低会导致培养基表面干燥进而影响菌种的生长和产酶能力,培养基含水量过高会导致培养基通气孔阻塞,供氧不足,从而抑制菌体生长。孙斐等[23]确定拟康氏木霉适宜含水量为55%~60%,与本试验结果(培养基含水量为67%)不一致。由试验可知,含水量对于菌种发酵产酶能力影响不大,这可能与本试验中起始含水高有关;其以玉米芯和麸皮为碳源,而本试验为玉米秸秆和麸皮。林元山[24]通过对康氏木霉AS3.2774发酵条件优化表明稻草粉与麸皮培养基含水量为67%,与本试验结果一致。因此,需要针对康氏木霉发酵培养基的组成来确定其适宜培养基含水量。
4 结 论
① 对康氏木霉13006进行多轮紫外、化学和交叉复合诱变,获得1株产纤维分解酶能力较强的突变菌康氏木霉UH-1,其木聚糖酶活性提高了42.7%,纤维素酶活性提高了78.5%。
② 优化康氏木霉UH-1固态发酵培养条件,基础培养基为玉米秸秆∶麸皮为7∶3、硫酸铵浓度2%、接种量1.1 mL、含水量67%、发酵时间84 h。在此条件下,康氏木霉UH-1滤纸酶活性达到0.86 U/g,纤维素酶活性达到99.81 U/g,木聚糖酶活性达到1 150.32 U/g。

