芳香烃受体调控肠道炎症的研究进展
李成良 齐广海,2 彭 鹏 方热军*
(1.湖南农业大学动物科技学院,长沙410128;2.中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京100081)
多环芳香烃化合物(polycyclic aromatic hydrocarbons,PAHs)是重要的环境污染物,具有强烈的致癌性。Poland等[1]应用核素标记配体法测定技术证明一种受体可介导PAHs的毒性作用,而命名为芳香烃受体(aryl hydrocarbon receptor,AhR)。以前研究多集中于AhR对环境芳香烃化合物的代谢反应,近年研究发现,AhR是参与免疫调节的关键因子,AhR存在于大多数免疫细胞,参与调控细胞增殖、分化、适应性及先天免疫细胞亚细胞群的细胞因子分泌[2]。AhR在调节性T细胞(regulatory T cell,Treg)、辅助性T细胞17(T helper cells 17,Th17)、肠上皮内淋巴细胞(intestinal intraepithelial lymphocytes,IELs)、固有淋巴细胞(innate lymphoid cells,ILCs)等自身免疫调节中具有重要作用。越来越多的研究表明,AhR在调控溃烂性结肠炎(ulcerated colitis,UC)、克罗恩病(Crohn’s disease,CD)、抑制肠道感染和维护肠道健康方面有重要作用,其对肠道炎症的调控已成为当前研究热点。
1 AhR的一级结构
AhR是分子量较大的蛋白质,是由805个氨基酸构成的转录因子,属于配体依赖性的碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)超家族中的PAS(period-aryl hydrocarbon receptor nuclear translocator-single minded,Pre-Arnt-Sim)亚家族成员[1]。所有哺乳动物bHLH-PAS蛋白质具有相似的分子结构,表明AhR进化过程中具有高度保守性。AhR结构从N端到C端主要分成bHLH、PAS和C端谷氨酰胺富集区3部分(图1)。bHLH具有高度保守性,对基本生理活动具有重要作用,PAS包括重复序列PAS-A和PAS-B 2部分[3]。C端具有物种差异性,呈多态性,其蛋白质长度长短不一[4]。N端bHLH帮助DNA结合和蛋白质二聚化,AhR受体C端约50%的蛋白质富含谷氨酸,该区具有转录激活作用,保护相关辅酶因子的结合位点如E1A结合蛋白P300(E1 A binding protein p300,P300)和固醇受体共激活因子-1(steroid receptor coactivator-1,SRC1)。PAS-B区为配体绑定区[5],PAS区主要发挥DNA识别、与配体和分子伴侣蛋白质相互结合的功能。PAS-B结构域与AhR配体结合区相重叠,赋予了蛋白质之间的相互作用,如与热休克蛋白90(heat shock protein 90,HSP90)、成视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)的相互作用[6-7]。

图1 AhR的结构功能域
但由于AhR高级结构尚未被解析,其涉及与配体结合、转运等机制研究受到一定限制。近年来,研究者采用同源模建法,获得了AhR配体结合区三维空间结构[8],该结构由5个β折叠和1个α螺旋构成,并包含1个疏水的配体结合口袋。目前认为配体结合口袋附近的芳香族氨基酸残基如谷氨酸(Gln)377、苯丙氨酸(Phe)318、Phe289、半胱氨酸(Cys)294,Gln317、苏氨酸(Thr)283等通过它们的芳香族侧链与配体的芳香环(所有配体都具有芳香环特征)之间产生的堆积力相互作用,实现配体与受体结合,其中Phe318在配体结合中起到关键性作用[8-9]。
2 AhR的配体
AhR需要配体激活才能发挥其相关功能,其配体至少具有芳香化合物结构特征和疏水性。传统意义上AhR配体主要有两大类:卤代芳烃(halogenated aromatic hydrocarbons,HAHs)和多环芳香烃(polycyclic aromatic hydrocarbons,PAHs),越来越多的研究显示,一些与二者结构上有很大差异的人工合成和天然化合物也可以与AhR结合,说明AhR具有高度的配体多样性特点[10]。AhR的配体主要包括外源性配体和内源性配体,表1总结了具有代表性的AhR配体[10-15]。
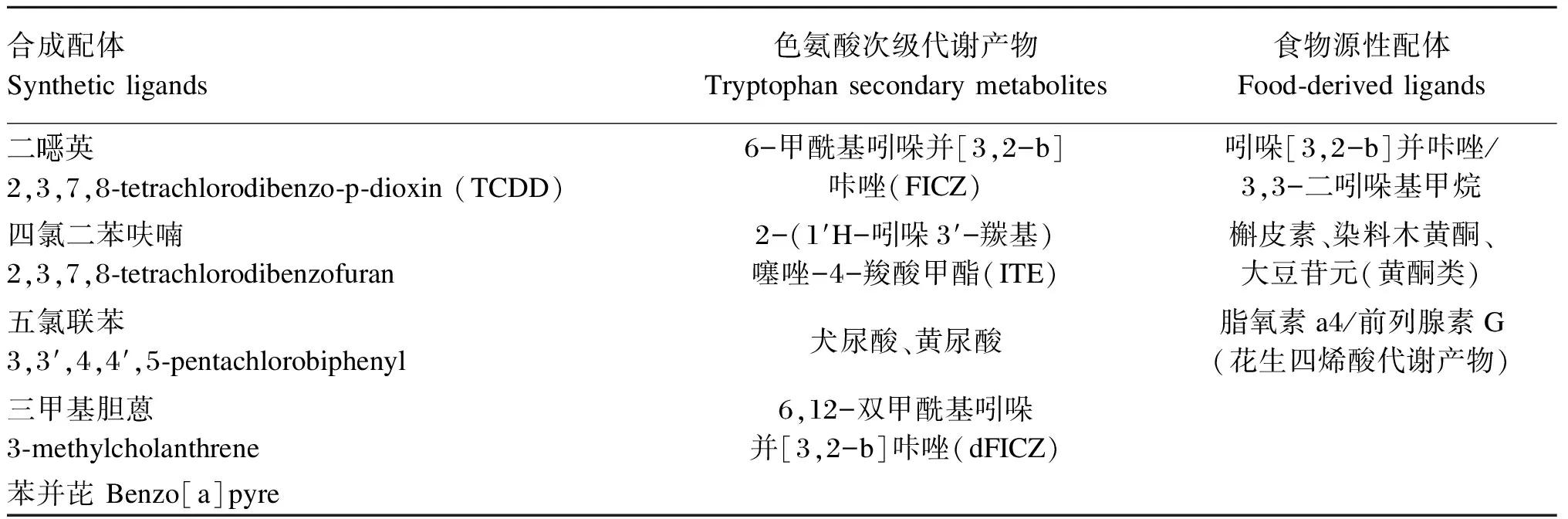
表1 代表性的AhR配体
3 AhR的信号传导过程
无配体时,AhR与辅助伴侣蛋白23(co-chaperone protein 23,p23)、HSP90和乙型肝炎病毒X相关蛋白-2(hepatitis B virus X-associated protein 2,XAP2)形成复合物,存在于细胞质内。AhR配体根据其分子量大小,通过被动运输、主动转运、易化扩散和胞饮等方式进入细胞内[16]。当配体与AhR结合后,该复合物构象改变,再与核输入蛋白β结合,从而控制复合物核质穿梭[17]。在核内AhR与芳香烃受体转运蛋白(AhR nuclear translocator,ARNT)组成异源二聚体。活化后的AhR-配体-ARNT异源二聚体与DNA片段上二噁英反应元件(dioxin-responsive element,DRE)也叫外源反应元件(xenobiotic-responsive element,XRE)特异结合而发挥转录作用,下游被调控基因的XRE含有共同核心序列(N-GCGTG-C)。
AhR激活诱导可氧化AhR配体的细胞色素酶P4501A1(cytochrome P-4501 A1,CYP1A1),并导致配体的代谢清除与解毒。AhR-配体复合物入核和XRE/DRE区域相互联系时,4 h左右配体-AhR复合物会从核中移出并被相关酶如CYP1A1所降解。但当CYP1A1表达异常时,会耗尽细胞核内AhR配体,形成一个类似于AhR缺乏状态,从而影响后续基因表达,导致机体病变[18]。同时还存在2条独立通路防止AhR被过度活化:泛素/蛋白酶途径将激活的AhR降解及转运出核,芳香烃受体抑制因子(aryl hydrocarbon receptor repressor,AhRR)与AhR竞争结合ARNT。激活的AhR可诱导AhRR表达,达到对AhR通路活性的负反馈调节(图1)[19]。
4 AhR与炎症性肠道疾病(inflammatory bowel disease,IBD)
多位学者研究了AhR与肠道炎症之间的关系。Qiu等[20]发现无菌条件下与野生型小鼠(AhR+/+)相比,40%的AhR敲除小鼠(AhR-/-)出现了结肠炎,肠道组织出现了增厚和纤维化。小鼠肠道出现隐窝损伤和脓创、杯状细胞减少、腺体结构变形,炎症延伸至黏膜下层属于典型的IBD症状。Arsenescu等[21]在无菌条件下,使用右旋葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导小鼠产生结肠炎,发现在饲喂DSS的7 d时间里,AhR-/-小鼠全部死亡。Monteleone等[22]发现,与对照组(健康人体结肠组织)相比,UC组和克罗恩病病人的AhRmRNA表达丰度显著下降,体重减轻。后期通过小鼠试验发现添加AhR拮抗剂后,加重小鼠结肠炎。这些试验说明AhR是维护肠道健康的必需因子,当AhR缺失或AhR表达受阻时,加重了肠道炎症。而AhR必须被各种配体活化后才能进入细胞核发挥相关功能。许多学者针对配体活化AhR介导肠炎信号在IBD模型中进行了大量研究[23-26]。

AhR:芳香烃受体 aryl hydrocarbon receptor;XAP2:乙型肝炎病毒X相关蛋白-2 hepatitis B virus X-associated protein 2;HSP90:热应激蛋白90 heat shock protein 90;ARNT:AhR转运蛋白 AhR nuclear translocator;DREs:二英反应元件 dioxin-responsive element;CYP1A1:细胞色素酶P4501A1 cytochrome P-4501A1。
图2AhR的信号途径
Fig.2 AhR signaling pathway[19]
李良子等[27]发现6-甲酰基吲哚并[3,2-b]咔唑(FICZ)可缓解DSS诱导的结肠炎,同时减少了促炎因子白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)表达,提高了抗炎因子白细胞介素-10(interleukin-10,IL-10)的表达。DSS型结肠炎导致肠黏膜CYP1A1表达量下降,加入FICZ后明显增加了肠黏膜CYP1A1表达量。FICZ为色氨酸光化产物,是AhR重要的内源性配体,其不仅可以缓解DSS诱导肠炎,还可以缓解三硝基苯磺酸(trinitrobenenze sulfonic acid,TNBS)或是T细胞转移诱导型结肠炎[25-27]。许多研究也都得到了类似结果[28-29]。
以上研究表明,AhR在缓解炎症性肠疾病中具有重要作用,内外源性配体均可激活AhR信号通路,活化的AhR可缓解由AhR缺失、DSS和TNBS诱导产生的结肠炎,而非AhR配体(如二甲基亚枫)不能激活AhR通路,不能缓解肠道炎症。
5 AhR调控肠道炎症的主要方式
5.1 AhR调控肠上皮内淋巴及其相关因子
作为肠黏膜免疫系统的一个关键组分,IELs是存在与小肠黏膜上皮的一类独特的细胞群。IELs具有自然杀伤活性,并能分泌多种细胞因子,从而在免疫监视和细胞介导的黏膜免疫中发挥重要作用。Li等[30]研究发现,与其他淋巴细胞相比较,IELs可以表达高水平的AhR,随后将小鼠AhR基因敲除,发现小鼠小肠95%的IELs损失,而对淋巴结、脾脏的细胞比例和数量无影响。与野生型小鼠相比,肠上皮细胞周转受到影响,从而影响黏膜屏障完整性。伴随着IELs数量的减少,发现AhR-/-小鼠的颗粒酶A和B、基质金属蛋白酶-7(matrix metalloproteinase-7,MMP-7)和C型凝集素均显著低于对照组和吲哚-3甲醇(indole-3-carbinol,I3C)添加组。而Girardi等[31]认为敲除AhR会导致强烈的宿主免疫,造成IELs的免疫耐受。
Li等[30]移植来自小肠的富含AhR的肠道T细胞受体(T cell receptor,TCR)αβ(一种IELs细胞亚群),可重建AhR-/-小鼠肠道上皮细胞。来自于对照组的骨髓细胞在缺失重组激活基因-1(recombination activating gene 1,RAG1),甚至RAG1和AhR都缺失情况下可重建肠道IELs。AhR-/-小鼠骨髓细胞不能重建肠道IELs细胞,这说明活化的AhR是ILEs的一种细胞固有(cell-intrinsic)需求。AhR活性可直接影响IELs细胞池的维持。作者并没找到AhR直接调控IELs的靶基因的证据,但以前有报道,具有受体酪氨酸激酶c-kit基因突变的小鼠,表现为IELs细胞池容量显著下降,这种现象与AhR-/-小鼠表现非常相似。这表明AhR可能是通过c-kit基因的表达来调控IELs细胞池容量[32]。
Li等[30]给小鼠饲喂标准饲粮和纯合饲粮3周后,饲喂纯合饲粮组回肠CYP1A1(AhR靶基因)、TCRγδ+CD88αα+IELs数量显著下降,而给纯合饲粮加入200 mg/kg I3C后,IELs数量得到恢复,结肠炎得到缓解。且颗粒酶A和B,MMP-7和C型凝集素含量明显高于对照组和基因敲除组。研究发现ILEs可直接参与免疫监视作用,通过高表达量的颗粒酶诱导感染细胞凋亡[33],MMP-7主要参与肠道损伤修复和α-防御素(α-defensin)的杀菌作用[34]。C型凝集素可直接分泌到肠腔清除革兰氏阳性菌[35]。
总结,配体激活AhR后可能通过调控c-kit基因表达,从而维持ILEs细胞池,保持肠上皮完整性,提高颗粒酶A和B及MMP-7、C型凝集素的表达,这几种因素共同作用,提高肠道修复和杀菌能力,从而缓解肠道炎症。
5.2 AhR调控肠道ILCs,维持肠道黏膜稳态平衡
ILCs既是固有免疫的效应细胞,又是获得性免疫的前体细胞[36-37]。ILCs位于肠黏膜固有层、肠黏膜的微小肠道隐窝斑(cryptopatches,CP)、孤立淋巴滤泡和派尔集合淋巴结,主要表达为孤儿核受体γt+(retinoid-related orphan nuclear receptors,RORγt+)ILC胞亚群。Spits等[38]发现ILCs是一个重要的肠黏膜稳态信号。
Qiu等[20]研究发现,成年AhR基因敲除小鼠,表现为RORγt+ILC程序性死亡增加,数量减少,添加FICZ后,可增加野生型小鼠和杂合子小鼠的RORγt+ILC数量,而对照组小鼠无影响。Lee等[39]发现当AhR缺失时,ILC(CD4+RORrt+ILC)数量显著下降。Kiss等[40]发现AhR-/-小鼠的ILCs数量扩增受到抑制,肠道第二淋巴器官微小肠道隐窝斑和孤立淋巴小结(isolated lymphoid follicles,ILF)发育受到抑制。以上研究都表明AhR信号参与调节ILCs细胞的增殖和存活。
Kiss等[40]发现AhR-/-小鼠表达低水平的kit(平均荧光强度3 500∶1 000),给添加小鼠饲喂纯合饲粮、纯合饲粮加2 g/kg I3C和对照组饲粮(谷物基础饲粮,含有多酚芥子苷等)后,添加配体组和对照组均能激活AhR上调kit基因表达(平均荧光强度500∶2 000∶2 000)。这表明AhR直接调控kit转录。研究发现kit启动子具有典型的XRE[41-43],染色体免疫沉淀反应分析发现,活化的AhR与kit启动子相结合,给RORγt+ILC添加AhR配体,可提高kit启动子中XRE的占有率[40]。kit是干细胞因子(stem cell factor,SCF)受体,SCF对维持肠道黏膜位点的ILCs细胞池非常重要[44]。采用含有SCF的RORγt+ILC进行体外培养证实了c-kit对出生后的ILCs增殖具有重要作用[40]。这表明AhR通路直接调控kit转录,从而调控ILCs细胞的增殖与分化。
Lee等[39]研究发现,给小鼠饲喂AhR配体二噁英(TCDD)后,可增加结肠肠腔Notch1和Notch2表达,而Notch被认为是AhR的目标基因[45-46],且RORγt+ILC可表达Notch1和Notch2[46],Possot等[47]通过体外培养来自于成人骨髓前体细胞的RORγt+ILC后发现,Notch2信号通路控制RORγt+ILC的产生,缺乏Notch信号通路的小鼠减少了RORγt+ILC的产生。Notch1和Notch2启动子含有XRE,使用AhR配体后,可诱导其启动子与AhR结合,从而进行后续调控[45]。这表明AhR通路同时调控Notch信号通路,从而调控ILCs的增殖与分化。
ILCs主要分泌细胞因子如白细胞介素-22(interleukin-22,IL-22),其可诱导肠上皮细胞产生黏蛋白和抗菌肽,IL-22在肠道抵抗病原方面有着关键作用[48-51]。Lee等[39]研究发现,野生型小鼠肠黏膜固有层的ILCs和派尔集合淋巴结的细胞在白细胞介素-23(interleukin-23,IL-23)刺激下,产生大量IL-22,而AhR基因敲除小鼠几乎无IL-22分泌。AhR基因敲除小鼠很快就被感染,2周内全部死亡。Monteleone等[22]通过TNBS、DSS和T细胞转移诱导小鼠产生结肠炎,而添加AhR配体FICZ后,增加了IL-22分泌,缓解了小鼠结肠炎。Zelante等[52]研究发现,AhR基因敲除小鼠IL-22分泌受到严重的抑制,进一步试验发现,小鼠肠道抗真菌能力与IL-22含量和ILCs数量有关。Schiering等[53]发现,小鼠中CYP1A1基因的异常表达,会耗尽原生AhR配体,形成一个类似于AhR缺乏的状态。CYP1A1的全身或限制在肠道上皮细胞的组成型表达,导致肠道AhR依赖型3类ILCs亚型(RORγt+NKP46+、RORγt+NKP46-、RORγt+CD4+)数量减少,IL-22分泌减少,提高了鼠柠檬酸杆菌对肠道的感染,在食物中增加AhR配体的摄入,可平衡因过多AhR配体降解对肠道免疫功能损伤。
Islam等[29]试验发现,野生型小鼠添加色氨酸增加了AhRmRNA表达,活化AhR的促进了ILCs增殖,同时增加了IL-22含量,IL-22诱导再生蛋白3(regenerating protein 3,Reg3)和黏蛋白的分泌,提高肠道抗菌能力。
AhR可通过上调kit和Notch通路,这2条通路控制ILCs的增殖、分化和周转,维持ILCs细胞池稳定。当肠道受到细菌威胁时,ILCs先于T细胞发挥免疫作用,ILCs分泌IL-22,从而诱导抗菌蛋白Reg3和黏蛋白的分泌进行杀菌活动,维护肠道健康。当AhR缺失或缺少配体激活时,AhR激活通路受到抑制,ILCs增殖分化减少,导致IL-22分泌减少,增加了肠道感染。因此,AhR是维护肠道黏膜稳态的必需因子。
5.3 AhR参与调控Treg/Th17分化平衡,从而调节肠道炎症
Treg和Th17都来自于初始CD4+T细胞,两者分化途径和在肠道炎症发生过程中的作用相反。Treg具有抗炎和维持免疫耐受功能,Th17功能与之相反。鼠类模型研究发现这2种细胞之间存在某种平衡,抑制Th17可促进Treg生成。
Treg转录因子为叉头状/翅膀状螺旋转录因子(forkhead box protein3,Foxp3)[20]。Treg主要分泌白细胞介素-4(interleukin-4,IL-4)、IL-10和转化生长因子β(transforming growth factor-β,TGF-β)等,Treg受IL-10正调节,受IL-6、白细胞介素-21(interleukin-21,IL-21)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)负调节[54-55]。研究发现,CD25+、CD4+辅助性T细胞可抑制、甚至治愈结肠炎[56-57]。Th17转录因子为RORγt。Th17可产生特异性的致炎细胞因子白细胞介素-17(interleukin-17,IL-17)。Th17生成过程受IL-1β、TNF-α和IL-23的正调节[58],γ干扰素(interferon-γ,IFN-γ)、受白细胞介素-27(interleukin-27,IL-27)和白细胞介素-2(interleukin-2,IL-2)的负调节。Th17还可分泌IL-21、IL-6、TNF-α等[59]。这些细胞因子可以集体动员、募集及活化中性粒细胞。IL-17能有效地介导中性粒细胞动员的兴奋过程,从而有效地介导了组织的炎症反应。Zhang等[60]试验发现,在UC模型小鼠体内Th17的分化及与其相关的RORγt、IL-17、IL-6的表达水平均增加,而Treg的分化及与其相关的Foxp3、IL-10的表达水平下降。在DSS诱导的结肠炎模型中,促进了辅助性T细胞1(T helper cells 1,Th1)和Th17的细胞因子(IL-17、IL-6)分泌[43]。
Qiu等[20]研究发现,AhR-/-小鼠促进了小肠初始CD4+T细胞转化为Th17,还发现AhR-/-小鼠Th17的转录因子RORγt表达量增加,促进了IL-17的产生,而Foxp3表达量下降。Singh等[24]采用DSS(3%)诱导小鼠产生结肠炎,结果发现,与DSS+载体组相比,DSS+TCDD组Treg的百分比和数量显著增加,而单独添加TCDD组和单独添加载体组的Treg百分比和数量只有轻微的增加。RT-PCR检测发现,与单独添加载体组比较,DSS+载体组显著下调FoxP3 mRNA表达,显著上调IL-17 mRNA表达。而添加TCDD后(DSS+TCDD),这种情况得到改善;同时发现未使用DSS的小鼠组,与单独添加载体组相比,添加TCDD能上调Foxp3的表达,而不改变IL-17的表达。
为验证TCDD通过AhR诱导调控Treg的分化,研究者采用野生型小鼠C57BL/6(AhR+/+)和AhR-/-小鼠进行体内和体外试验,结果发现,TCDD促进了野生型小鼠的Foxp3表达,而对AhR-/-小鼠的Foxp3表达无影响。同时使用TCDD处理DSS诱导的UC小鼠,发现肠道淋巴组织中的Foxp3表达显著上调,而IL-17的表达没有显著变化,表明TCDD活化AhR后可诱导Treg的分化,而不诱导Th17的分化[24]。Islam等[29]研究发现,野生型小鼠添加色氨酸显著上调Foxp3表达,下调IL-17的表达。还有研究发现,犬尿氨酸与AhR结合后,可促进T细胞向Treg分化,并增强Treg的活性,同时Treg可再作用于树突状细胞(dendritic cell,DC),通过DC促进其他调节性T细胞向Treg分化,形成一个正反馈的过程[61]。
研究发现,Foxp3和RORγt的启动子都具有XRE元件,因此活化的AhR可直接调控这2个转录因子。AhR可通过诱导RORγt/C2表达进而启动RORγt/C2信号转导通路,从而促进Treg的分化。RORγt缺陷型小鼠能够减少Treg的组织浸润并缓解自身免疫性疾病[62]。Foxp3是Treg的调节功能密切相关的特异转录因子,高表达的Foxp3转基因小鼠其Treg数量增加。Foxp3不是传统意义上与IL-2、IL-4和INF-γ基因启动子直接相互作用的转录抑制因子,而是通过阻断多种细胞因子表达所必需的活化T细胞核因子(nuclear factor of active T cells,NFAT)、核转录因子-κB(nuclear factor-kappa B,NF-κB)的活化,达到抑制相应细胞因子表达的作用[63-64]。犬尿氨酸可通过AhR依赖的方式使Foxp3和Treg增殖[65]。
一些新的研究表明,酪氨酸蛋白激酶-信号传导和转录激活因子(janus kinase-signal transducers and activatorsof transcription,JAK-STAT)信号通路在Treg的各种功能中都发挥着重要作用。如Chaudhry等[66]认为,Treg内的信号传导与转录激活因子(signal transduction and activator of transcription,STATs)活化可使Treg通过增加抑制性细胞分子和趋化因子受体的表达来抑制Th17炎性反应,而Treg内STAT3的缺失可导致结肠炎的发生。Quintana等[67]发现,活化的AhR可以通过调节STAT1来促进Treg的分化。在体外Treg/Th17生长分化环境中,STAT3的缺失严重削弱了Th17的分化,使Treg/Th17平衡向Treg方向移动。而AhR与其配体结合后,激活包括STAT3、NF-κB等在内的信号途径促使细胞向Th17分化[68-69]。
以上研究表明,AhR缺失促进了Th17的分化,增加了促炎细胞因子(IL-17、IL-21和TNF-α)分泌,减少了Treg细胞分化,加重了肠道炎症。而添加AhR配体后可促进Treg细胞分化,增加抗炎细胞因子(IL-10)分泌,抑制了Th17的分化,减少该细胞促炎症因子(IL-4、IL-10、TGF-β)的分泌。活化的AhR通过调控转录因子Foxp3和RORγt,以及通过JAK-STAT通路调节Treg和Th17之间的平衡。而有研究者认为,TCDD活化AhR后对Foxp3和RORγt的调控是通过抑制Foxp3的CpG岛甲基化,促进IL-17启动子区域甲基化,从而促进Treg的分化,抑制Th17的分化,维持Treg/Th17的平衡,从而减缓肠道炎症[24]。
6 小 结
近年来,关于AhR参与免疫调节尤其是肠道炎症调节的研究很多,本文简单综述了AhR参与肠道免疫的稳态平衡,缓解肠道炎症。AhR失活会加重IBD病人肠炎,而各类配体可激活AhR有助于激发下游调控基因表达。通过维护和发挥IELs和ILCs相关功能、保护肠黏膜上皮完整、增加抗炎因子、抑制促炎症因子从而缓解肠道炎症。
食物是AhR配体的最大来源,食物相关营养素如色氨酸、大豆异黄酮、花生四烯酸、槲皮素、黄芩素等均是AhR配体。这些配体进入肠道后与AhR结合,启动相关基因表达,从而调节肠道免疫。IBD病人多摄入蔬菜有助于缓解结肠炎,利于肠道健康。菌群代谢物如短链脂肪酸可调节AhR及其在肝脏及肠道中的靶点,而AhR信号通路可影响小肠菌群组成,从而调控肠道菌群平衡,维护肠道健康。因此,研究相关配体调控动物肠道炎症,受体、配体与肠道微生物之间的关系,可作为未来动物营养调控研究的方向之一。

